3种新型冠状病毒核酸检测试剂对120份样本检测结果的比较与分析
曾林子,田自城,黄玉兰,韩声付,肯 布,张光慧,贾春燕,杨小蓉
2019年12月,湖北省武汉市首先公开通报新型冠状病毒肺炎(COVID-19)疫情以来,全世界多个国家也相继报道了此类病例[1]。根据新型冠状病毒肺炎诊疗方案(试行第七版)规定,实时荧光RT-PCR检测新型冠状病毒核酸阳性为确诊病例的病原学金标准之一[2]。实时荧光RT-PCR技术具有结果直观、重复性好、特异性强、敏感性高和易操作等优点[3]。目前,具备国家医疗器械注册证的新冠病毒(SARS-CoV-2)核酸检测试剂(荧光PCR法)有多家,各种检测试剂盒对样本检测是否存在差异?检测机构应该如何选择新冠病毒核酸检测试剂?本研究选择其中3种新冠病毒核酸检测试剂对120份新冠肺炎病人和密切接触者的样本进行检测,对检测结果加以分析和比较,供检测机构参考。
1 材料与方法
1.1样本 随机选取120份新冠肺炎病人和密切接触者样本(样本包括同一新冠肺炎病人不同采集时间或者不同类型的样本),包括咽拭子60份(新冠肺炎病人51份,密切接触者9份)、唾液20份(新冠肺炎病人)、尿液20份(新冠肺炎病人)、粪便20份(新冠肺炎病人)。
1.2试剂 采样管采用江苏医疗用品采样公司生产的一次性使用病毒采样管。3种市售的核酸检测试剂盒分别为3个不同公司生产试剂,A试剂(批号:2019002)、B试剂(批号:20200123C)和C试剂(批号:2020017)。
1.3仪器 核酸提取采用Natch S全自动核酸提取系统(湖南圣湘生物科技股份有限公司),核酸扩增采用SLAN-96S荧光定量PCR仪(上海宏石生物科技股份有限公司)。
1.4 实验方法
1.4.1样本处理 将样本放置于56 ℃培养箱中30 min灭活。灭活后,对不同类型样本分别进行处理。
1.4.1.1咽拭子 充分混匀后吸取200 μL进行核酸提取。
1.4.1.2尿液 充分混匀后吸取200 μL进行核酸提取。
1.4.1.3唾液 加入400 μL病毒保存液,充分混匀后,吸取200 μL 进行核酸提取。
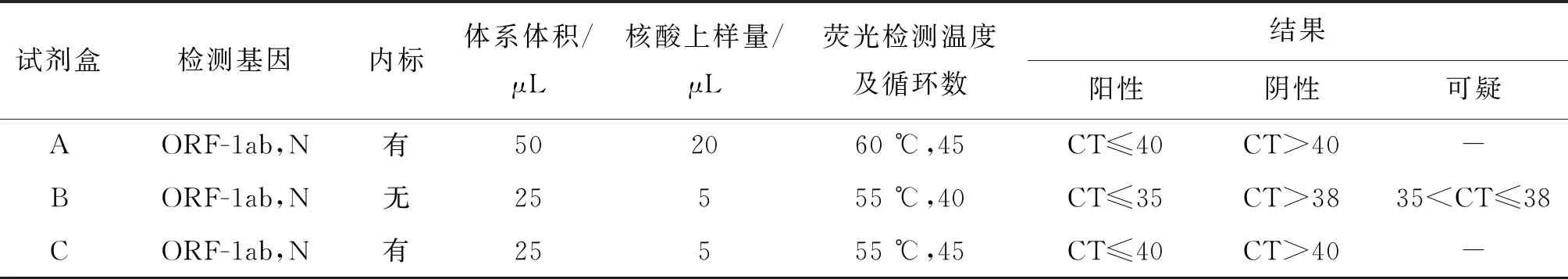
表1 3种试剂盒检测参数比较
1.4.1.4粪便 挑取黄豆粒大小的便标本加至50 mL离心管中,吸取2 mL TRIzol加至离心管中与粪便混匀,室温静置10 min,吸取600 μL上清液,5 000 r/min离心5 min,取200 μL上清液进行核酸提取。
1.4.2核酸提取 使用圣湘生物Nathch CS全自动核酸提取系统,严格按照仪器使用手册进行提取。
1.4.3核酸扩增 分别按照3个试剂厂家的检测说明书配置反应体系及设置相应的反应程序和检测荧光通道,同时设置阴性和阳性对照,反应结束后严格参照各试剂使用说明书进行结果判定。
1.4.4统计方法 使用SPSS 20.0软件对检测结果进行统计学分析,用χ2检验对检测阳性率进行差异性分析,P<0.05为差异具有统计学意义。通过计算Kappa值,分析检测结果的一致性:K<0.40,一致性较差;0.4≤K<0.75,一致性中等;K≥0.75,一致性较好。
2 结 果
2.1各种试剂基本情况 3种新型冠状病毒核酸检测试剂基本情况比较见表1。3种试剂均检测新冠病毒基因组中开放读码框1ab(open reading frame 1ab,ORF-1ab)和核衣壳蛋因(Nucleocapsid,N)。A试剂、B试剂和C试剂的最低检出限分别为200 copies/mL、1000 copies/mL和500 copies/mL,3种试剂核酸加样量、荧光检测和扩增循环数及结果判断有差异。本研究采用的标本类型为病人和密切接触者的咽拭子、粪便、尿液和唾液样本,3种试剂均适用。本研究仅针对各试剂相应批号。
2.2 3种试剂检测结果
2.2.1咽拭子检测结果 对60份咽拭子进行核酸检测结果为:A试剂所有样本的内标均检出,检出阳性41份,阴性9份,单阳性10份(均为N基因阳性),阳性检出率68.33%(41/60);B试剂检出阳性39份,阴性13份,单阳性8份(包括6份N基因阳性和2份1ab基因阳性),阳性检出率为65.00%(39/60);C试剂所有样本的内标均检出,检出阳性40份,阴性13份,单阳性7份(包括1份N基因阳性和6份1ab基因阳性),阳性检出率为66.67%(40/60),详细情况见表2。通过SPSS软件进行卡方检验,A试剂、B试剂和C试剂对咽拭子样本的阳性检出率无显著性差异(χ2=0.15,P>0.05)
2.2.2尿液检测结果 对20份尿液进行核酸检测结果为:A试剂所有样本的内标均检出,检出阳性3份,阴性4份,单阳性13份(均为N基因阳性),阳性检出率15.00%(3/20);B试剂检出阳性3份,阴性15份,单阳性2份(均为N基因阳性),阳性检出率为15.00% (3/20);C试剂所有样本的内标均检出,检出阳性3份,阴性11份,单阳性6份(均为1ab基因阳性),阳性检出率为15.00%(3/20)。3种试剂对尿液的阳性检出率相同,详细情况见表2。
2.2.3唾液检测结果 对20份唾液进行核酸检测结果为:A试剂所有样本的内标均检出,检出阳性2份,阴性14份,单阳性4份(均为N基因阳性),阳性检出率10.00%(2/20);B试剂检出阳性2份,阴性18份,阳性检出率为10.00% (2/20);C试剂所有样本的内标均检出,检出阳性2份,阴性16份,单阳性2份(均为1ab基因阳性), 阳性检出率为10.00%(2/20)。3种试剂对唾液的阳性检出率相同,详细情况见表2。
2.2.4粪便检测结果 对20份粪便进行核酸检测结果为:A试剂所有样本的内标均检出,检出阳性5份,阴性13份,单阳性2份(均为N基因阳性),阳性检出率25.00%(5/20),B试剂检出阳性3份,阴性13份,单阳性4份(包括3份N基因阳性和1份1ab基因阳性),阳性检出率为15.00% (3/20);C试剂所有样本的内标均检出,检出阳性5份,阴性14份,单阳性1份(1ab基因阳性),阳性检出率为25.00%(5/20),详细情况见表2。通过SPSS软件进行卡方检验,A试剂、B试剂和C试剂对粪便样本的阳性检出率无显著性差异(χ2=0.786,P>0.05)。
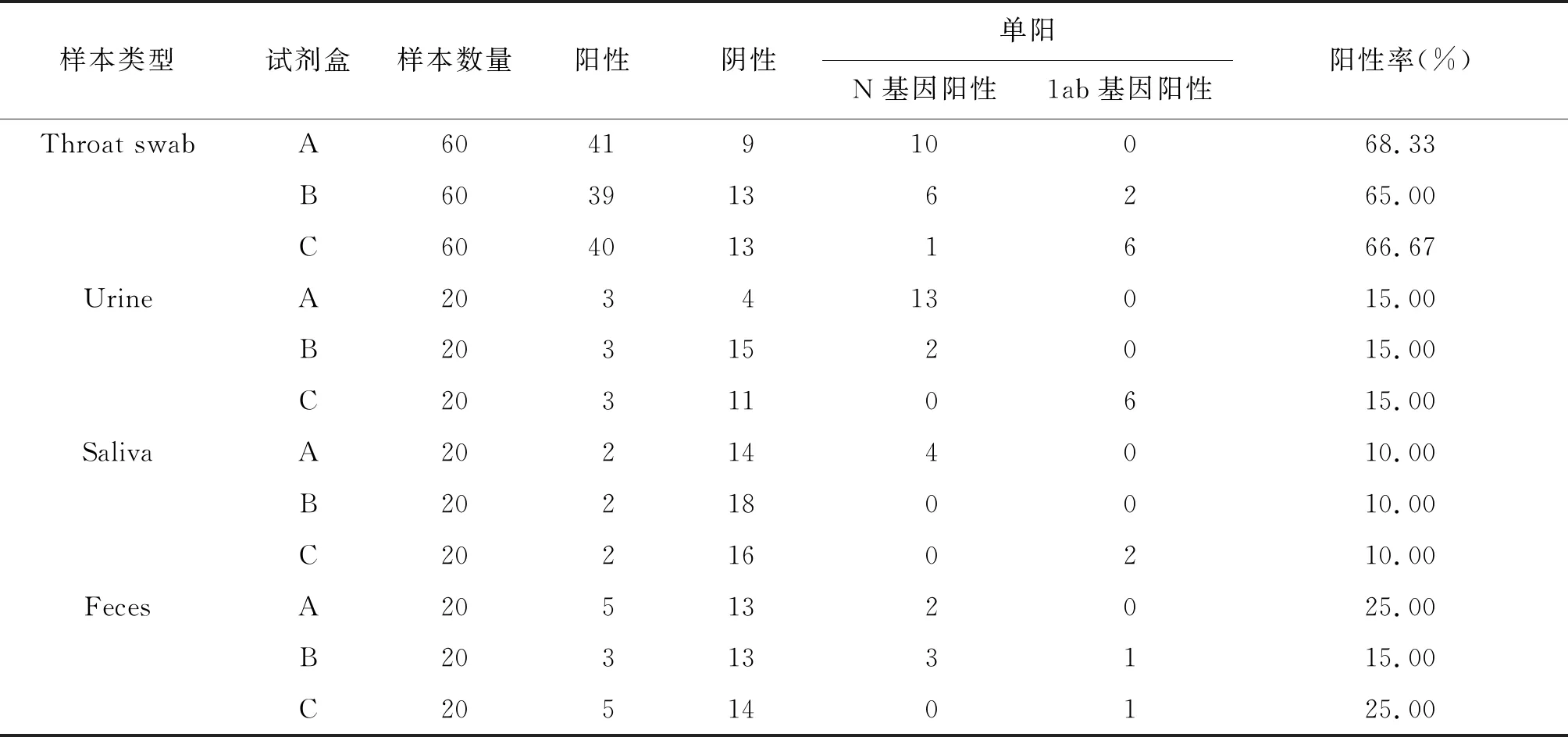
表2 四种样本检测结果
2.2.53种试剂检测总结果 对120份样本进行核酸检测结果为:A试剂所有样本的内标均检出,检出阳性51份,阴性40份,单阳性29份(均为N基因阳性),阳性检出率为42.50%(51/120);B试剂检出阳性47份,阴性59份,单阳性14份(包括11份N基因阳性和3份1ab基因阳性),阳性检出率为39.17%(47/120);C试剂所有样本的内标均检出,检出阳性50份,阴性54份,单阳性16份(包括1份N基因阳性和15份1ab基因阳性),阳性检出率为41.67%(50/120),详细情况见表3。通过SPSS软件进行卡方检验,A试剂、B试剂和C试剂的阳性检出率无统计学差异(χ2=0.298,P>0.05)。

表3 三种试剂检测结果
2.2.63种试剂检测结果一致性 120份样本中,3种试剂检测结果一致的样本数有89份,均为阳性的样本有43份,均为单阳的有6份,均为阴性的有40份,3种试剂检出结果有差异的样本有31份,3种试剂检测结果差异见表4。A试剂检出51份阳性样本中,B试剂检出阳性46份,另外5份为4份单阳(2份N单阳,2份1ab单阳)和1份阴性,C试剂检出阳性47份,另外4份结果为2份单阳(均为1ab单阳)和2份阴性。C试剂检出50份阳性样本中,B试剂检出阳性44份,另外6份均单阳(5份1ab单阳,1份N单阳),A试剂检出阳性47份,另外3份均为单阳(N单阳)。经Kappa检验,A试剂和B试剂检测结果基本一致(K=0.688),差异在于A试剂比B试剂更容易检测出单阳;A试剂和C试剂检测结果一致性较好(K=0.753);B试剂和C试剂检测结果基本一致(K=0.736)。一致性从高到低为:A试剂和C试剂>B试剂和C试剂>A试剂和B试剂。检测结果一致性比对见表5、表6和表7。
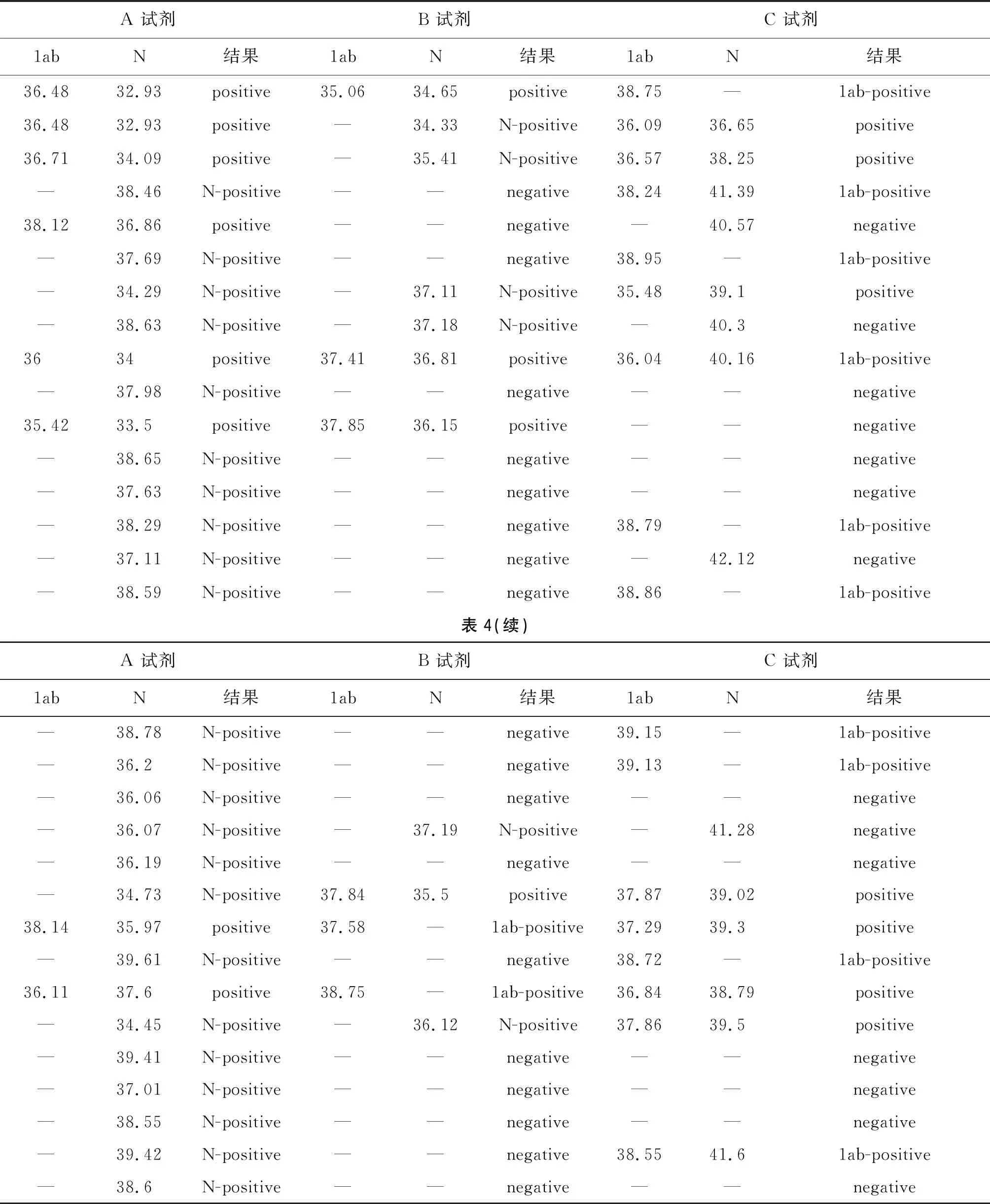
表4 三种试剂检测结果差异一览表

表5 A试剂和B试剂检测结果一致性对比

表6 A试剂和C试剂检测结果一致性对比
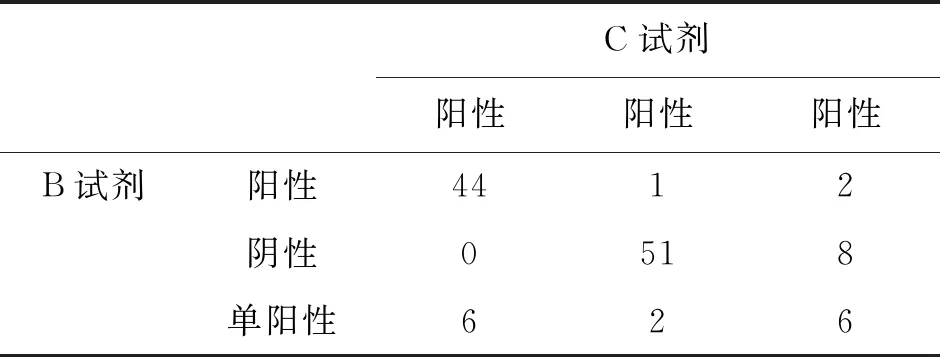
表7 B试剂和C试剂检测结果一致性对比
3 讨 论
本研究使用3种新型冠状病毒核酸检测试剂对120份样本进行检测,结果表明,3种试剂对同一批样本的阳性检出率无统计学差异,但是由于各试剂的检出限不同,阳性检出率也有不同,检出限越小的试剂,灵敏度越高,阳性率越高。A试剂、B试剂、C试剂的最低检出限分别200 copies/mL、1 000 copies/mL和500 copies/mL,本研究中,A试剂阳性率>C试剂阳性率>B试剂阳性率,与最低检出限吻合。
本研究结果显示,3种试剂盒检测结果差异较大的是单靶标阳性(1ab阳性或者N阳性)。A试剂的检测出的单阳最多(29份),均为N单阳;C试剂16份,以1ab单阳为主(15份);B试剂13份,以N单阳为主(11份)。分析原因,可能是各试剂厂家不同靶标基因位点的试剂检测敏感度不同,试剂中酶、金属离子等成分与质量有差异,扩增体系时加入的模板量不同,都能影响扩增效率和最后的检测结果[4-6]。A试剂的检出限低于B试剂和C试剂,同时可能由于A试剂中的N基因的检测灵敏度高于1ab,所以导致某些病毒载量较低的样本使用A试剂检测N单阳的结果较多,而C试剂中1ab的检测灵敏度高于N,从而以1ab单阳为主。单靶标阳性对结果的判读和病例的确诊带来了困扰,对此类标本要引起足够重视,判读时除了严格按照试剂盒说明书执行外,需要按照规范要求重新采集样本,重新提取核酸检测,如果仍然为单靶标阳性,判定为阳性;如果两种标本实时荧光RT-PCR同时出现单靶标阳性,可判定为阳性[7]。
本次研究中使用的3种新型冠状病毒核酸检测试剂,两种带有内源性内标,通过内标的检测,可以对标本采集、核酸提取及PCR扩增过程进行质量控制,避免人为造成检测结果假阴性[4-5,9]。对于检测中内标没有检出的样本,需要逐一排除问题,在确保PCR扩增和核酸提取都没有问题的情况下,应该再次采集样本重新检测。鉴于内标在检测中的质控作用,检测机构可选择带有内源性内标的试剂。除了内源性内标作为质控,湖北省临检中心的做法值得借鉴[10],在核酸检测过程设置“三阴一阳”作为质控,具体做法是每批检测设立1个弱阳性质控和3个阴性质控(生理盐水),3份阴性质控随机放在临床检测标本中。弱阳性质控测定为阳性,3份阴性质控全部测定为阴性,视为在控,反之,则为失控。
新冠病毒是一种新的病毒,对它的研究和认识还不够深入,目前,全国出现多例新冠患者核酸检测转阴后又复阳的情况,这可能与样本采集和运输有关系,也跟实验室的仪器设备和检测试剂等有关系。新冠病毒的检测试剂在极紧迫而短暂的情况下研制和生产出来,面对市面上出售的各种新型冠状病毒核酸检测试剂,各检测机构在条件允许的情况下,除了上述质控手段,还可采用试剂比对来确保实验室检测结果准确性,为新冠肺炎疫情的防控工作提供科学客观的数据支持。
利益冲突:无

