平喘颗粒对气道上皮细胞自噬及凋亡的抑制作用探讨∗
蒋鹏娜 王丽洁 李 星 李竹英
(黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040)
支气管哮喘是由包括气道炎性细胞和结构细胞(如嗜酸粒细胞、T淋巴细胞、气道上皮细胞等)在内的多种细胞和细胞组分参与的气道慢性炎症性疾病,具有高发病率和高死亡率的特点[1]。哮喘的病理生理状态研究较多的主要有:气道重塑、气道炎症、黏液蛋白过度分泌和氧化应激过度[2]。近些年来自噬在呼吸系统疾病中作用机制的不断被挖掘,许多学者证实了自噬主要通过调节基因[3]、氧化应激、T细胞免疫调节[4]、病毒侵袭[5]等多方面影响哮喘的发生、发展。笔者通过观察平喘颗粒含药血清对气道上皮细胞自噬及凋亡的影响,以探讨该药的作用机制。现报告如下。
1 材料与方法
1.1 实验动物
健康清洁级Wistar大鼠,48只雌雄各半,购于黑龙江中医药大学药物安全性评价中心,许可证号:SYXK(黑)2015-003,体质量(200±20)g,雌雄分笼饲养,自由饮食,在室温(22±2)℃、湿度(50±10)%条件下适应性喂养,观察大鼠在进食、饮水、二便、活动方面均无异常,1周后正式进行动物实验。
1.2 药物与试剂
平喘颗粒由淫羊藿、炙麻黄、黄芪、太子参、五味子、款冬花、地龙、罂粟壳、知母共9味药物组成,由黑龙江中医药大学附属第一医院制备,规格10 g/袋,批号20150102;人支气管上皮细胞(16HBE),购自上海中国科学院细胞库(CBP60550);胎牛血清(FBS)来自Sigma公司,雷帕霉素来自上海源叶生物公司,氯喹来自Sigma公司。
1.3 含药血清的制备
取健康清洁级Wistar大鼠,平喘颗粒连续给药3 d(将平喘颗粒稀释至0.54 g/mL,每次按1 mL/100 g灌胃),末次给药前禁食12 h,给药2 h后麻醉,腹主动脉取血,采血后静置30 min,常规分离血清,56℃水浴灭活补体30 min,过滤器过滤,密封,-20℃冰箱保存备用。通过实验发现当含药(平喘颗粒)血清浓度为20%时[9],对雷帕霉素诱导的16HBE细胞有较明显的抑制作用,故实验中选用该浓度。
1.4 细胞分组、加药及收集
取对数生长期的16HBE贴壁细胞,调整细胞浓度为2×105个/mL,将细胞按照常规方法接种于细胞培养皿中,在显微镜下细胞密集度达到70%时,将细胞分为正常培养基细胞组(正常对照组)、雷帕霉素组、雷帕霉素加氯喹组、雷帕霉素加中药组。将雷帕霉素组、雷帕霉素加氯喹组、雷帕霉素加中药组分别加入雷帕霉素800 μL,对照组加入等量的DMEM不完全培养液,放入培养箱中诱导12 h后弃去各组培养基,重新将正常对照组、雷帕霉素组分别加入800 μL DMEM不完全培养液,雷帕霉素加氯喹组加入800 μL氯喹溶液,雷帕霉素加中药组加入800 μL含中药血清,再次放置细胞培养箱中24 h。弃去各组培养液,常规消化细胞,分别刮取收集各组细胞,保存至1.5 mL离心管内。
1.5 电镜下观察细胞自噬
弃去培养液,常规消化细胞,刮取细胞,分别收集各组细胞,用戊二醛固定后,按照电镜操作流程处理细胞后观察各组细胞自噬情况。
1.6 流式细胞仪测定细胞凋亡情况
收集培养的细胞,调成密度为5×105个/mL,按照操作流程进行流式细胞检测,Anneexin V-FITC为绿色荧光,碘化丙啶(PI)为红色荧光,在流式细胞仪的散点图上,正常的活细胞不被Anneexin V-FITC和PI染色;凋亡早期的细胞仅被Anneexin V-FITC染色,PI染色呈阴性;坏死细胞和凋亡晚期细胞可以同时被Anneexin V-FITC和PI染色。散点图的左上象限是可允许范围内的检测误差。
1.7 Westen blotting方法检测细胞中自噬效应蛋白-1(Beclin-1)、Caspase-3蛋白表达
将准备就绪的各组细胞按照BCA蛋白浓度检测说明书进行测定,利用酶标仪读取OD值,在蛋白定量后用还原样品加热,使蛋白变性,电泳、湿转、封闭、一抗孵育、二抗孵育及胶片曝光、定影等过程同胶片扫描后分析结果。检测各组细胞中自噬相关基因蛋白Beclin-1、Caspase-3的表达水平,并对其条带灰度值进行定量分析。
1.8 统计学处理
应用SPSS20.0统计软件。计量资料以()表示,组间比较用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 电镜检测结果
2.1.1 雷帕霉素诱导12 h 16HBE观察 见图1。正常对照组中细胞核染色质丰富且均匀,可清晰见到线粒体及完整峭结构,细胞整体形态良好;经自噬诱导剂雷帕霉素作用后,其余3组中部分细胞内可见单层膜结构的自噬泡,内含细胞器肿胀变形,部分线粒体空泡化,峭开始溶解。

图1 各组12 h 16HBE电镜结构图(25 000倍)
2.1.2 雷帕霉素诱导后加药物干预电镜观察 见图2。正常对照组中细胞基本结构及形态完好,细胞核染色质丰富、分布均匀,胞内可见内质网及线粒体,峭较完整;加氯喹干预后24 h,细胞结构基本正常,可见自噬泡,少量线粒体出现峭溶解断裂;加中药血清干预后24 h,细胞基本形态较好,可见到自噬泡和线粒体,其中线粒体峭较完整。由图可见,经雷帕霉素诱导的细胞内改变了正常基本结构,出现了线粒体肿胀,甚至溶解、空泡化。而分别在氯喹和含药血清干预已自噬的细胞后,其内部超微结构均明显改善,细胞活力增加,说明由雷帕霉素引起的自噬在氯喹或者中药平喘颗粒的干预下可以得到抑制或者改善,从而对细胞起到保护作用。
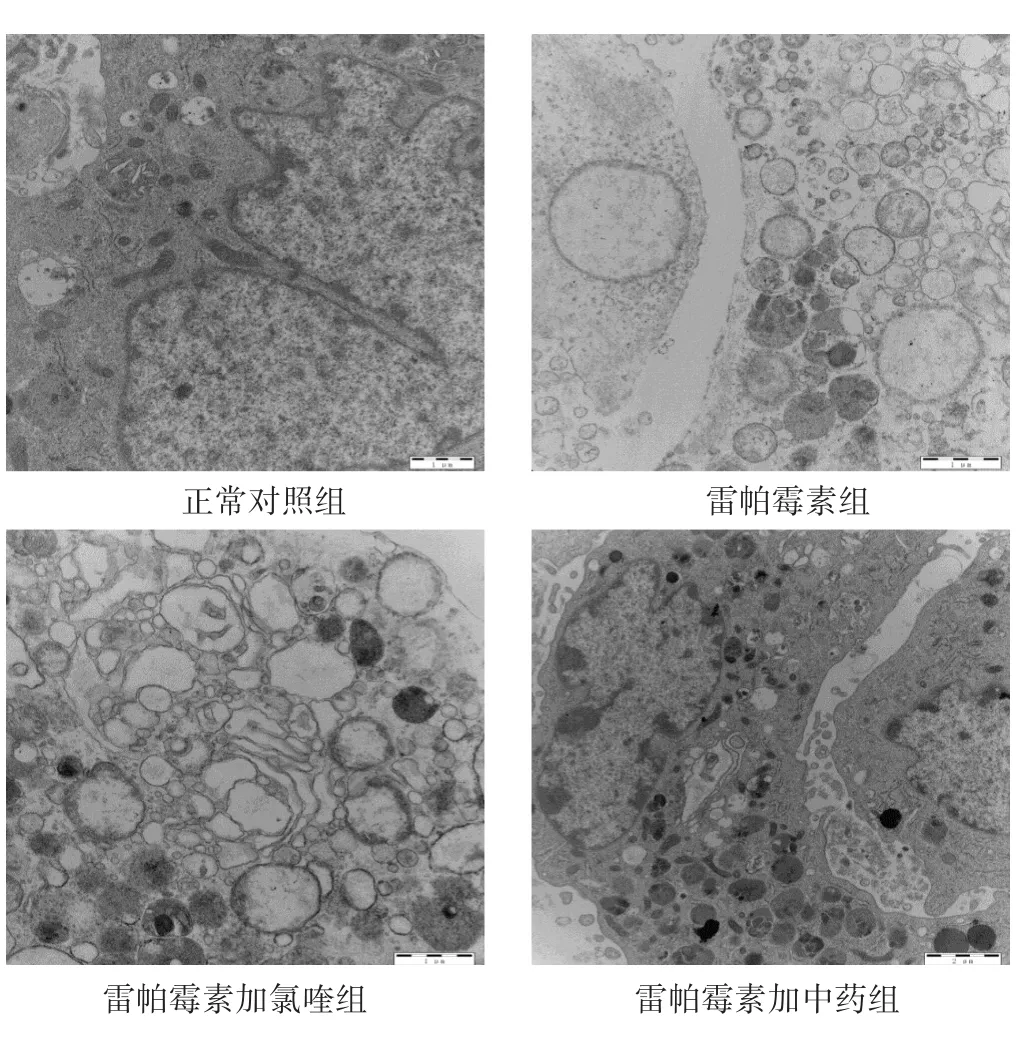
图2 各组细胞电镜结构图(25 000倍)
2.2 各组细胞凋亡情况比较
见表1,图3。经雷帕霉素诱导后,16HBE细胞的早期凋亡率和晚期凋亡率均增加(P<0.05)。而经氯喹阻断后,细胞晚期凋亡率明显下降(P<0.05),而早期凋亡率下降不明显(P>0.05),总凋亡率也呈下降趋势(P<0.05)。经平喘颗粒干预后,细胞早期凋亡率变化也不明显(P>0.05),晚期凋亡率明显下降(P<0.05),总凋亡率也呈下降趋势(P<0.05)。
表1 各组细胞凋亡率比较(%,±s)

表1 各组细胞凋亡率比较(%,±s)
与正常对照组比较,∗P< 0.05,∗∗P< 0.01;与雷帕霉素组比较,△P<0.05,△△P<0.01。下同
组别正常对照组雷帕霉素组雷帕加氯喹组雷帕加中药组n 6 6 6 6早期凋亡率6.135±0.422 10.125±0.635**14.581±1.232**10.056±1.114**晚期凋亡率9.123±0.307 26.843±2.136**12.426±1.667**△△17.011±1.606**△△总凋亡率16.012±0.823 35.266±2.736**26.758±2.697**△△26.903±2.792**△△
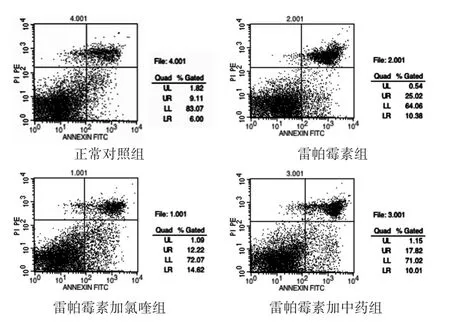
图3 各组细胞凋亡流式检测结果
2.3 各组Beclin-1、Caspase-3蛋白表达的比较
见表2,图4。结果显示,雷帕霉素组和雷帕加氯喹组Beclin-1、Caspase-3的表达较正常对照组显著增高(P<0.05或P<0.01),其中雷帕霉素组上述指标的表达较雷帕加中药组增高(P<0.05)。在雷帕霉素诱导的细胞自噬和凋亡中,自噬和凋亡二者相互促进,Caspase-3蛋白表达增加,而氯喹和中药平喘颗粒组Caspase-3蛋白表达受抑制。
表2 各组Beclin-1、Caspase-3蛋白表达的比较(±s)

表2 各组Beclin-1、Caspase-3蛋白表达的比较(±s)
组别正常对照组雷帕霉素组雷帕加氯喹组雷帕加中药组n 6 6 6 6 Beclin-1 GAPDH 0.61±0.33 0.82±0.37**0.71±0.29*△△0.43±0.30**△△Caspase-3 GAPDH 0.46±0.27 0.97±0.30**0.55±0.22*△△0.54±0.25*△△

图4 各组细胞自噬相关基因蛋白的表达
3 讨论
刘建秋教授根据多年治疗哮喘慢性持续期或者缓解期的经验,总结出了“见痰不治痰,重用温药,既化饮又给邪以出路,补中有消,温中有行,开中有阖”的学术观点。平喘颗粒为黑龙江中医药大学院内制剂,由淫羊藿、炙麻黄、黄芪、太子参、五味子等9味药物组成。前期临床研究表明平喘颗粒用于慢性持续期的阳虚痰盛证哮喘患者治疗效果尤佳,亦可用于具有相同症状的其他咳喘病[6-7]。在前期平喘颗粒药效学研究中该药物可促进小鼠气管酚红的排泄量和促进呼吸道上皮纤毛运动,促使痰液稀释并发挥排痰的作用[8]。也有研究表明哮喘发病时引起气道上皮细胞和平滑肌细胞的内质网应激反应,而结局则是以细胞重回内质网稳态、细胞自噬或细胞凋亡等形式结束[9]。气管上皮细胞的新陈代谢中自噬与凋亡是细胞死亡的一种方式,自噬可以促进凋亡发生,又可以通过提供营养和能力发挥防御作用,抑制凋亡或者延迟凋亡,而在调控方面,二者又可独立发挥作用,导致细胞死亡[10]。Beclin-1作为自噬的直接执行者,不仅可促进自噬吞噬体形成[11],增加自噬发生[12],同时参与上皮细胞凋亡[13]。刘娟等提出在哮喘患者中Beclin-1可能同时参与上皮细胞凋亡和自噬的过程,调控炎症细胞因子的表达,缓解哮喘的急性发作与慢性病程[14]。Caspases又称凋亡蛋白酶,Caspase-3处于两条凋亡信号通路的中心位置,通过介导特异性肽键,引起凋亡级联反应[15-16],执行细胞最终凋亡过程[17]。国内研究表明在婴幼儿喘息性疾病的研究中[18],嗜酸性粒细胞中的凋亡因子Caspase-3活性降低,抗凋亡Bcl-2基因表达增多,在两者共同作用下导致嗜酸性粒细胞凋亡减缓,使得患儿外周血中嗜酸性粒细胞相对增多。
本实验用雷帕霉素[19]诱导16HBE细胞自噬,通过电镜发现自噬的标志性结构-自噬泡的存在,还观察到凋亡细胞,并用流式细胞仪检测细胞凋亡的情况,其结果均明显出现自噬和凋亡指征,凋亡率明显增加,自噬泡及溶酶体增多,凋亡标志蛋白酶Caspase-3/Beclin-1表达均显著增加,而应用自噬抑制剂氯喹和中药平喘颗粒后,凋亡率、自噬数量、Caspase-3、抑凋亡蛋白Beclin-1表达均明显下降。实验证实雷帕霉素激活气道上皮细胞自噬途径后,平喘颗粒有类氯喹作用,在哮喘发病的自噬过程中对病变细胞的凋亡与自噬起抑制作用,且此过程中凋亡与自噬二者呈正相关。
——雷帕霉素

