石榴石型固态电解质表界面问题及优化的研究进展*
张念 任国玺 章辉 周櫈 刘啸嵩2)3)†
1) (中国科学院上海微系统与信息技术研究所, 功能材料国家重点实验室, 上海 200050)
2) (天目湖先进储能技术研究院, 溧阳 213300)
3) (上海科技大学物质学院, 上海 201210)
随着对能源存储设备输出和安全性能等方面需求的不断提升, 全固态电池展示了替代传统液态锂离子电池占据新能源市场的潜力. 石榴石型Li7La3Zr2O12 固体电解质具有高离子导率且对于锂金属稳定, 是最受人瞩目的固体电解质材料之一. 但是, 固-固界面不良接触导致的巨大界面电阻以及由于锂的不均匀沉积和分解导致的锂枝晶生长等问题严重阻碍了全固态电池的发展. 本综述针对石榴石型全固态电池突出的界面问题, 详细论述了Li7La3Zr2O12 表面碳酸锂问题的研究现状; 讨论了锂金属负极和固态电解质的界面浸润性以及锂枝晶生长问题, 给出了构建理想界面的关键因素; 阐述了优化正极与石榴石型固体电解质界面的具体方法以及改善界面润湿性的思路. 本文还展望了未来石榴石型全固态锂离子电池可能的发展方向, 为全固态锂离子电池的发展和应用提供了借鉴.
1 引 言
近年来, 可充放锂离子电池的快速发展为包括手机、笔记本电脑等消费电子产品带来了革命性的进步, 并且使插电式混合和全电新能源汽车成为可能. 作为最重要的储能装置, 锂离子电池在发展国民经济、减少碳排放、降低对石油等化石能源的依赖、解决环境污染等方面意义重大. 面对应用领域,特别是新能源汽车市场进一步拓宽的强劲需求, 锂离子电池技术还需要在性能方面得到进一步提升.
要进一步提高动力电池的能量密度和稳定性,常见的高镍三元正极+硅碳负极锂离子电池很难有所突破[1,2], 其能量密度难以超越350 Wh/kg,且采用易燃的液态有机电解质, 高集成下安全性存在巨大隐患. 目前, 有至少4 种可以替换硅碳负极的新材料受到了广泛的关注, 分别是热解多孔碳、合金负极、转换型负极以及锂金属负极[3-7], 其中, 锂金属负极拥有超高的理论能量密度(3860 mAh/g)、低密度和最低的化学势(0 V vs Li+/Li)等优点,成为最佳的候选材料. 然而, 用有机液态电解质组成的锂金属电池存在巨大安全隐患, 电极表面存在微米尺度下的锂电镀不均匀, 诱发锂枝晶的生长,刺穿聚合物隔膜或者严重损坏电极导致电池短路甚至起火爆炸[8,9], “死”锂的形成也会导致容量不可逆地衰减并破环循环稳定性[10-12]. 针对上诉问题, 全固态锂离子电池(ASSLIBs)成为近几年研究的热点, 无机固态电解质不可燃、无腐蚀、不挥发、不漏液, 具有极高的安全性[13], 搭载全固态锂电池的新能源汽车自燃概率会大大降低. 同时, 极其致密的固态电解质极大地抑制了锂枝晶现象,且对于金属锂稳定[14], 使得锂金属电池的研发成为了可能. 然而, 固态电解质低的锂离子传导能力和巨大的界面电阻严重抑制了全固态电池的发展.
目前, 全固态电池中研究较多的无机固态电解质主要包括LISICON 型[15,16], NASICON 型[17], Garnet 型, Perovskite 型[18], Thio-LISICON 型[19], Argyrodite 型[20]等晶态和LiPON[21]以及P2S5基硫化物[22]等非晶态电解质. 其中, 立方相Garnet 型锂镧锆氧(Li7La3Zr2O12, 以下简称LLZO)因在室温下具有高达2 × 10—4S/cm 的离子导率, 掺杂后可以达到10—3S/cm, 克服了传统固态电解质离子导率差的缺点, 并且对于金属锂稳定, 受到了最广泛的关注和研究[23-25]. 目前, 可以通过在正极/LLZO界面添加少量的液态或者聚合物电解质得到稳定循环的混合固态电池或准全固态电池[26,27]. 然而,为了真正实现全固态电池的目标, 决定性的挑战依然存在于固态电解质与两极接触的界面上, 主要为以下三个方面: 1) LLZO 材料本身十分坚硬, 暴露空气后在表面会形成碳酸锂, 导致其界面处与两极材料多为点接触且浸润性差, Li+在界面处输运能力弱, 产生了巨大的界面电阻[5,28]; 2) 界面处电流密度的不均匀分布, 促使锂分解和沉积的不均, 枝晶依然会沿着晶界进行生长, 刺穿固态电解质, 使电池发生短路[29]; 3) LLZO 对于金属锂和常规正极材料并没有计算中稳定, 两者若直接接触依然会在高温或者电化学条件下发生副反应, 副产物在界面的积累会破坏电池的循环性能[27,30]. 因此, 深入研究界面反应和优化机理, 对进一步提升全固态电池性能至关重要.
本综述将结合上述的固态电解质中存在的三个问题, 系统地总结锂镧锆氧固态电解质表界面问题及优化的最新研究进展, 并穿插介绍最新的表界面表征技术在固态电池研究中的应用.
2 LLZO 固态电解质空气稳定性及表面碳酸锂问题
起初, 研究人员认为LLZO 固态电解质在空气中是稳定的, 然而Cheng 等[31]发现LLZO 在空气中存放两个月后其界面阻抗显著提升. 结合扫描电镜(SEM)、X 射线衍射(XRD)、X 射线光电子能谱(XPS)和X 射线吸收谱(XAS)等多种表征手段的研究表明, LLZO 暴漏空气后会在表面以及晶界处生成一层污染的Li2CO3层, Li2CO3本身离子导率差(约10—8S/cm)且对于金属锂的浸润性差,是导致界面阻抗提升的根本原因. 密度泛函理论(Density Functional Theory, DFT)计算显示, Li金属对于Li2CO3和LLZO 界面的黏附功函数分别为0.1 和0.67 J/m2, 对应的接触角为142°和62°, 并且当LLZO 表面沉积了Li2CO3层后, 通过简单的干式抛光或者湿式抛光都不能显著改善界面的浸润性, 如图1 所示[32]. 随着研究的进展, 碳酸锂的存在也越来越受到人们的重视[33]. 研究表明, 即使是纳米尺度的碳酸锂, 也会导致界面阻抗数量级的提升, Xia 等[34]报道称Al 掺杂的LLZO固态电解质暴露空气3 个月后, 离子导率从1.81 ×10—4显著降低到2.39 × 10—5S/cm. 后续研究发现,碳酸锂污染是难以避免的, LLZO 表面的质子化交换有可能在烧结降温的过程中就已经发生了[35].想要有效抑制消除碳酸锂的影响, 就需要从根本上理解LLZO 表面碳酸锂的形成机制.
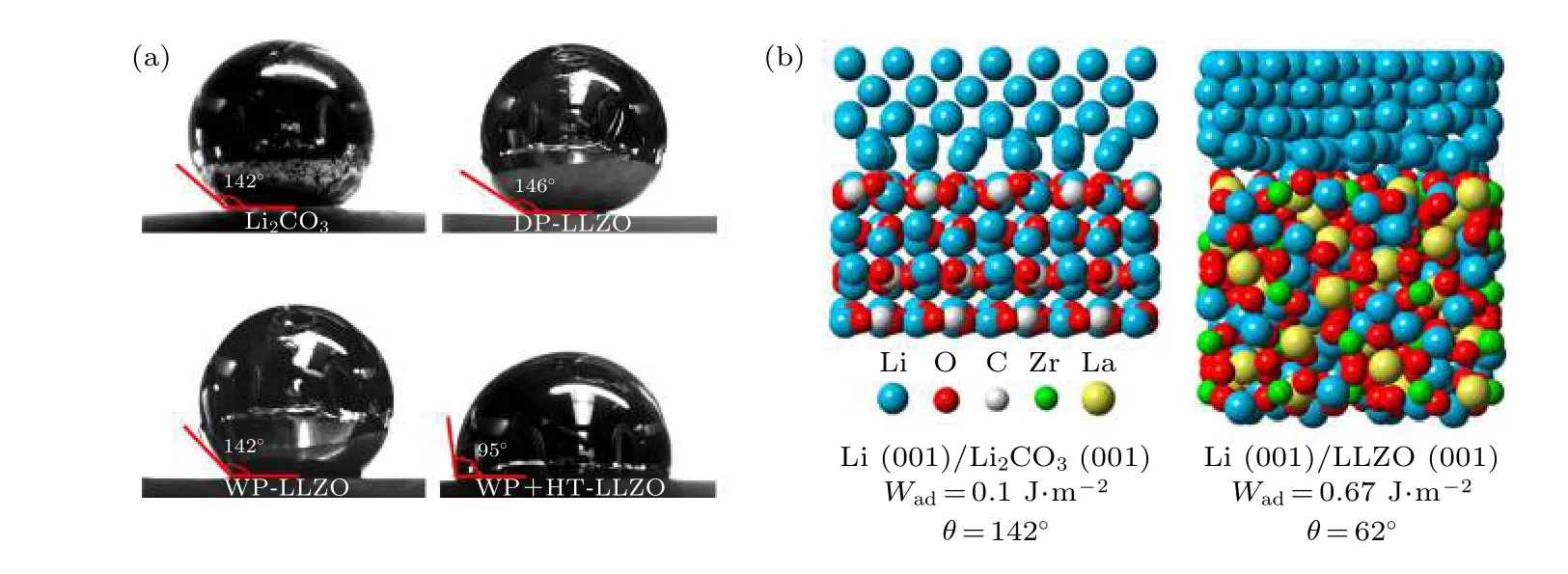
图1 (a) 熔融的金属锂在各种界面上的浸润角; (b) 计算得到的Li—Li2CO3 和Li—LLZO 界面的附着功(Wad)、接触角(θ)以及原子结构[32]Fig. 1. (a) The contact angle of molten metallic Li on different surfaces; (b) calculated work of adhesion (Wad), contact angle (θ),and atomic structure for the Li—Li2CO3 and Li—LLZO interfaces[32].
对于碳酸锂的形成, 有研究认为其会直接与空气中的CO2发生反应[36], 即Li7La3Zr2O12+xCO2→Li7—2xLa3Zr2O12—x+xLi2CO3, DFT 计算显示该反应在热力学上自发进行的趋势很大, 然而实验观测到其动力学上反应速率却很小, 在干燥的空气中, LLZO表面仅有很少量的Li2CO3生成[37]. 因此, 更被广泛接受的是两步反应路径: Li7La3Zr2O12+xH2O→Li7—2xLa3Zr2O12—x+2xLiOH; 2LiOH+CO2→Li2CO3+H2O[37,38]. 自发的Li+/H+交换作用在石榴石型材料如Li5La3M2O12(M=Nb, Ta) 和Li7La3M2O12(M=Zr, Sn)中被发现是广泛存在的[39,40], 但是这种交换作用并不会破坏立方相的晶格结构, 只会降低锂离子的输运能力[38,41]. Sharafi 等[37]提出Li+/H+交换后生成Li55HLa24Zr16O96所需的反应能更低,即真实反应路径应为: Li56La24Zr16O96+H2O(g)→Li55HLa24Zr16O96+LiOH, 2LiOH+CO2(g)→Li2CO3+H2O(g), 具体各步反应能计算结果如表1 所列. 因此, 到目前为止LLZO 表界面在空气中化学组分的衍变以及碳酸锂形成的真实反应路径和机理尚不清楚, 急需发展原位的界面深度表征技术,可以在反应气氛下对LLZO 表面乃至内部实时进行化学成分以及电子结构演变分析.
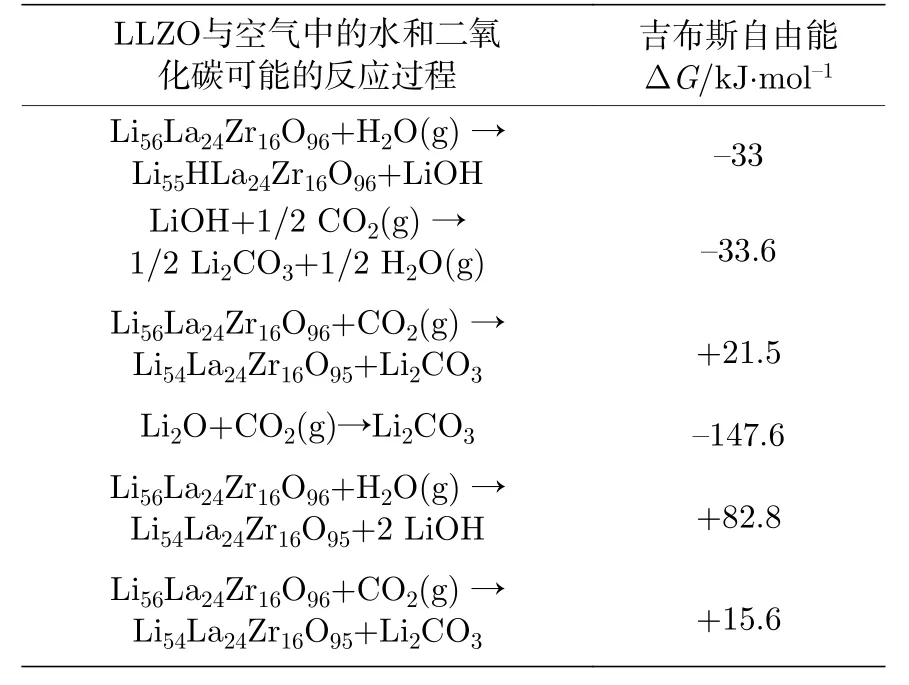
表1 计算得到的在298.15 K 下LLZO 发生水合以及碳酸化反应所需的吉布斯自由能, 其中, 前4 项是反应过程中有Li+/H+交换作用对应的能量,后2 项为直接反应对应的能量[37]Table 1. Calculated Gibbs free energy for the hydration and carbonation of LLZO at 298.15 K. The first 4 reactions involve Li+/H+ ion exchange and the last 2 reactions assume direct hydration and carbonation of LLZO[37].
想要找到抑制或者消除碳酸锂的方法, 还需要知道碳酸锂在表面的结构和分布. 最近, Liu 等[42]结合中子和电子谱表征手段, 证实了Li+/H+交换作用的存在, 并发现即使将LLZO 在0.01 M 的硝酸中浸泡30 min, 使得Li+/H+交换达到75%, 依然不会破坏LLZO 的结构骨架. 该研究表明碳酸锂很可能不是破坏了LLZO 的晶格结构进而向LLZO 内部生长, 而是在表面以及晶界内形成并堆积. Sharafi 等[37]采用氩离子刻蚀结合光电子能谱对暴漏空气后LLZO 表面成分进行了厚度分析, 发现表面纯的碳酸锂和碳氢化合物层只有5—10 nm,在深度不到80 nm 的位置就发现大量未反应的LLZO 存在. 我们课题组[43]利用同步辐射吸收谱全电子产额模式(TEY~10 nm)和全荧光产额模式(TFY~100 nm)探测深度的不同, 观测到在与空气反应相比陶瓷片更加剧烈的LLZO 粉末样品中, 长期暴漏空气后在TEY 模式的探测深度内全部是碳酸锂的信号, 而TFY 模式下依然可以探测到LLZO 的信号, 说明对于颗粒来说, LLZO 表面碳酸锂的积累厚度难以完全超越100 nm. 因此,LLZO 表面碳酸锂的分布更趋向于一个球壳模型,内部是LLZO, 表面是一层百纳米级别的Li2CO3(可能还含有LiOH)包覆层, 在内部LLZO 与Li2CO3接触的界面层, 还可能存在一层因为Li+/H+交换作用而形成的LHLZO 层.
如何才能解决LLZO 表面碳酸锂的问题进而改善界面接触成为了当下研究的热点之一. 如果碳酸锂如上所述是向外部堆积, 那么提高陶瓷片的致密度(相对密度>99%)可以有效减少内部孔隙, 进而抑制体相碳酸锂的形成. 但是想制备出高密度的LLZO 块还是十分困难的, 需要对粉末的颗粒度有很好的把控, 同时, 高温烧结还极易导致表面的锂损失. 此外, 常用的Al2O3坩埚在高温下可以与Li2O 和Li2CO3发生反应, 生成Li-Al-O 杂质进而阻碍锂离子的传输[44]. 目前, 用石墨模具以及铂金坩埚替代Al2O3坩埚可以有效避免含Al 杂质带来的污染, 提升致密度并可以提高材料的空气稳定性, 如图2(a)所示[34].
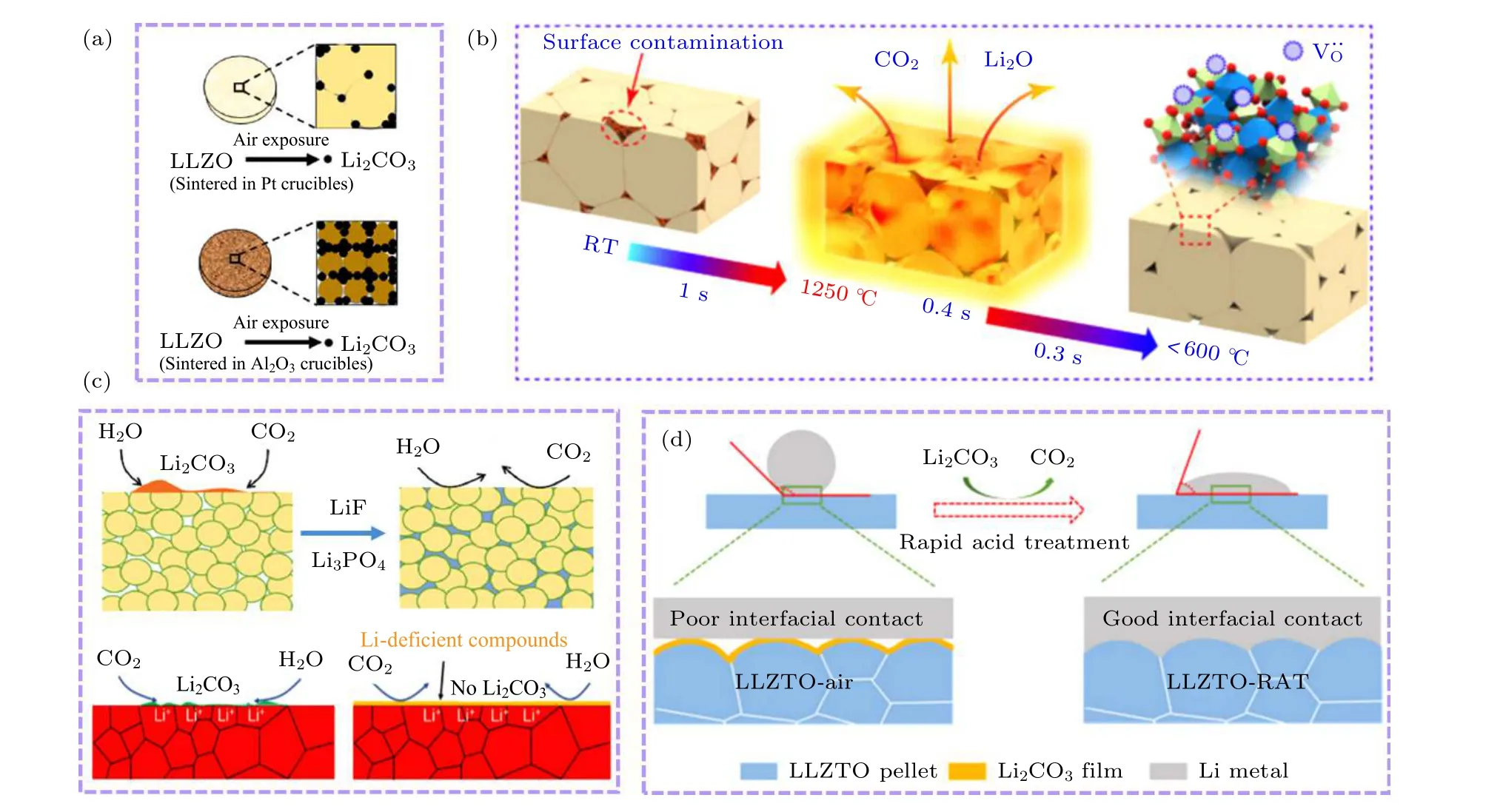
图2 (a) 利用铂金坩埚代替传统Al2O3 坩埚可以有效减少暴露空气后LLZO 表面碳酸锂的形成[34]; (b) 利用快速热脉冲的处理方法可以有效去除碳酸锂, 并且使得锂损失最小化[48]; (c) 通过添加LiF, Li3PO4 等疏水添加剂, 或者在表面制造缺锂层, 都可以有效抑制碳酸锂的形成[33,51]; (d) 通过快速酸处理可以除去表面碳酸锂, 得到稳定接触的界面[52]Fig. 2. (a) Using Pt crucible instead of alumina crucible can effectively reduce the Li2CO3 formation on LLZO after exposed to air[34]; (b) the rapid thermal pulsing treatment can effectively remove the Li2CO3 impurity and minimize Li loss[48]; (c) adding inorganic additives such as LiF and Li3PO4, or creating Li-deficient compounds on the surface can eliminate Li2CO3 contaminants[33,51];(d) improving Li/LLZO interface contact by removing Li2CO3 via rapid acid treatment[52].
要想除去LLZO 表面的碳酸锂, 可以在材料合成后对其进行二次处理. 打磨抛光的方法不能完全去除LLZO 表面特别是位于晶界中的碳酸锂,同时, 还会在打磨的过程中引入砂纸上的其他杂质. 高温退火是另外一种方法, 然而, 碳酸锂的分解温度在750 ℃以上, 高温会导致LLZO 表面锂损失和界面副反应的发生, 在表面形成其他相阻碍锂离子的传输[45], 因此, 降低二次处理的烧结温度是十分重要的. Goodenough 课题组[46]将C 涂抹到LLZO 片上在氩气中700 ℃进行烧结, 得到了良好的亲锂性界面. Sharafi 等[32]将LLZO 片湿磨后在500 ℃进行退火得到了良好的LLZO 固有界面. Cheng 等[47]提出碳酸锂是因为表面Li+/H+交换作用后形成的, 该交换作用在250 ℃的时候是可逆的, 因此, 在保护气氛下250 ℃进行退火即可以显著减少碳酸锂. 如果不降低退火温度, 降低退火时间也是有效的, Wang 等[48]开发出了一套快速退火的装置, 可以将LLZO 陶瓷片在1 s 的时间内快速升温到1250 ℃, 然后保温0.4 s, 再用0.3 s快速降到600 ℃以下, 如图2(b)所示, 该方法也可以有效减少碳酸锂并避免副反应的发生.
此外, 研究人员发现使用添加剂、进行界面构造以及快速的酸处理也可以抑制或者除去碳酸锂,如图2(c)和图2(d)所示. LiF 和Li3PO4因其良好的疏水性, 可以有效防止LLZO 与空气中的水接触, 被广泛用作掺杂材料. Goodenough 课题组[49]报道了添加2%质量分数的LiF 到Ta 掺杂的LLZO 中可以显著抑制碳酸锂的形成. Xu 等[50]报道Li3PO4的掺入, 不仅抑制了碳酸锂的形成, 还可以抑制电化学过程中锂枝晶的生长. Wu 等[51]发现在900 ℃高温退火可以形成一个缺锂层, 该层的存在可以有效抑制碳酸锂的形成, 也能同时构造一个亲锂的界面. Huo 等[52]报道了通过快速酸处理能有效去除掉LLZO 表面的碳酸锂, 即使是暴露在空气中一个月的LLZO 片, 用1 M 的盐酸进行30 s 的处理也可以将其完全去除, 不过处理时间不宜过长, 过长会导致LLZO 片的碎裂.
总体来说, 碳酸锂问题对于LLZO 是不可忽视的, 其深刻影响到电解质中的离子传输、与两极的界面接触以及枝晶生长等固态电池中的关键问题. 然而, 目前其真实形成机理还不明确, 需要开发强有力的研究手段对其进行原位研究, 才能从根本上找出抑制其形成的方法, 弥补现有方法中的不足.
3 LLZO 固态电解质与锂金属界面优化及锂枝晶问题
锂金属负极拥有超高的理论能量密度(3860 mAh/g)、低密度和最低的化学势(0 V vs Li+/Li)等优点, 被认为是高能量密度可充放电池负极的终极目标. 但是, 用常规的液态或者聚合物电解质组装的锂金属电池, 金属锂会与电解质发生反应, 生成固态电解质界面(solid electrolyte interphase, SEI)膜, 电流分布不均匀导致的枝晶生长一直是一个难以解决的问题[53]. 固态陶瓷电解质LLZO 等, 凭借它们高的机械强度和高的锂离子迁移数, 被认为可以有效抑制锂枝晶的生长, 使得锂金属电池成为可能. 然而, 众多最新的实验结果表明, 由于LLZO材料本身的坚硬性, 其与金属锂界面多为点接触,导致了巨大的界面电阻. 同时, 固态电解质非但没有抑制锂枝晶的生长, 反而使枝晶的生长比在传统液态锂离子电池中更加迅速[4,54-56].
为了改善界面接触并抑制锂枝晶生长, Sharafi等[30]和Tsai 等[55]最先尝试了利用高压和加热的方法改善界面接触并提高界面的Li+传输能力, 但是实验条件苛刻难以应用到真实电池上. 2016 年起, 研究人员开始致力于用添加缓冲层的方法降低界面电阻并提高与锂金属电极的浸润性, Hu 课题组先后报道了通过添加Au, Ge, Si 等缓冲层材料,利用合金化反应将Li 金属与LLZTO 的接触电阻由1960 Ω/cm2分别降低至32, 14 和5 Ω/cm2, 界面电流的均匀化使得临界电流密度也得到了一定的提升, 原理如图3(a)所示[5,57]. 但是, 当电流密度高于临界电流密度时, 枝晶依然会刺穿固态电解质, 发生短路. 要想更好地抑制锂枝晶的生长, 就必须知道枝晶在固态电解质中生长的本质原因.
中子深度分析技术(neutron depth profiling,NDP)是一种无损的探测技术, 因其可以观测到样品中不同深度的Li 分布而被广泛应用于固态电池中, 例如Li+/H+交换作用以及锂枝晶的研究中[42,58].Han 等[58]利用该技术原位研究了电化学过程中锂的深度分布, 如图3(b)所示, 揭示了高的电子导率是固态电解质中锂枝晶形成的根本原因. 对于LLZO 来说, 最新的研究发现, 其电子导率在电化学过程中可以从1.2 × 10—7S/cm 提升至1.1 ×10—6S/cm, 是其临界电流密度不高的重要原因[59].Wang 等[60]通过计算指出: 一个拥有高的离子导率、低的电子导率并且热力学不稳定但动力学稳定的材料才是最理想的缓冲层材料. 我们课题组[61]率先选择MoS2作为缓冲层材料改善Li/LLZO 界面, 利用电化学过程中原位转化反应将界面电阻降低到了14 Ω/cm2, 并将临界电流密度提升到了2.2 mA/cm2. 更为重要的是, 当电流密度高于临界电流密度后, 电池会发生极化而不是短路, 通过添加反向电压, 极化可以得到恢复, 大大提高了电池的安全性能, 如图3(c)所示. Guo 课题组[62]和Sun课题组[63]利用磁控溅射的方法分别在LLZO 片上制备了20 nm 厚的SnO2缓冲层和Cu3N 薄膜, 利用界面转化反应显著改善了界面, 同时抑制了锂枝晶生长.
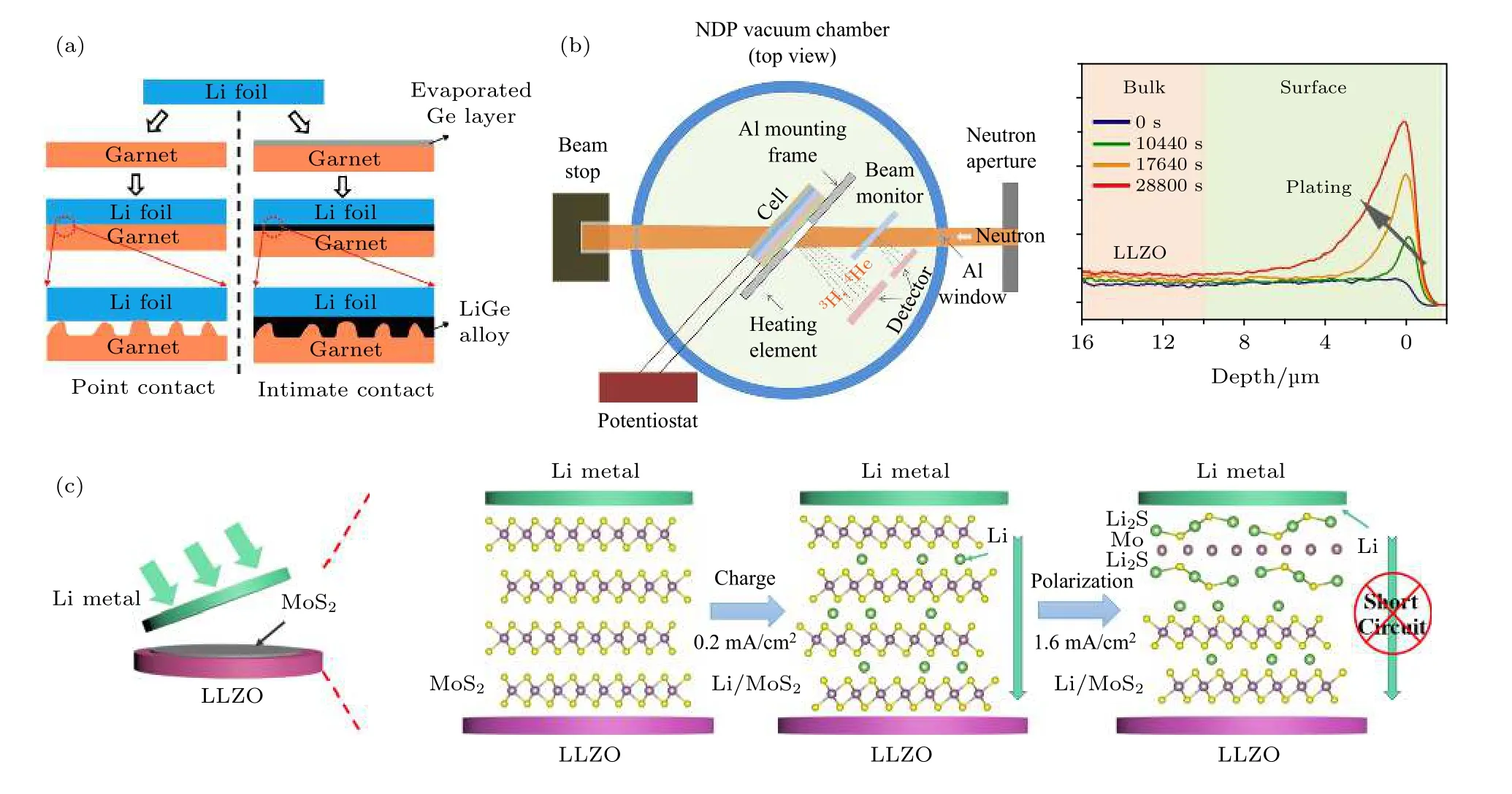
图3 (a) 利用Ge 作为界面缓冲材料优化Li/LLZO 界面[5]; (b) 中子深度分析装置示意图及LLZO 原位探测结果[58]; (c) 利用MoS2 作为界面缓冲材料优化Li/LLZO 界面, 和界面转化反应及极化原理示意图[61]Fig. 3. (a) Using Ge as buffer layer to modify Li/LLZO interface[5]; (b) schematic of the experimental set-up for operando Neutron depth profiling and the results for LLZO cell[58]; (c) schematic diagram of the conversion reaction and the chemical evolution of the MoS2-coating layer in the polarization process[61].
综上所述, 石榴石型固态电解质和锂金属的搭配有望实现电池的高安全性和高比能量, 其界面电阻通过合理的优化, 已经可以降到接近于液态电池的水平. 然而, 在抑制锂枝晶生长方面, 石榴石型固态电解质还远远没有达到人们的期望, 其临界电流密度还远远低于可以实际应用的电流密度10 mA/cm2, 需要进一步改善提高.
4 LLZO 固态电解质与正极材料的界面优化
石榴石型固态电解质具有高的硬度和剪切模量, 导致电解质/正极接触面积较小, 并在界面处形成一定的结构缺陷, 制约了锂离子的传输, 其界面电阻是目前全固态电池中阻抗的主要来源. 此外, 电解质/正极界面并不是那么稳定[28,64], 在高温烧结或者电化学循环过程中, 容易发生元素互扩散, 破坏材料的骨架结构并形成第三相[43,65]. 第三相的存在往往会阻碍锂离子的传输, 增大界面电阻, 并随着电化学循环的进行引入界面应力, 应力的逐渐积累会使得固-固界面断裂分离, 最终导致全固态电池的失效[66,67].
激光脉冲沉积的方法最先用来尝试改善正极/石榴石型固态电解质界面. Kim 等[68]利用激光脉冲沉积方法在LLZO 上沉积LiCoO2正极薄膜, 发现Co, La 和Zr 等元素在沉积过程中由于局部高温而在界面处发生互扩散, 生成了La2CoO4高阻相. Ohta 等[69]改进了沉积条件, 测得LiCoO2/LLZONb/Li 全固态电池的界面阻抗约为170 Ω/cm2,电池的首次充放电容量分别为130 和129 mAh/g,性能非常接近于液态电池. Kato 等[70]随后又进一步优化了沉积方法, 先在LLZO 上沉积一层约为10 nm 的Nb 层, 在600 ℃的O2气氛下热处理2 h 形成Li-Nb-O 无定形界面层, 再进行LiCoO2的沉积, 如图4(a)所示. 无定形的Li-Nb-O层既起到缓冲层平缓界面的作用, 还显著抑制了界面元素的互扩散行为, 其本身较高的Li+传导率也使得Li+可以在界面处快速移动. 该方法将LiCoO2/LLZO 界面电阻从2600 Ω/cm2降到150 Ω/cm2,并将全固态电池的容量提升到了140 mAh/g.
共烧结方法是另外一个改善正极/固态电解质界面接触的重要方法. Ren 等[71]利用XRD, XPS和拉曼光谱系统研究了LiCoO2, LiMn2O4, LiNi0.33Co0.33Mn0.33O2LiFePO4等常见正极材料对于LLZO的热稳定性, 发现LiCoO2和LiNi0.33Co0.33Mn0.33O2对于LLZO 的稳定性要远高于LiMn2O4和LiFePO4. 我们课题组[43]进一步结合软X 射线吸收谱技术(sXAS)和第一性原理计算, 揭示了LiCoO2和LiNi0.33Co0.33Mn0.33O2对于LLZO 热稳定性的差异来源于Ni 与Li 的交换作用, Li 从电解质交换到电极材料中, 会导致容量的略微增加, 然而, 界面处形成的Li 耗尽层以及LaNiO3相会破坏电池的循环稳定性. 为了减少界面反应的发生,Liu 等[72]设计了一种方法利用加热的碳纸将V2O5电极材料快速退火制备到LLZO 片上, 将常温下的界面电阻从2.5 × 104降低到 71 Ω/cm2,并且全固态电池可以以97%的库仑效率循环100 圈以上, 如图4(b)所示. Han 等[73]巧妙地利用LLZO 表面存在碳酸锂的特性, 将LiCoO2等电极材料表面也包覆上碳酸锂, 引入Li2.3—xC0.7+xB0.3—xO3在高温烧结过程中与碳酸锂反应生成LCBO 离子导电基体, 填充了间隙并显著改善了界面接触,同时, 还避免了界面处由于电极材料直接与LLZO接触而产生的互扩散现象, 如图4(c)所示, 室温下全固态电池稳定循环100 圈后仍表现出了优良的循环稳定性.
综上所述, 目前还没有特别完备的方法改善传统的正极材料与LLZO 界面. 激光脉冲沉积方法能够精确控制沉积层的厚度, 改善界面接触, 有效降低界面阻抗, 优化电池性能, 但成本较高, 且电极材料负载量很小, 不适合大规模制备. 共烧结方法以及缓冲材料的引入从本质上改变了原有的正极/电解质界面结构, 改善了界面的相容性, 抑制和引导正极、电解质之间的元素互扩散, 降低了界面阻抗. 但目前对于引入改性材料的成分和结构的选择、界面反应的方向和机理都有待深入理解和系统性研究.
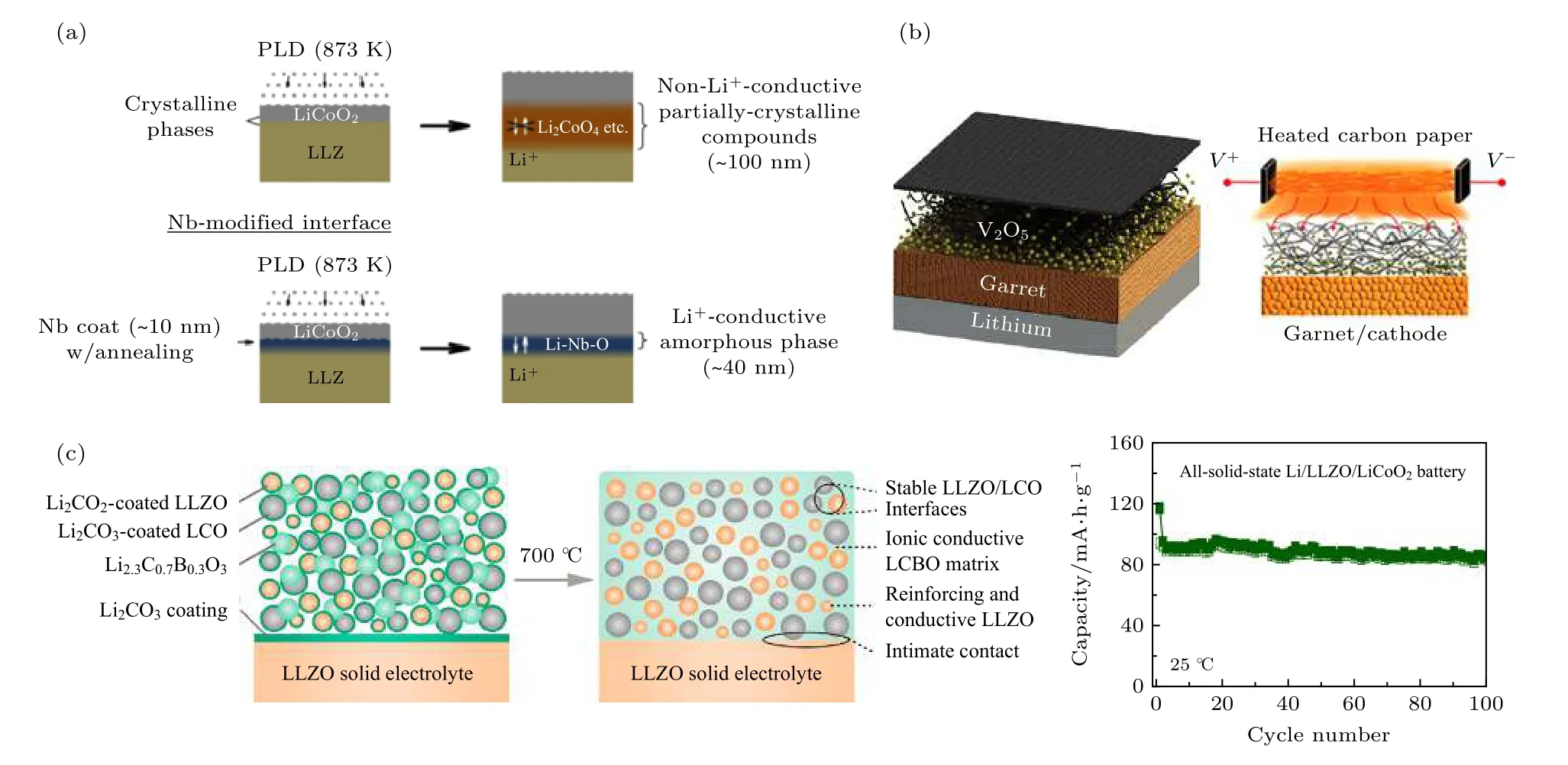
图4 (a) 利用添加Nb 缓冲层可以有效改善激光脉冲沉积过程中LiCoO2/LLZO 界面稳定性[70]; (b) 利用快速热退火的方法将V2O5 电极材料制备到LLZO 片上[72]; (c) 利用Li2.3-xC0.7+xB0.3-xO3 与碳酸锂反应生成LCBO 改善LiCoO2/LLZO 界面示意图以及全固态电池在常温下的循环特性[73]Fig. 4. (a) Using Nb as buffer layer can modify the stability of LiCoO2/LLZO interface during Pulsed Laser Deposition (PLD) process[70]; (b) using rapid thermal annealing to melt V2O5 cathode onto LLZO pellet[72]; (c) schematics of the interphase-engineered allceramic cathode/electrolyte by using the reaction of Li2.3-xC0.7+xB0.3-xO3 with Li2CO3. The all sold battery can cycle well over 100 times at room temperature[73].
5 总结和展望
石榴石型固态电解质具有高的离子导率、良好的化学稳定性以及宽的电化学窗口, 在全固态电池中的应用前景广阔. 然而, 石榴石型固态电解质与两极之间依然存在着众多问题, 特别是本文中提到三个主要问题: 1)差的空气稳定性导致的碳酸锂问题; 2)对于金属锂界面润湿性差且难以阻止锂枝晶生长的问题; 3)与正极材料间差的界面接触、元素互扩散形成的高阻抗相以及界面结构应力使得石榴石型全固态电池的放电比容量低、倍率性能差、循环寿命短的问题.这些都是制约石榴石型全固态电池应用的瓶颈. 针对上述问题, 下一步石榴石型全固态电池还可以在以下几个方向得到改进,如图5 所示.
1) 为了解决石榴石型固态电解质空气稳定性及存放问题, 利用先进的原位表征技术从本质上理解石榴石型固态电解质与空气中的水和二氧化碳反应机理十分重要. 针对气-固界面的原位表征、近常压表征技术, 如常压/近常压X 射线谱学技术(包括近常压光电子能谱和近常压吸收谱), 是最强有力的手段之一[74,75]. 真空腔体中的样品处理可以保证样品表面的清洁, 不同光谱学手段探测深度的差异可以实现表界面的深度分析, 近常压技术还可以详细观测到反应的动力学过程. 利用该原位表征技术, 将有望排除外界因素的干扰, 原位观测到石榴石型固态电解质与水和二氧化碳反应的真实过程. 目前上海光源02 B 实验平台正在完善这样一套原位表征系统[76,77], 以后不仅可以用于石榴石型固态电解质的研究, 还可以进一步推广到其他体系固态电解质气氛稳定性的研究中.
2) 对于Li/LLZO 界面, 目前很多方法已经可以将界面电阻降低到接近液态电池的地步, 下一步应该研究如何能抑制锂枝晶的生长, 提高临界电流密度. 目前大多数的研究都集中在缓冲层材料上,具有高的离子传输能力、能均匀化界面电阻并隔绝电子的材料是最理想的材料, 目前看来, 转化反应界面层材料[61,63]以及复合电解质材料[78]是最有可能实现这些目的候选者. 此外, 临界电流密度还显著受到工作温度[30]、电解质的剪切模量[79,80]以及晶界[36]的影响, 这些方面的研究还比较稀少, 有待进一步加强.

图5 石榴石型全固态电池未来可能的研究方向[63,78,82]Fig. 5. Possible research directions for garnet-based all solid battery in the future[63,78,82].
3) 采用硫化物作为电极材料组装石榴石型全固态Li-S 电池或有望改善固态电解质/正极界面的问题. 相比于传统氧化物电极材料, 硫化物电极材料可以更好地附着在LLZO 片上, 且Li-S 电池的工作电压较低, 可以更好地适配LLZO 电解质的真实稳定的电化学窗口. 此外, 通过界面转化反应构建的新型电极/电解质界面使得两者在电化学过程中稳定. 氧化物电解质材料本身也可以抑制聚硫化物的穿梭效应, 通过构建新型界面并引入具有催化性能的金属, 可能会有效固定反应产物并催化Li2S 的转化[81]. 目前, 关于利用硫化物作为正极材料组装石榴石型Li-S 电池的报道还比较稀少,已有的报道称基于LLZTO 固态电解质的Li-S 电池在低倍率下容量可以达到1200 mAh/g, 并且有接近100%的库仑效率[82].
全固态锂离子电池离真正商业化还有很长的路要走, 随着研究的不断深入, 相信未来全固态电池还是很有希望代替现有的液态锂离子电池, 成为安全高效的能源存储方式.

