干制羊肉基因组DNA不同提取方法的比较
陈传君 金 鹭 林 华 胡 滨,* 韩国全 陈世界 张 婧 安 微
(1 四川农业大学食品学院,四川 雅安 625000;2 成都海关,四川 成都 610000)
肉及肉制品是人类饮食中重要的优质蛋白质来源。羊肉因具有肉质细嫩、味道鲜美,富含人体所必需氨基酸、维生素和微量元素而备受消费者青睐,历来被当做秋冬御寒和进补的重要食品之一[1-2]。同时,羊肉产品没有文化和宗教的禁忌,更易被广大消费者所接受[3]。也正因羊肉的这些优点及其所具有的商业价值,利用鸭肉、猪肉、貂肉、老鼠肉制造假羊肉的现象屡见,假羊肉的泛滥不仅干扰了市场秩序,还严重损害了养殖户和消费者的利益[4-5]。因此,对羊肉中其他肉类的快速检测研究具有重要的意义。目前,针对肉种鉴定的方法主要有电子鼻法[6]、红外光谱法[7]、酶联免疫吸附法[8-10]、聚合酶链式反应(polymerase chain reaction,PCR)法等,其中实时荧光定量PCR法的应用最广泛[11]。DNA的提取效果对于采用PCR检测显得尤为重要。目前动物源性DNA提取方法主要有酚抽提法、异丙醇沉淀法、Tris-EDTA法、改良十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)法、chelex-100法、盐析法、异硫氰酸胍(GuSCN)法等[12-13]。但大多数PCR法是基于不同物种鲜肉样品的掺假研究,针对热加工后肉样定量掺假研究的报道较少。而多数掺假羊肉制品往往已经加工为成品,经历了烹调过程,导致DNA断裂并遭到破坏,在一定程度上影响了提取基因组DNA的纯度和浓度[14-15]。PCR法检测的关键在于快速、简洁地提取DNA,而筛选出合适的干制羊肉基因组DNA的提取方法才能够保证羊肉真伪鉴别的准确性和灵敏度。因此,本试验将新鲜羊肉进行高温干制处理后,采用传统酚-氯仿法、动物组织基因组磁珠法提取试剂盒(磁珠法)、DNeasy© mericon Food Kit 试剂盒(改良CTAB法)以及DNeasy© Blood & Tissue Kit 试剂盒(离心柱)提取干制羊肉基因组DNA,通过比较分析4种方法提取的羊肉基因组DNA浓度、纯度、完整性以及提取所需时间、PCR扩增效果等,探求一种适合于干制羊肉基因组DNA的提取方法,旨在获得稳定、高质量的DNA,使产品的进一步分析检测更加便捷。
1 材料与方法
1.1 材料与设备
1.1.1 试验材料 羊肉由成都海关检验检疫技术中心提供,-70℃保存;动物组织基因组磁珠法提取试剂盒,由食品安全检测四川省重点实验室自制[组织裂解液;磁珠悬浮液:磁珠浓度100 μg·mL-1,液态介质为异丙醇;洗涤液(pH值7.0):800 mmol·L-1氯化锂,50 mmol·L-1磷酸盐缓冲液(phosphate buffered solution, PBS)缓冲液,100 mmol·L-1氯化钠,70%乙醇;漂洗液:70%乙醇;制备时间:2017年10月];DNeasy®mericon®Food Kit试剂盒、Neasy© Blood & Tissue Kit 试剂盒,德国QIAGEN公司;Tris-饱和酚,索莱宝(北京)生物科技有限公司;蛋白酶K(20 mg·mL-1), 郑州拓样生物有限公司;Premix Ex Taq(Probe qPCR)预混液,北京TaKaRa公司;组织裂解液[1 mol·L-1三(羟甲基)氨基甲烷-盐酸、0.5 mol·L-1乙二胺四乙酸、10%十二烷基硫酸钠、2 mol·L-1氯化钠]、氯仿-异戊醇(24∶1,v/v)、0.1 mol·L-1醋酸钠溶液均为自配试剂。
1.1.2 主要仪器与设备 ND-1000 Nano Drop核酸蛋白测定仪、CFX96 Real-time PCR 仪、小型水平电泳槽、ChemiDoc MP多功能凝胶成像系统,美国Bio-Rad公司;MagMax Express自动化核酸提取仪、高速冷冻离心机X3R,美国Thermo Fisher Scientific公司;Eppendorf Thermomixer F恒温金属浴,德国Eppendorf公司;FastPrep-245G匀浆仪,美国MP Biomedicals生物医学公司。
1.2 样品的制备
取新鲜羊肉样品的肌肉组织,用绞肉机绞碎后于烘箱中烘干至恒重,烘干温度100℃,每2 h取出放入干燥皿冷却,0.5 h后称重并记录一次,直到前后2次称重差值不超过2 mg即达到恒重。将烘干样品研磨至粉末状,室温条件下保存于干燥皿中用于DNA的提取。
1.3 干制羊肉基因组DNA提取
1.3.1 传统酚-氯仿法 参考《分子克隆实验指南》(第三版)[16]的方法,采用蛋白酶K和苯酚从哺乳动物细胞中提取DNA,将提取的DNA于-20℃保存。
1.3.2 磁珠法
1.3.2.1 自制磁珠法提取DNA 准确称取100 mg干制羊肉粉末于2 mL EP管中,加入500 μL PBS缓冲液,匀浆。然后吸取200 μL(相当于25 mg样品)匀浆于2 mL EP管中,再加入200 μL组织裂解液和20 μL蛋白酶K于56℃条件下恒温孵育1 h,消化完全后取出,期间每隔10 min震荡一次。后续操作严格按照动物组织基因组磁珠法提取试剂盒操作手册进行,具体操作步骤如下:将经过恒温孵育的样品加入300 μL异丙醇涡旋混匀,同时设置阴性对照(未添加肉粉末组);室温孵育10 min(期间每隔3 min振荡混匀一次)后加入20 μL磁珠悬浮液,将离心管放置于磁力架上静置30 s,小心去除液体;将离心管从磁力架上取下,加入500 μL洗涤液,并震荡混匀;将离心管放置于磁力架上静置30 s,小心去除液体;将离心管从磁力架上取下,加入500 μL漂洗液,并震荡混匀;将离心管放置于磁力架上静置30 s,小心去除液体;重复上述洗涤步骤一次,尽量将液体去除干净;将离心管放置于磁力架上室温晾干10 min后,将离心管从磁力架上取下,加入100 μL ddH2O,涡旋混匀,室温孵育10 min;将离心管放置于磁力架上静置30 s,小心将核酸液转移到新的1.5 mL EP管中,-20℃保存或者立即使用。
1.3.2.2 自制磁珠法提取试剂盒的性能评价 1)重复性。取同一批干制羊肉粉末,由同一试验人员按照自制磁珠法提取试剂盒操作说明提取羊肉基因组DNA,重复6次,每次3个平行。用核酸蛋白测定仪测定并计算每份样品DNA的浓度及纯度值。按照相对标准差(relative standard deviation,RSD)不大于5.0%,判定检测方法的重复性。
2)稳定性。将试剂盒从2~8℃条件下取出置于25℃复温后,提取同一批干制羊肉的基因组DNA,使试剂盒反复复温10次、20次,将每一次提取的DNA进行实时荧光定量PCR扩增,计算RSD值。
3)有效期。将试剂盒于2~8℃条件下保存1年, 期间每隔一个月用试剂盒提取同一批干制羊肉的基因组DNA,测定提取DNA的纯度及浓度。
1.3.3 改良CTAB法 准确称取100 mg干制羊肉粉末于2 mL EP管中,加入800 μL PBS缓冲液,充分匀浆。然后吸取200 μL匀浆,严格按照DNeasy© mericon© Food Kit试剂盒操作手册提取DNA,将提取的DNA置于-20℃保存。
1.3.4 离心柱法 准确称取100 mg干制羊肉粉末于2 mL EP管中,加入800 μL PBS缓冲液,充分匀浆。然后吸取200 μL匀浆,严格按照DNeasy© Blood & Tissue Kit说明书提取DNA,将提取的DNA置于-20℃保存。
1.4 DNA指标测定
每份DNA样品取3 μL,用相应缓冲液作为空白对照,采用核酸蛋白仪测定基因组DNA的浓度(ng·μL-1) 及纯度A260/A280值,用于评价基因组DNA的质量。每份样品重复测定3次,每次3个平行。
1.5 实时荧光定量PCR扩增效果检测
1.5.1 引物探针的设计 参考任君安[17]的方法,选定羊的生长激素因子GH(序列号为NC-000077)作为目的基因,根据NCBI中公布的不同物种间各基因序列,进行序列比对,选取羊特异性较好的区域运用引物设计软件Primer Express 3.0设计一对特异性引物及一条Taqman探针,设计时充分考虑引物设计的要求。
1.5.2 实时荧光定量PCR反应条件 为验证不同方法提取的DNA在qPCR中的实际扩增情况,分别将4种方法提取的基因组DNA稀释至50 ng·μL-1作为扩增模板,使用CFX96 Real-time PCR仪进行扩增,PCR反应参照优化后体系及程序进行扩增。具体反应程序见表1,反应体系见表2。

表1 实时荧光定量PCR扩增反应程序Table 1 Real-time fluorescence quantitative PCR reaction procedure

表2 实时荧光定量PCR扩增反应体系Table 2 Real-time fluorescence quantitative PCR reaction system
1.6 琼脂糖凝胶电泳检测
取不同方法提取的DNA样品各5 μL,采用1%琼脂糖进行凝胶电泳,采用TAE缓冲液,100 V恒压电泳30 min, 在ChemiDoc MP多功能凝胶成像系统中成像,观察并记录结果。
2 结果与分析
2.1 核酸蛋白仪测定4种方法提取的DNA比较
由表3可知,传统酚-氯仿法、磁珠法和离心柱法提取的羊肉基因组DNA的A260/A280平均值均大于1.80, 说明提取的DNA纯度均较好。传统酚-氯仿法的A260/A280值>1.90,可能有少许RNA污染。改良CTAB法所得DNA浓度平均值最低,且该方法的A260/A280值远低于1.80,表明该方法提量最低,且提取的DNA存在较多的杂质。
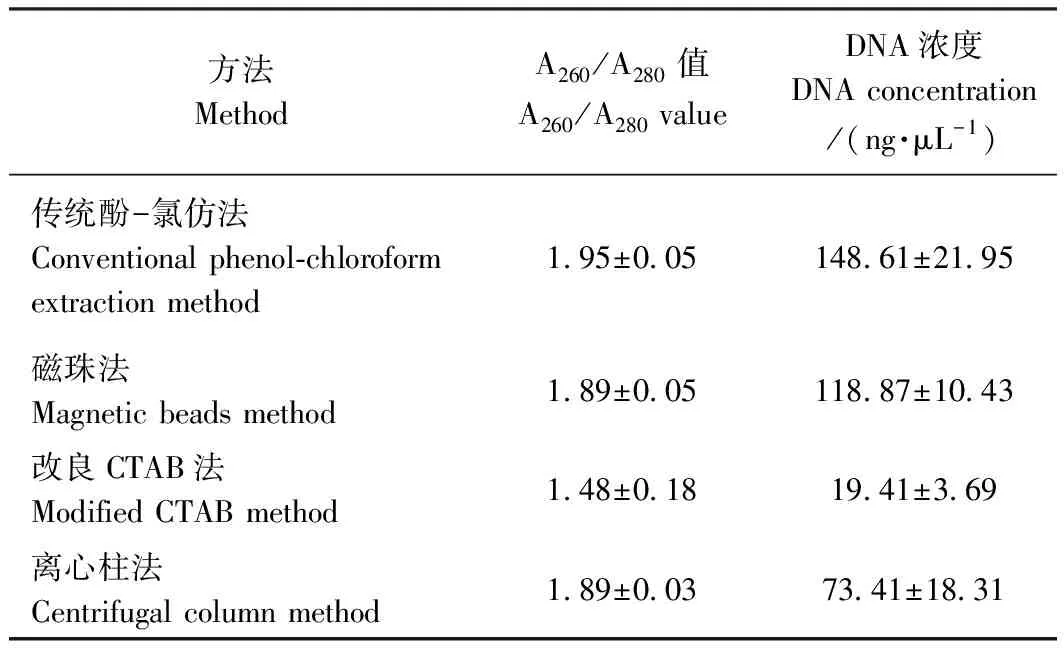
表3 不同提取方法基因组DNA的质量参数Table 3 The quality parameters of different extraction methods about genomic DNA
2.2 引物探针的设计
通过NCBI中公布的不同物种间基因序列的比对,选取了羊特异性较好的区域,运用引物设计软件Primer Express 3.0设计了一对羊特异性引物和一条探针(表4)。
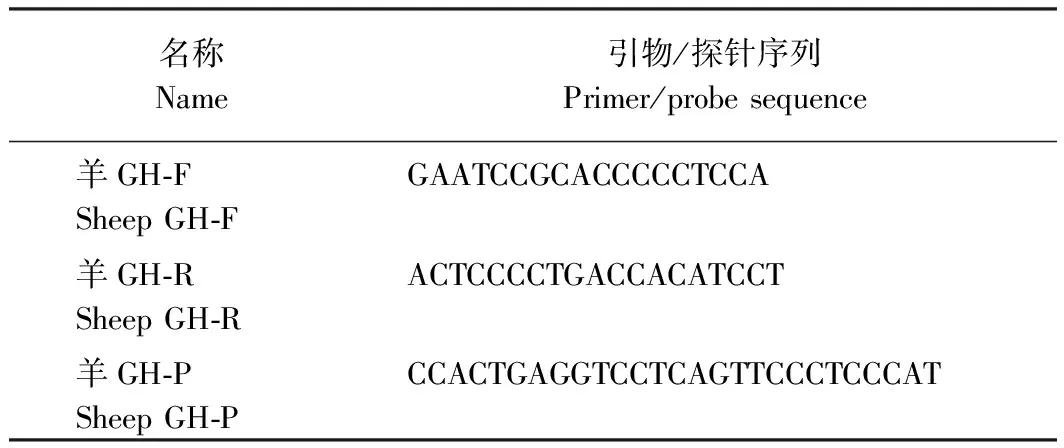
表4 羊的特异性引物探针Table 4 Specific primers/probes for sheep
2.3 实时荧光定量PCR扩增效果比较
由图1可知,4种方法提取的羊基因组DNA均有PCR扩增曲线,但扩增效果有明显差异。仅从Ct值大小可知,4种方法提取羊基因组DNA的PCR扩增效率为磁珠法>传统酚-氯仿法>离心柱法>改良CTAB法,从核酸蛋白仪测定的结果来看,磁珠法与传统酚-氯仿法所得DNA浓度相差不大,但磁珠法的扩增效率更好,说明传统酚-氯仿提取的DNA中存在抑制PCR扩增的物质。而离心柱法和改良CTAB法因DNA质量浓度相对较低,导致其扩增效率较其他2种方法更低。
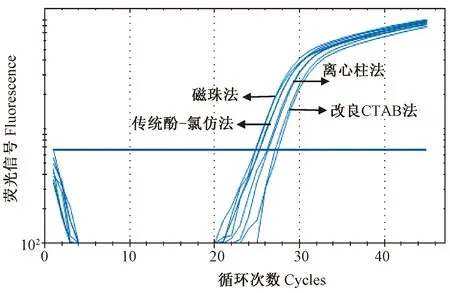
图1 4种方法提取DNA样品的实时荧光定量PCR扩增图Fig.1 Real-time fluorescence quantitative PCR amplification of DNA samples extracted by four extraction methods
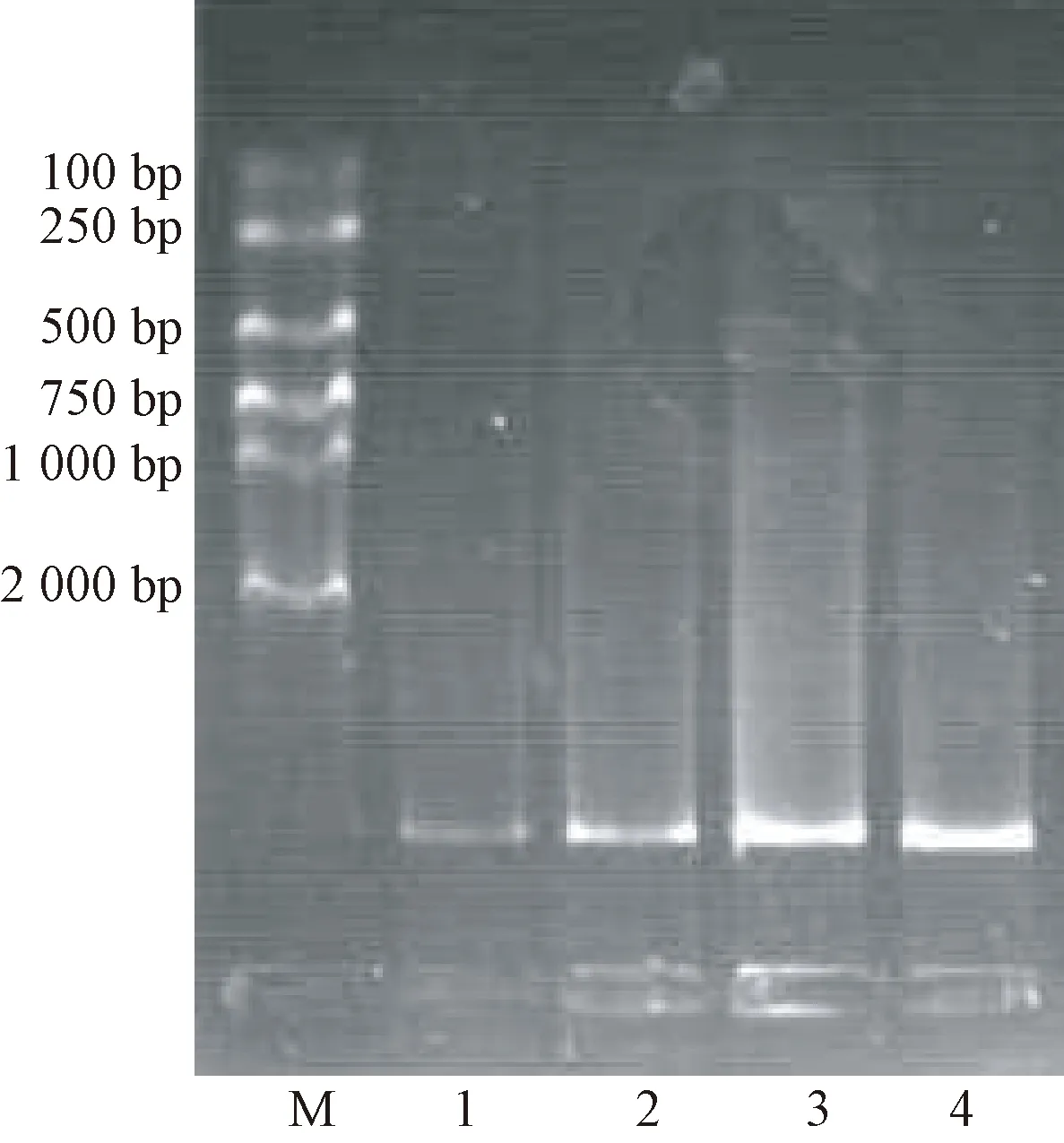
注:M:2 000 bp marker;1:改良CTAB法;2:离心柱法;3:传统酚-氯仿法;4:磁珠法。Note: M: 2 000 bp marker. 1: Modified CTAB method2: Centrifugal column method. 3: Conventional phenol-chloroform extraction method. 4: Magnetic beads method.图2 4种方法提取的DNA琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis of DNA extracted by four methods
2.4 羊基因组DNA凝胶电泳检测结果
由图2可知,4种方法提取的羊基因组DNA电泳条带的大小一致,说明4种方法提取的DNA都是完整的、全面且无降解的。泳道3、4的条带较1、2条带更加明亮、清晰,泳道1(改良CTAB柱法)的条带最弱,说明传统酚-氯仿法和磁珠法提取的基因组DNA浓度比离心柱法和改良CTAB法高。而泳道3有轻微拖尾现象,这是由于传统酚-氯仿法提取DNA过程中未加入RNA酶,还有少许RNA未去除完全,造成了轻微拖尾的现象。
2.5 自制磁珠法提取试剂盒的性能评价
2.5.1 重复性验证结果 由表5可知,重复性验证结果中A260/A280值的RSD为0.50%,DNA浓度的RSD为3.34%,表明试剂盒的重复性较好,符合提取试剂盒标准。

表5 自制磁珠法提取试剂盒重复性验证Table 5 Repeatability verification of self-made magnetic bead extraction kit
2.5.2 稳定性检测结果 由表6可知,试剂盒经反复复温10、20次后仍能提取动物基因组DNA,利用实时荧光定量PCR定量,试验结果显示多次提取样本的Ct值基本一致,表明试剂盒具有良好的稳定性。
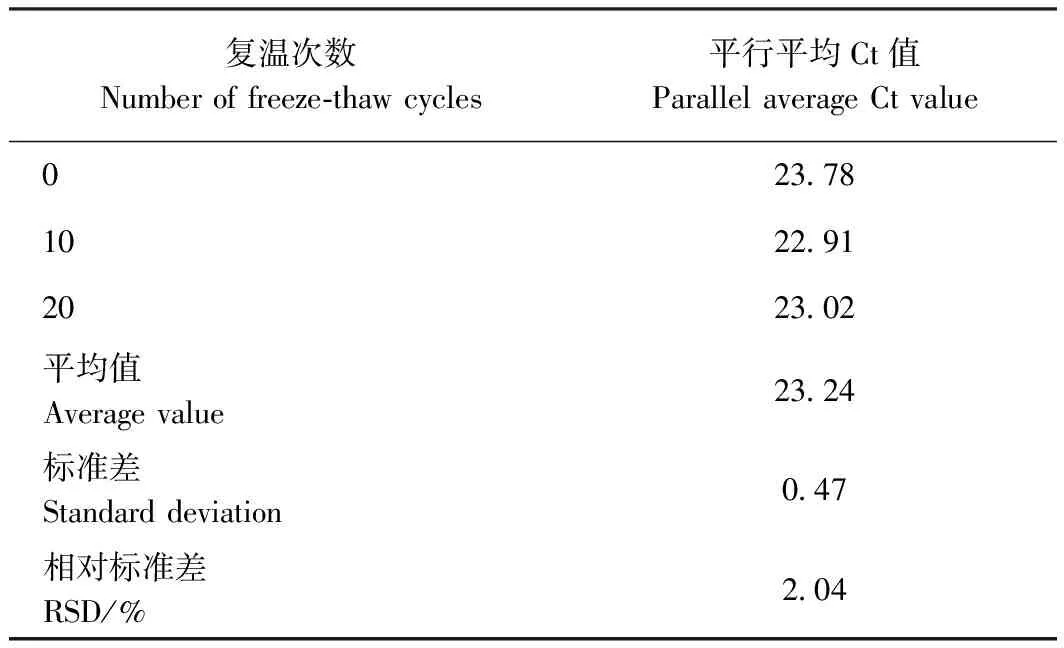
表6 自制磁珠法DNA提取试剂盒稳定性验证Table 6 Stability verification of self-made magnetic bead DNA extraction kit
2.5.3 有效性检测结果 由表7可知,12个月中12次提取结果的RSD均较小,A260/A280值和DNA浓度检测结果的RSD分别为0.74%和4.99%,说明该试剂盒在2~8℃保存条件下,检测结果准确可靠,至少可保存1年。
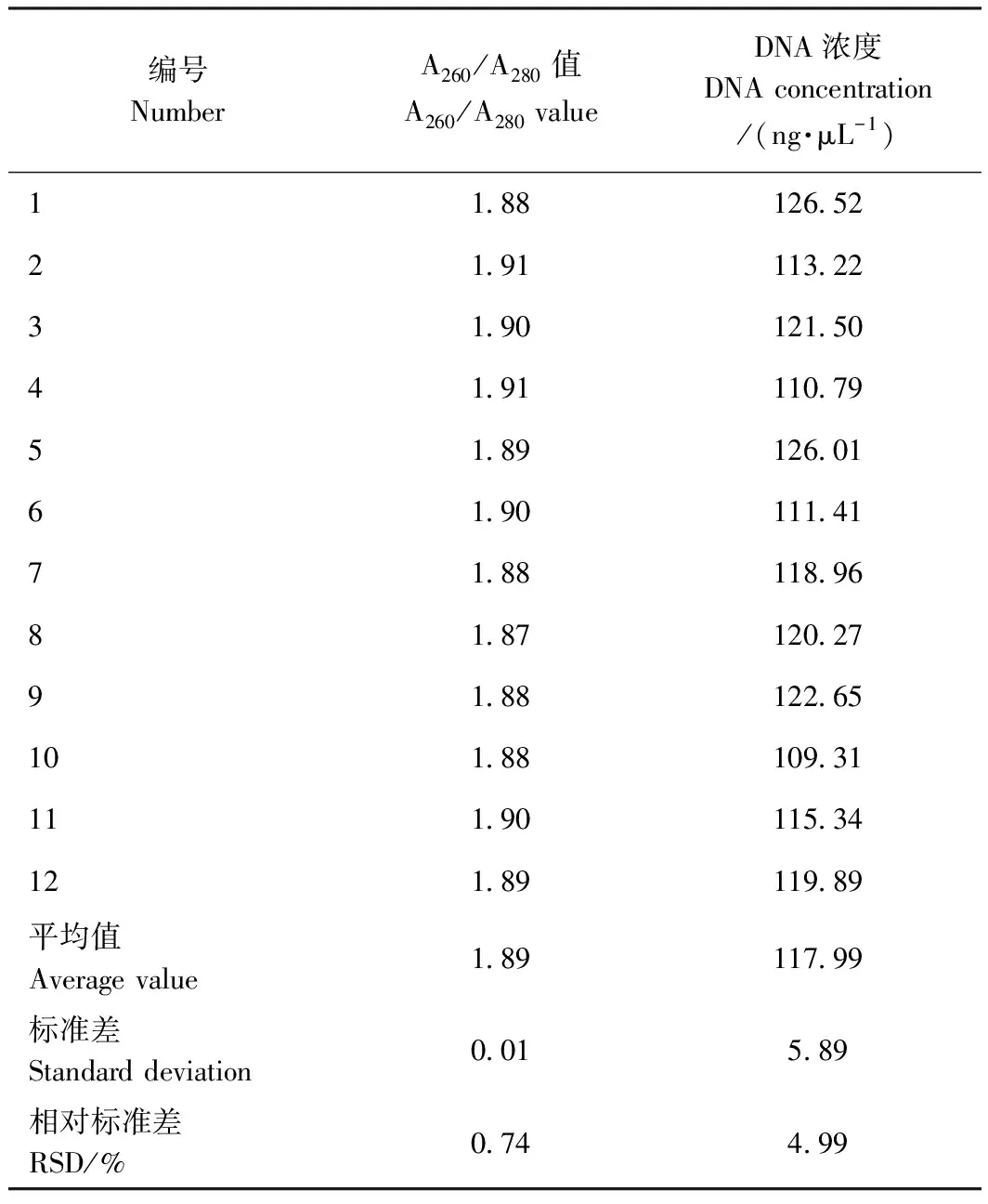
表7 自制磁珠法DNA提取试剂盒有效性验证Table 7 Validation of self-made magnetic bead DNA extraction kit
3 讨论
随着分子生物学的发展,应用PCR技术在DNA水平上对肉类及肉制品进行掺假检验备受关注。DNA的提取是利用PCR技术鉴定肉类及肉制品是否掺假的第一步,DNA模板的纯度和完整性与后续试验成功与否密切相关[18]。对于肉制品来说,加工过程易造成基因组DNA的降解,影响提取基因组DNA的质量,导致检测结果不稳定[19]。Pascoal等[20]证实经加热和超压处理后,牛肉的DNA发生了一定程度的降解。Aslan等[21]通过提取生牛排和煮熟牛排的DNA发现,将牛肉高温烹调会导致肉质量下降,DNA的碎片小于800 bp。因此,筛选适宜的DNA提取方法极为重要。
由于不同的DNA提取方法对肉制品的提取效果有所不同,本研究通过实时荧光定量PCR扩增效果和凝胶电泳对4种不同方法提取干制羊肉基因组DNA效果进行比较,发现不同提取方法得到的DNA浓度、纯度均存在较明显的差异。改良CTAB法和离心柱法提取的DNA浓度和纯度较其他2种方法更低,传统酚-氯仿法和磁珠法提取DNA的效果更好。杨成等[22]采用改良NaCl法、十二烷基苯磺酸钠法、CTAB法和Tiangen试剂盒法提取猪肉、牛肉、羊肉的DNA,结果发现CTAB法提取的DNA浓度与纯度均低于其他3种方法,这可能与CTAB法提取时样品受到小分子物质污染有关,这与本研究结果较为一致。Chapela等[23]采用CTAB法从同一金枪鱼品种的4种不同品牌罐头中提取DNA,结果表明CTAB法提取的DNA浓度与纯度均相对较低。曾国权等[24]采用离心柱法提取牛肉干中牛基因组DNA时证实,该方法操作简单快速,提取的DNA质量较高,易进行PCR扩增,但离心柱法提取得到的DNA质量相对较低,这与本研究结果也较相似。
传统酚-氯仿法作为经典的DNA提取方法,提取的DNA质量能够满足分子生物学试验的基本要求,但耗时较长。而且酚和氯仿均有一定的挥发毒性,长期使用会对使用者和环境造成危害[25]。Arslan等[26]将牛肉经过高温烹调处理后,采用酚-氯仿法提取DNA,用PCR扩增出271 bp的DNA片段,但试验时间达到10 h以上。何建文等[27]在提取牦牛肉产品中基因组DNA时发现,酚-氯仿抽提法所提DNA的纯度和含量适中,蛋白含量较低,但缺点是试验时间较长。磁珠法通过把DNA分离技术和富集技术有机结合在一起,经过简单洗脱即可得到纯度较高的靶物质DNA,其操作步骤少、自动化程度高、耗时短,目前已被广泛应用于DNA的提取[28]。曾国权等[24]采用磁珠法提取牛肉干中牛基因组DNA时证实,磁珠法提取不需要加入苯酚等有毒试剂,无乙醇沉淀等步骤,且不需要离心操作,整个过程仅需1.5 h,操作简单快捷,这与本研究结果较一致。石盼盼等[29]采用OMEGA磁珠组织DNA提取试剂盒提取熟制牛肉干的DNA,发现提取DNA的纯度较高,耗时较短。沈丽等[30]比较了磁珠核酸提取法与商品化核酸提取试剂盒提取肉制品DNA,证明磁珠核酸提取法具有快速方便、灵敏、安全及可实现自动化等优点。本试验中,自制磁珠法提取试剂盒对仪器和人员操作要求低,而且配制试剂盒所用试剂均为常规试剂,较易取得,相较于另外2种商品试剂盒成本较低。目前,QIAGEN的DNeasy© mericon© Food Kit试剂盒提取成本约32元/次,DNeasy© Blood & Tissue Kit 试剂盒提取成本约29.6元/次,而实验室自制试剂盒仅需要约7.8元/次,市面上国产的商品化磁珠法DNA提取试剂盒提取成本普遍大于10元/次,进口试剂盒更昂贵。因此,本试验自制磁珠法提取试剂盒具有一定的应用前景。
4 结论
从提取DNA的纯度、浓度、扩增效果以及试验所消耗时间、成本等方面综合考虑,本研究认为,磁珠法具有较好的稳定性和重复性,更适宜于加工羊肉基因组DNA的大规模提取与检测。

