澳洲茄碱通过mTOR信号通路抑制膀胱癌细胞增殖
刘 容,方 潇,高宇文,林飞飞,林志杰,陈榕彬,翁铭芳,吴卫真
0 引 言
膀胱癌是泌尿系统最常见的恶性肿瘤之一,其中约90%为尿路上皮癌[1]。肌层浸润性膀胱癌复发率较高,预后较差,降低膀胱癌的复发率和死亡率是一个亟待解决的问题。龙葵是传统中药的十大抗癌药物之一,澳洲茄碱(solasonine)是龙葵的重要抗癌成分。研究表明,澳洲茄碱在神经胶质瘤、肺癌、肝癌等多种肿瘤中均具有抗肿瘤作用[2-4]。然而截止到2020年9月24日,检索了PubMed、CNKI、万方等数据库,澳洲茄碱对膀胱癌的作用尚未见报道。哺乳动物雷帕霉素靶蛋白(mammalian target of Rapamycin, mTOR)是细胞生长、增殖的重要调节因子。本研究旨在观察不同浓度的澳洲茄碱对体外培养的膀胱癌细胞增殖、细胞周期和细胞凋亡的影响,并通过研究澳洲茄碱对J82细胞mTOR信号通路相关蛋白和mRNA表达的影响,初步阐明澳洲茄碱发挥抗肿瘤作用的分子机制,为进一步研究奠定基础。
1 材料与方法
1.1 材料澳洲茄碱(纯度95%,中国杨凌慈缘生物技术有限公司)。J82、T24细胞(中国科学院上海细胞库),胎牛血清、细胞培养基(美国Hyclone公司),CCK-8试剂盒(中国博士德公司),二甲基亚砜(Dimethyl sulfoxide,DMSO,美国Sigma公司),碘化丙啶(Propidium iodide, PI,美国Sigma公司),Annexin V-FITC/PI凋亡检测试剂盒(美国BD公司),EvoScipt RNA SYBR Green I Master试剂盒(瑞士Roche公司),总RNA提取试剂盒(中国Bio Flux公司),抗体β-actin、mTOR、p70S6K、p-mTOR、p-p70S6K(美国Cell Signaling Technology公司),山羊抗鼠二抗、山羊抗兔二抗(美国Thermo公司)。
1.2 方法
1.2.1 CCK-8检测澳洲茄碱作用后膀胱癌J82、T24细胞的生存率将对数期生长的J82、T24细胞种植至96孔板中,2000个/孔,培养12 h至细胞贴壁。分别加入含有0、5、10、20、40 μmol/L澳洲茄碱的细胞培养液,0 μmol/L澳洲茄碱组加入含有0.3%DMSO的细胞培养液,每组设6个复孔,分别培养24 h、48 h、72 h,加入CCK-8,计算细胞生存率。独立重复实验4次。
1.2.2 流式细胞仪(fluorescence activating cell sorter,FACS)检测J82细胞凋亡J82细胞经0、10、30 μmol/L澳洲茄碱处理24 h,胰酶消化后收集,PBS洗涤后加入结合液100 μL重悬,每组加入5 μL FITC Annexin V进行避光染色15 min后加入5 μL PI染色5 min。每组加入500 μL结合液重悬后上机检测,得出细胞凋亡率。独立重复实验4次。
1.2.3 FACS检测J82细胞周期取对数期生长J82细胞,传代培养12 h至贴壁,设0 μmol/L、10 μmol/L、30 μmol/L澳洲茄碱组,其中0 μmol/L组加入含有0.3%DMSO的培养基,10 μmol/L澳洲茄碱组和30 μmol/L澳洲茄碱组加入对应浓度澳洲茄碱,培养箱内培养24 h。胰酶消化、洗涤后重悬,用预冷70%乙醇溶液固定2 h,用5 μg/mL的PI溶液进行DNA染色,70 μmol/L滤网过滤后上机检测,所得数据应用ModFit LT软件进行分析,得出细胞周期各期细胞百分比。
1.2.4 Western blot法检测mTOR、p-mTOR、p70S6K、p-p70S6K蛋白表达将J82细胞分成0 μmol/L、10 μmol/L、20 μmol/L、30 μmol/L澳洲茄碱组,加入对应培养液,其中0 μmol/L组加入含有0.3%DMSO的培养基,培养24 h后收取蛋白,双辛酸(BCA)法检测蛋白浓度,取30 μg蛋白进行SDS-PAGE电泳,转移至聚偏二氟乙烯(PVDF)膜上。用4%BSA封闭1 h,加入1∶1000稀释的一抗孵育15 h,洗膜后加入二抗孵育1 h,加入电化学发光液暗室曝光。
1.2.5 RT-qPCR法检测mTOR、p70S6K mRNA表达将0 μmol/L、10 μmol/L、30 μmol/L澳洲茄碱组J82细胞培养24 h后,应用总RNA提取试剂盒提取总RNA并测定RNA浓度,根据EvoScipt RNA SYBR Green I Master试剂盒说明书配成反应体系。mTOR引物序列:F:5′-ATGCTTGGAACCGGACCTG-3′, R:5′-TCTTGACTCATCTCTCGGAGTT-3′。 p70S6K引物序列:F:5′-CGGGACGGCTTTTACCCAG-3′,R:5′-TTTCTCACAATGTTCCATGCCA-3′。 β-actin引物序列:F:5′-GTTGTCGACGACGAGCG-3′,R:5′-GCACAGAGCCTCGCCTT-3′。每组三复孔,置于荧光定量PCR仪内检测。参数设置为:逆转录:60 °C,15 min;预保温:95 ℃,10 min;扩增:95 ℃,10 s,58 ℃,30 s,45个循环;溶解曲线:95 ℃,1 min,25 ℃,1 min,95 ℃,15 s;冷却:40 ℃,30 s。
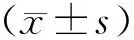
2 结 果
2.1 澳洲茄碱抑制膀胱癌细胞J82、T24细胞增殖
2.1.1 澳洲茄碱抑制膀胱癌J82细胞增殖不同浓度的澳洲茄碱作用后,相同作用时间各组J82细胞生存率在整体上差异均有统计学意义(P<0.01)。相同作用时间下,不同浓度的澳洲茄碱各组间两两比较,差异均有统计学意义(P<0.05)。相同作用浓度下,不同培养时间的各组进行ANOVA检验,仅20 μmol/L澳洲茄碱组差异有统计学意义(P=0.01),其余各组差异均无统计学意义(P>0.05)。虽然24 h各浓度组细胞生存率均高于48 h,但相同浓度不同作用时间比较差异均无统计学意义(P>0.05)。CCK-8检测结果见图1。
2.1.2 澳洲茄碱抑制膀胱癌T24细胞增殖不同浓度的澳洲茄碱处理后,相同作用时间各组T24细胞生存率差异均有统计学意义(P<0.01)。相同作用时间下,不同浓度的澳洲茄碱各组T24细胞间两两比较,除72 h 20 μmol/L和72 h 40 μmol/L组间差异无统计学意义(P=0.17),其余各组间差异均有统计学意义(P<0.05)。相同作用浓度下,不同培养时间的各组进行ANOVA检验,差异均无统计学意义(P>0.05)。见图2。
2.2 澳洲茄碱诱导J82细胞凋亡随着澳洲茄碱浓度增高,J82细胞的凋亡率显著增高,其中0、10和30 μmol/L澳洲茄碱组凋亡率分别为(0.93±0.26)%、(8.33±2.16)%、(29.53±7.63)%,各组间差异有统计学意义(P<0.01)。两两比较差异均有统计学意义(P<0.05)。表明澳洲茄碱能诱导J82细胞凋亡,这种诱导作用具有浓度依赖性。见图3。
2.3 澳洲茄碱阻滞J82细胞周期S期澳洲茄碱作用后,J82细胞S期细胞增多,0、10、30 μmol/L澳洲茄碱组S期细胞百分比分别是(34.51±3.61)%、(39.34±3.21)%、(44.50±4.29)%,差异有统计学意义(P=0.01)。G0/G1期细胞比例相应减少,0、10、30 μmol/L澳洲茄碱组G0/G1期细胞百分比分别是(62.65±4.73)%、(57.51±3.37)%、(52.69±4.00)%,差异有统计学意义(P=0.02)。而G2/M期细胞百分比无明显变化。提示澳洲茄碱可引起J82细胞发生细胞周期阻滞,这种阻滞作用发生在S期。见图4。
2.4 澳洲茄碱抑制J82细胞mTOR、p70S6K蛋白的磷酸化各组细胞mTOR、p70S6K蛋白表达未见明显差异。随着澳洲茄碱浓度增高,p-mTOR表达量逐渐减少,差异有统计学意义(F=85.18,P<0.01);p-p70S6K表达量逐渐减少, 差异有统计学意义(F=74.96,P<0.01)。表明澳洲茄碱能抑制mTOR蛋白的磷酸化、抑制p70S6K蛋白的磷酸化,从而抑制mTOR/p70S6K信号通路的激活。见图5、图6。
2.5 澳洲茄碱下调J82细胞mTOR、p70S6K mRNA表达随着澳洲茄碱浓度增高,J82细胞mTOR mRNA表达量逐渐降低,差异有统计学意义(F=31.49,P<0.01);p70S6K mRNA表达量逐渐降低,差异有统计学意义(F=47.08,P<0.01)。各组进行两两比较,差异均有统计学意义(P<0.05)。见图7。
3 讨 论
2015年全世界新发膀胱癌病例超过450 000例,膀胱癌在最常见的肿瘤中排名第9位[5]。膀胱癌的危险因素包括:年龄、性别、吸烟、饮水中砷的暴露史、职业性芳香胺接触史、血吸虫病、含非那西丁的止痛药以及膀胱癌家族史[6]。与发达国家相比,发展中国家和不发达国家的膀胱癌患者生存率较低[7]。膀胱癌目前的主要治疗手段是手术和化疗,然而因肿瘤转移导致其治疗效果并不理想,患者预后较差[8]。即使应用了最佳的治疗方案,超过50%的膀胱癌患者出现复发,高达20%的患者可能进展为肌层浸润性膀胱癌[9]。根治性膀胱切除术是肌层浸润性膀胱癌的主要治疗方法,但患者术后各种并发症的发生率较高[10]。因此寻找对膀胱癌有效的新药物是提高膀胱癌患者生存率的关键。
从天然药物中发现低毒、高效的抗癌成分是新药研发的重要途径之一[11]。传统中药治疗恶性肿瘤具有独特的优势,可以通过提高自身免疫力、增强机体抗病能力达到驱除癌瘤的目的[12]。中药龙葵具有清热、解毒、消肿等功效,在临床中广泛应用于肺癌、肉瘤、宫颈癌、乳腺癌等恶性肿瘤的治疗中[13]。澳洲茄碱,分子式:C45H73NO16,是龙葵发挥抗癌作用的主要活性成分。研究表明,澳洲茄碱可以显著抑制结肠癌、乳腺癌、宫颈癌、肝癌、胶质母细胞瘤等细胞的增殖,其半数抑制浓度波动于6.01~26.21 μg/mL[14]。Liu等[4]发现,澳洲茄碱可以通过对miR-375-3p和lncRNA CCAT1的相互调解,导致转录因子SP1介导的IRF5表达减少,从而抑制肝癌HepG2细胞的增殖。Smo基因突变和Gli基因扩增可以使肿瘤细胞发生原发性和获得性的耐药,澳洲茄碱可以通过抑制Hh信号通路,降低Gli的表达从而对抗肿瘤细胞的耐药性[15]。
J82细胞、T24细胞均为人膀胱移行癌细胞,属于浸润性膀胱癌细胞[16-17]。CCK-8结果表明澳洲茄碱作用后,J82、T24细胞的存活率降低。并且随着澳洲茄碱的浓度增加,这种抑制作用增强,说明澳洲茄碱能显著抑制J82、T24细胞的增殖,并且这种抑制作用具有浓度依赖性。然而延长澳洲茄碱的作用时间,并不能显著增强这种抑制作用,提示这种抑制作用无明显时间依赖性。
细胞凋亡和细胞周期结果表明,澳洲茄碱可诱导J82细胞凋亡并且引起J82细胞发生细胞周期阻滞,阻滞发生在S期。不同浓度组进行两两比较,差异均具有统计学意义(P<0.05),提示澳洲茄碱诱导J82细胞凋亡和引起J82细胞阻滞的作用均具有浓度依赖性。
mTOR/p70S6K信号通路是一条复杂的信号通路,包含许多下游分子,广泛参与许多细胞进程,包括细胞生长和存活、细胞周期、细胞凋亡、细胞自噬、蛋白合成、血管再生、细胞迁移和膜运输等[18-22]。mTOR蛋白经过磷酸化后活化,进一步引起下游靶蛋白p70S6K磷酸化,进而激活mTOR信号通路,促进细胞生长,抑制细胞自噬和凋亡,有利于细胞周期进展,加速细胞的增殖[23-24]。因此,抑制mTOR、p70S6K蛋白的磷酸化的药物可以通过抑制mTOR信号通路的传导发挥抗肿瘤作用。
为了进一步研究澳洲茄碱抑制膀胱癌细胞增殖、诱导细胞凋亡、阻滞细胞周期的分子机制,本研究分析了澳洲茄碱对J82细胞mTOR、p-mTOR、p70S6K、p-p70S6K蛋白表达的影响和对mTOR、p70S6K的mRNA表达的影响。结果显示各组细胞mTOR和p70S6K蛋白的表达量无明显差异,p-mTOR、p-p70S6K表达量显著减少,mTOR、p70S6K的mRNA表达下调,提示澳洲茄碱可能同时通过抑制mTOR和p70S6K蛋白的磷酸化、下调mTOR和p70S6K的mRNA表达,从而抑制mTOR信号通路的激活,发挥抗肿瘤作用。
综上所述,本研究发现澳洲茄碱在体外能显著抑制J82、T24细胞增殖、诱导J82细胞凋亡、阻滞J82细胞周期,这种作用呈浓度依赖性。其分子机制可能是通过抑制mTOR和p70S6K蛋白的磷酸化、下调mTOR和p70S6K的mRNA表达。澳洲茄碱有望解开肌层浸润性膀胱癌治疗的难题,成为新的膀胱癌治疗药物。本研究仅在体外初步探索了澳洲茄碱对膀胱癌细胞的抗肿瘤作用,澳洲茄碱对mTOR通路其他分子的表达和磷酸化是否有影响以及在动物体内是否仍有抑制膀胱癌细胞生长的作用,尚有待进一步验证。

