OSAHS患者ESR、血清TNF-α及IL-6的水平与其PASP的相关性
赵凌燕,熊小敏,田雪琴
(广元市中心医院,四川 广元 628000)
阻塞型睡眠呼吸暂停低通气综合征(obstructivesleep apnea hypopnea syndrome,OSAHS)是指患者在睡眠时上呼吸道完全或部分塌陷,使其出现低通气和呼吸暂停的情况,导致其发生睡眠结构紊乱(片段化)、间歇性缺氧及二氧化碳潴留,并引发一系列临床症状的综合征。流行病学调查结果显示,约有5%的成年人患有OSAHS[1]。肺动脉高压(pulmonary hypertension,PH)是指患者因罹患胸外疾病、肺部血管疾病、心肺疾病、胸膜及胸廓疾病等而导致其肺动脉压力增高的临床症状。肺动脉收缩压(pulmonary artery systolic pressure,PASP)≥40 mmHg 作为判定患者患有肺动脉高压的标准。肺动脉高压可引发右心衰竭。相关的研究结果显示,OSAHS 患者发生PH 的几率为40%左右,其发生PH 与OSAHS 导致的炎症反应有关[2]。本文主要是探讨OSAHS 患者红细胞沉降率(erythrocyte sedimentation rate,ESR)、血清肿瘤坏死因子α(tumor necrosis factor α,TNF-α)及白细胞介素6(Interleukin-6)的水平与其PASP 的相关性。
1 资料与方法
1.1 一般资料
经广元市中心医院伦理委员会批准,将2016 年7 月至2018 年7 月期间该医院收治的63 例OSAHS 患者及在该医院进行健康体检的30 例健康人作为研究对象。将其中的32例OSAHS 合并PH 患者作为观察组,将其中未合并PH 的31 例OSAHS 患者作为对照1 组,将其中的30 例健康人作为对照2 组。研究对象的纳入标准为:1)临床资料完整。2)对本次研究的依从性高,能配合完成各项检查及随访。研究对象的排除标准为:1)肝功能或肾功能较差。2)患有恶性肿瘤。3)患有心、脑、肺等重要器官的疾病。4)因患有慢性阻塞性肺疾病或肝硬化而发生PH。观察组患者及对照1 组患者的病情均符合中华医学会呼吸病学分会睡眠呼吸障碍学组在2011 年发布的OSAHS 诊断标准[3]。OSAHS诊断标准为:患者在夜间睡眠时存在打鼾及呼吸暂停的症状,其日间嗜睡、疲倦,其上呼吸道存在狭窄或阻塞的情况。观察组患者中有男15 例,女17 例;其年龄为23 ~60岁,平均年龄为(35.32±4.74)岁;其身体质量指数(BMI)为(29.13±1.14)。对照1 组患者中有男16 例,女15 例;其年龄为24 ~59 岁,平均年龄为(35.65±4.89)岁;其平均BMI 为(29.12±0.98);其PASP 均≥40 mmHg。对照2 组研究对象中有男16 例,女14 例;其年龄为23 ~60 岁,平均年龄为(36.01±4.77)岁;其平均BMI 为(24.11±0.77)。三组研究对象的性别、年龄相比,P>0.05 ;观察组患者与对照1 组患者的BMI 相比,P>0.05。
1.2 方法
在三组研究对象进行相关检查的前1 d 晚上通知其禁食禁水,保证采集血样时其空腹8 h 以上。在检查当天的清晨采集三组研究对象8 ml 的空腹肘正中静脉血。将血样保存在试管中。使用乙二胺四乙酸对血样进行抗凝。使用魏氏法检测血样的ESR。将盛有血样的试管放入离心机中,以3000r/min 的速度离心15 min。取试管中上层的血清备用。使用酶联免疫吸附法监测血清中TNF-α 及IL-6的水平。使用美国邦德安百多导睡眠呼吸监测仪和飞利浦多普勒彩超仪检测三组研究对象的平均血氧饱和度(mean oxygen saturation,MSaO2)、最低血氧饱和度(thelowest oxygen saturation,LSaO2)、睡眠呼吸暂停低通气指数(apnea hypopnea index,AHI) 及PASP。
1.3 统计学方法
将本次研究中的数据录入到EXCEL 中,再导入SPSS 21.0 统计学软件进行分析。三组研究对象的BMI、年龄等计量资料用均数± 标准差(±s)表示,两组数据间的差异采用t检验,三组数据间的差异采用F 检验;计数资料用百分比(%)表示,采用χ² 检验。对各因素之间的相关性进行积差相关分析(秩相关分析)。以P<0.05 为差异具有统计学意义。
2 结果
2.1 观察组患者与对照1 组患者的MSaO2、LSaO2 及AHI
观察组患者的MSaO2及LSaO2均低于对照1 组患者,其AHI 高于对照1 组患者,P<0.05。详见表1。
表1 观察组患者与对照1 组患者的MSaO2、LSaO2 及AHI(± s)

表1 观察组患者与对照1 组患者的MSaO2、LSaO2 及AHI(± s)
组别 例数 MSaO2(%) LSaO2(%) AHI(次/h)观察组 32 82.74±5.29 64.89±4.27 46.24±3.69对照1 组 31 88.58±5.26 73.57±4.62 34.15±3.24 t 值 5.674 7.354 8.374 P 值 <0.05 <0.05 <0.05
2.2 三组研究对象ESR、血清TNF-α 及血清IL-6 的水平
三组研究对象ESR、血清TNF-α 及血清IL-6 的水平相比,P<0.05。对照1 组患者ESR、血清TNF-α 及血清IL-6 的水平均高于对照2 组研究对象,P<0.05。观察组患者ESR、血清TNF-α 及血清IL-6 的水平均高于对照1组患者及对照2 组研究对象,P<0.05。详见表2。
表2 三组研究对象ESR、血清TNF-α 及血清IL-6 的水平(± s)
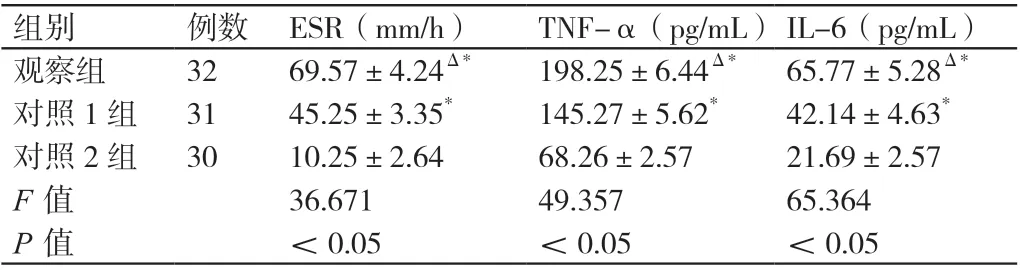
表2 三组研究对象ESR、血清TNF-α 及血清IL-6 的水平(± s)
注:Δ 与对照1 组相比,P <0.05 ;* 与对照2 组相比,P <0.05。
组别 例数 ESR(mm/h) TNF-α(pg/mL)IL-6(pg/mL)观察组 32 69.57±4.24Δ* 198.25±6.44Δ* 65.77±5.28Δ*对照1 组 31 45.25±3.35* 145.27±5.62* 42.14±4.63*对照2 组 30 10.25±2.64 68.26±2.57 21.69±2.57 F 值 36.671 49.357 65.364 P 值 <0.05 <0.05 <0.05
2.3 OSAHS 患者ESR、血清TNF-α 及血清IL-6 的水平与其PASP 的相关性
将观察组患者和对照1 组患者ESR、血清TNF-α 及血清IL-6 的水平与其PASP 进行相关性分析。分析的结果显示,两组患者ESR、血清TNF-α 及血清IL-6 的水平与其PASP 呈正相关性,P<0.05。详见表3。

表3 两组患者ESR、血清TNF-α 及血清IL-6 的水平与其PASP 相关性的r 值
3 讨论
目前,临床上对OSAHS 患者发生PH 的机制尚不明确。很多学者认为,OSAHS 患者的气道阻塞可引发间歇性缺氧,激活其体内的核因子κB。核因子κB 激活会加速TNF-α及IL-6 等炎性因子的过度表达。OSAHS 患者血清TNF-α及IL-6 的水平上升,可对其胸肺部血管造成损伤,进而增加其PASP,诱发PH[4]。TNF-α 是主要由巨噬细胞和单核细胞产生的一种促炎细胞因子,可参与炎症反应和免疫反应。OSAHS 患者血清TNF-α 水平升高可诱导产生活性氧,进而导致其发生血管内皮功能障碍,降低其血液中前列环素2 的水平。前列环素2 是由内皮细胞合成的抗血栓物质,具有强大的扩血管作用和抗血小板聚集作用。OSAHS 患者血液内前列环素2 的水平降低可促使其肺血管收缩,增加其肺循环的阻力[4]。OSAHS 患者血清TNF-α 水平升高还会导致其体内丙酮酸脱氢酶的水平降低,使其肺动脉平滑肌细胞内的线粒体超极化,促进肺动脉平滑肌细胞增殖,使其肺动脉重塑,进而增加其PASP,诱发PH。IL-6 是活化的T 细胞和成纤维细胞产生的淋巴因子。OSAHS 患者血清IL-6 的水平升高可激活IL-6/Janus 激酶通路,使其肺部血管过度收缩,进而增加其PASP,引发PH[5]。健康人的ESR 较低,其ESR 的波动范围较小。很多因素均可导致患者的ESR 升高。本次研究的结果显示,对照1 组患者的ESR 高于对照2 组研究对象,P<0.05 ;观察组患者的ESR 高于对照1 组患者及对照2 组研究对象,P<0.05 ;观察组患者和对照1 组患者的ESR 与其PASP 呈正相关性,P<0.05。我们由此推测,ESR 可能与TNF-α 及IL-6 一样,在OSAHS 患者发生PH 的过程中起到了一定的作用。但ESR 在OSAHS 患者发生PH 过程中的具体作用机制尚需经过大量深入的研究。此外,本次研究中我们使用多普勒彩超仪检测三组研究对象的PASP,而未能采用右心导管术(进行PH 相关科研时常用的一种技术)检测其PASP。这可能导致本次研究中的PASP 数据存在一定的误差。这也是本次研究中的不足之处。
本次研究的结果证实,与未患有PH 的OSAHS 患者及健康人相比,OSAHS 合并PH 患者ESR、血清TNF-α 及血清IL-6 的水平均较高,其缺氧的症状较重。OSAHS 患者ESR、血清TNF-α 及血清IL-6 的水平越高,其PASP 越高。

