蛋白-多糖复合凝胶性质及微观结构研究进展
陈炳宇 胡 晖 王 强 刘红芝
(中国农业科学院农产品加工研究所/农业部农产品加工综合性重点实验室 北京100193)
蛋白质和多糖是食品体系中应用最广泛的食品成分,这两种生物聚合物常被同时使用[1]。多糖因具有免疫活性、抗肿瘤、抗炎活性和抗氧化活性等生物学功能而备受关注,研究人员已成功地从植物、动物、微生物、脱脂花生粕中[2]提取。在食品和化妆品工业中,由于蛋白质和多糖具有凝胶、增稠和稳定表面的功能特性,所以常被用来构建结构和结构块,在食品质构、吸附水分、稳定脂肪、风味物质释放等诸多方面都起到重要作用[3]。本文讨论蛋白-多糖复合凝胶体系的构建,流变学性质,形成过程中微观结构变化以及应用研究现状,为富含多糖蛋白食品的精准开发与品质调控提供依据。
1 蛋白-多糖复合凝胶体系构建
现有研究表明,利用不同的原料构建、不同构建方法以及相同方法中不同的环境条件都会对多糖蛋白复合凝胶体系的性质产生不同程度的影响。
1.1 蛋白-多糖复合凝胶制备原料
目前,国内外关于蛋白-多糖复合凝胶的研究主要集中在大豆蛋白、豌豆蛋白、乳清蛋白,有少量针对花生蛋白[4-7]。对多糖的选择有阴离子多糖,例如黄原胶、卡拉胶,阳离子多糖壳聚糖,中性多糖葡聚糖等。部分蛋白-多糖复合凝胶制备原料见表1。
1.2 蛋白-多糖复合凝胶制备方法
蛋白凝胶的制备由3 个步骤组成,即:变性、聚集和凝胶。在典型的热致凝胶中,这些过程交织在一起,同时发生在加热过程。在冷凝胶中,变性和聚集与凝胶化的步骤是分离的。
1.2.1 冷致凝胶 冷致凝胶是一种在常温条件下形成的凝胶。优点是在较低浓度的蛋白质条件下也可形成凝胶[22]。冷致凝胶的形成过程包括两个步骤:第1 步,在低离子强度或高于蛋白质等电点的pH 值条件下加热蛋白质溶液来获得反应性蛋白质聚集体;第2 步,在常温条件下通过加盐或降低pH 值来改变溶剂性质,从而形成凝胶[22]。在第2 步之前将蛋白质聚集体与多糖溶液混合,将多糖引入冷凝胶化过程中产生各种不同的微结构。加热乳清蛋白和果胶,然后在低pH 值条件下共同促进这两种生物聚合物之间的相互作用,形成紧密而均匀的网络[23]。Laneuville 等[24]将黄原胶/乳球蛋白体系首次在低浓度、不需加热的情况下就得到较强的半透明凝胶。
1.2.2 热致凝胶 热凝胶是通过加热的方式使蛋白质变性,打开原本天然折叠状态变为伸展状态,同时暴露出包埋在分子内部的巯基和疏水基团,促进蛋白质分子间的交联和相互作用,许多蛋白质能够在加热过程中形成凝胶,在随后的冷却过程中凝胶强度会逐渐增强[25-26]。Nieto 等[27]在pH 3和pH 7 的条件下将15%的燕麦蛋白和0.5%的卡拉胶混合悬浮液于110 ℃油浴30 min 后得到热致凝胶。朱建华等[28]通过90 ℃恒温加热45 min,然后4 ℃冷藏12 h 获得大豆分离蛋白热致凝胶。Zasypkin D V 等[29]将3.4%~16.6%的β-乳球蛋白与0.9%的黄原胶混合,调节pH 值至6.85~6.93,87 ℃水浴加热40 min,得到热致凝胶。
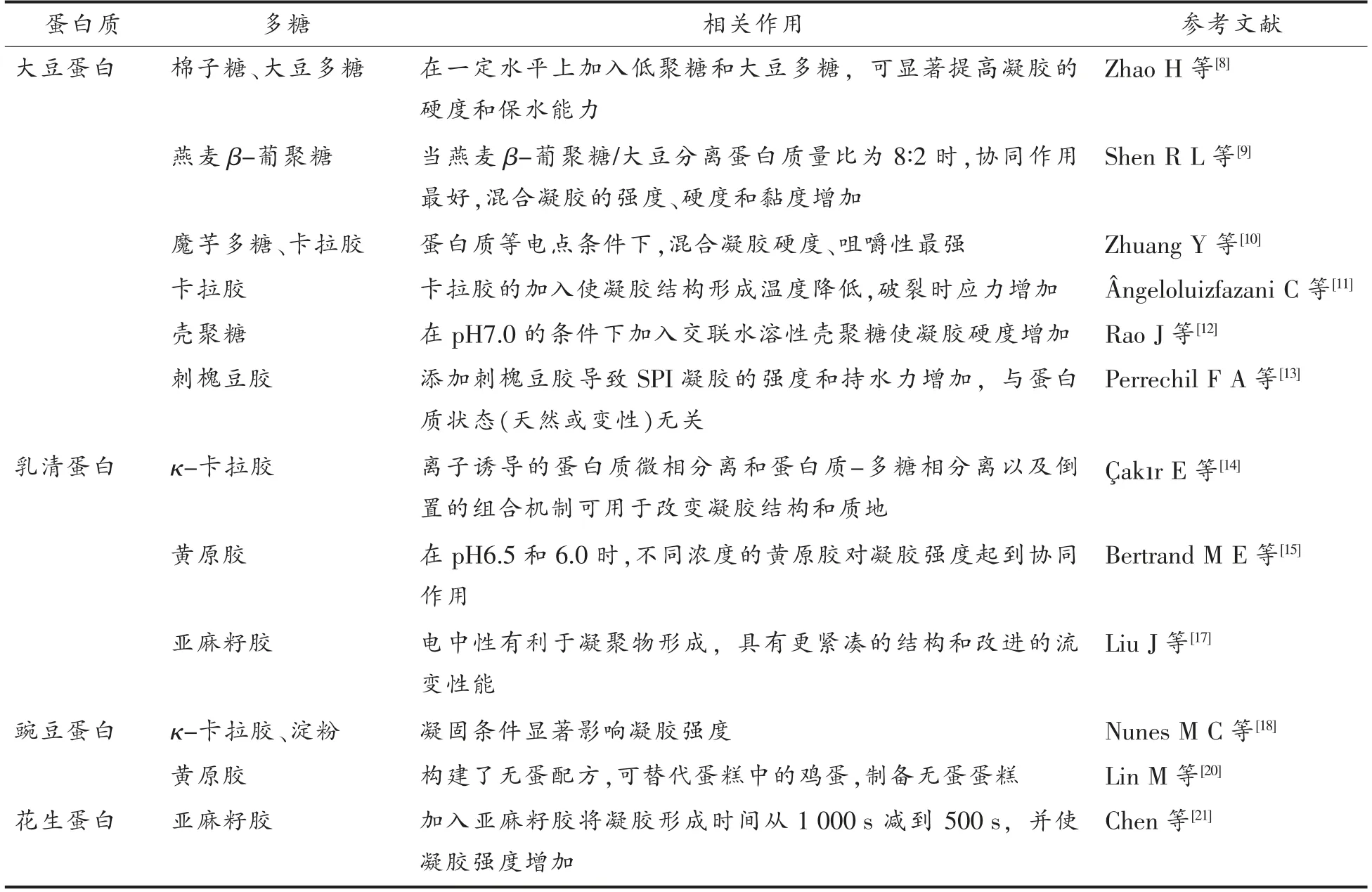
表1 部分蛋白-多糖复合凝胶研究现状Table 1 Research status of part polysaccharide-protein composite gels
1.3 影响蛋白-多糖复合凝胶的因素
蛋白与多糖间的相互作用主要是静电作用,很大程度上受到pH 值、离子强度和蛋白多糖的比例等多种因素的影响[30]。
1.3.1 pH 值 因添加酸或微生物发酵而引起的pH 值的变化改变了分子的净电荷,从而改变了分子间的吸引力和排斥力以及分子与溶剂的相互作用。此外,盐的溶解度随pH 值的变化而变化,这也会影响凝胶的形成[31]。
Bertrand M E 等[15]通过试验得出结论,当pH值接近蛋白质等电点时,凝胶的弹性模量升高,凝胶的微观结构从精细束状态向胶粒状态转变。此时,凝胶内部蛋白与蛋白之间的作用力非常强,降低了蛋白质的溶解度和分散性,而与溶剂间的作用力较弱,蛋白质和多糖两种大分子的碰撞几率减小。当溶液环境pH<pI 时,蛋白质显阳性,此时蛋白质与带有相反电荷的阴性多糖产生静电作用,形成不可溶复合物;当溶液环境pH>pI 时,蛋白质显阴性,多糖与蛋白质通过疏水相互作用和氢键作用形成可溶性复合物[32]。研究发现乳清蛋白/阿拉伯胶复合凝胶在pH4 的条件下凝胶的黏度、生物聚合物的浓度和相互作用的强度都达到最大值[33]。
1.3.2 多糖种类 带不同电荷密度的多糖会影响凝胶体系性质。多糖与蛋白所带的不同电荷的密度越大越容易发生静电作用。在pH3 的条件下,含有硫酸集团的卡拉胶与燕麦蛋白形成的复合凝胶要比葡聚糖与燕麦蛋白形成的复合凝胶更加致密、坚实[27]。含有硫酸基团的卡拉胶与蛋白质的相互作用比含有羧酸基团的果胶与蛋白质的相互作用要强[34]。
相同多糖不同的分子质量也会对凝胶体系性质产生影响。朱建华等[35]研究表明具有较大分子质量的葡聚糖分子与大豆7S 蛋白形成的热致凝胶的黏弹性增加,这是因为大分子质量的葡聚糖相对于小分子质量的葡聚糖在混合体系中占有更大的空间,降低了大豆7S 蛋白的临界凝胶浓度[35]。
1.3.3 离子种类及强度 不同种类的盐离子会对复合凝胶体系产生不同的影响。崔旭海等[36]研究发现随着钠离子浓度的增加,凝胶结构更加结实致密,网状孔隙变小,细胶束的聚集增加,形成纤细丝状的凝胶;随着钙离子浓度的增加,凝胶胶束变粗、不均匀,形成众多大小不一的蛋白聚集胶束,最终形成三维的网状凝胶。
即使是相同的盐离子,在不同的浓度条件下也会对复合凝胶体系产生不同的影响。将250 mmol/L NaCl 加入卡拉胶-乳清蛋白混合体系中,由于盐离子浓度过高产生静电屏蔽作用,因此不利于复合凝胶的形成。在50 mmol/L 和100 mmol/L NaCl 的低盐离子强度环境下,有利于静电复合[14,34]。庄远红等[10]研究发现在魔芋多糖-大豆分离蛋白复配体系中,随着KCl 加入量的增多,凝胶强度呈先增大后降低的趋势,咀嚼性、黏度和透明度持续减小。
1.3.4 蛋白质与多糖配比 在相同的pH 值和离子强度条件下,即使相同的蛋白质和多糖种类,因为不同配比也会影响复合凝胶的性质。只有在合适的蛋白质-多糖比例的前提下才能使两者最大程度地发生结合作用。在蛋白质-多糖比例5∶1 的条件下,卵清蛋白/黄原胶复合凝胶达到最大配合物生成量和最大剪切模量[37]。董吉林等[32]发现在燕麦β-葡聚糖/大豆分离蛋白配比为8∶2 时复合凝胶具有较好的质构特性。
在复合凝胶形成的过程中影响因素较多,目前存在原料如不同品种的大豆、花生等对相关产品品质有影响。针对导致产品品质波动的研究还不够深入,有待寻找适合加工凝胶食品的原料品种所具备的特征。
2 蛋白-多糖复合凝胶流变学性质
流变学是分析凝胶形成步骤以及评估最终产品质地的工具。使用流变学方法来评估食品的优点是将食品性质与分子理论联系起来,以描述食品以及预测食品或工艺条件对最终产品的影响[39]。
在食品中常用到的流变学性质研究方法是按照物质受力方式的不同分为动态测定和静态测定[4]。
2.1 静态测定
静态测定是在一定应力或应变下的稳态剪切流方法,其有一定的局限性,即在连续形变下常会造成高分子,尤其是多相/多组分高分子形态结构的变化甚至破坏,难以准确获得材料结构及大分子链段状态的信息[40]。
2.2 动态测定
动态测定是在周期应力或应变下的震荡剪切流,对被测物及结构的影响较小且所测结果的线性黏弹响应也比较敏感,多用于测定黏弹特性[40]。混合体系中所有凝聚层的储存模量G' 值比储存模量G''值高,表明凝胶状结构形成[41-42]。
蛋白-多糖复合凝胶的流变性能受到诸多因素的影响,其内因有蛋白质分子和多糖的分子质量、类型、柔韧性等;其外部因素包括pH 值、离子强度等[43]。流变测试为多糖蛋白质的结构特征及多糖蛋白质的混合物的稳定性提供了有价值的信息。由于形成了更大尺寸的体系,因此蛋白与多糖混合体系的性能不同于两者各自的性能。
2.2.1 模量变化 Dekkers 等[43]研究发现κ-卡拉胶与β-乳清蛋白复合凝胶在加热到90 ℃时呈现两相:首先是κ-卡拉胶网络的热诱导熔化对应储能模量降低;其次是储存模量增加对应于蛋白质网络的建立。对应于黄原胶和乳清蛋白混合体系加热后乳清分离蛋白变性、聚集,增加了与黄原胶的不相容性。相分离浓缩蛋白质导致储存模量增加[45]。加入0.05%黄原胶的蛋白凝胶贮存模量高于纯蛋白凝胶,且随着黄原胶的加入而降低。Xiong等[42]研究发现,以1∶3 的比例制备的壳聚糖-卵清蛋白复合凝胶的流变学特性在50 mmol/L 的临界盐浓度(CNaCl)表现不同:当CNaCl低于50 mmol/L时,储存模量增高,表现出更强的凝胶强度,盐离子增强了密度凝聚层结构的形成;当CNaCl高于50 mmol/L 时,储存模量降低,盐离子屏蔽效应导致复合凝胶弹性减弱。此外,将壳聚糖-卵清蛋白的比例从1∶1 增到1∶3 时,G' 值增加,显现更强的弹性。然而,进一步增加壳聚糖-卵清蛋白的比例会降低了凝聚层的G'值。Ru 等[41]研究发现,在牛血清蛋白和果胶混合体系中,当CNaCl从0.01 增到0.4 mol/L 时,混合体系贮存模量降低,牛血清蛋白-果胶凝聚体形成的临界pH 值降低;此外,当牛血清蛋白-果胶从1∶1 增到10∶1 时,混合体系储存模量增大,有利于牛血清蛋白/果胶凝聚体的形成。Zhao 等[8]研究了含有寡糖(蔗糖、棉子糖和水苏糖) 和大豆可溶性多糖的大豆蛋白形成的硫酸钙诱导的凝胶,添加质量分数1%,3%和5%的低聚糖以及0.3%和0.5%的大豆多糖,在温度循环、频率扫描、蠕变恢复试验和大变形特性测定后储能模量增加,表明上述糖类的附着增强了凝胶的弹性[8]。
2.2.2 黏弹性变化 Wang 等[46]研究发现,在凉粉草胶多糖-大豆分离蛋白混合体系中,低钙离子浓度(0.005~0.01 mol/L) 时混合凝胶的弹性和黏度增加,高浓度(0.015~0.02 mol/L) 时混合凝胶的弹性和黏度减少;在高钠离子浓度(0.015~0.02 mol/L)下,混合凝胶固体弹性较差。Raei 等[47]通过研究乳清蛋白/高甲氧基果胶在不同pH 值(3.0,3.5 和4.0)下的流变特性,发现凝聚层的复数黏度随频率线性降低,表明凝聚层的剪切变稀现象。Ru等[41]通过流变测定发现牛血清蛋白/果胶凝聚体具有高度连通的凝胶状网络结构,主要是弹性行为,复数黏度随频率呈线性下降,呈普遍的剪切变薄现象[41]。
流变响应可准确反映凝胶的结构变化,通过测定复合体系在低频区对频率变化的敏感度,可以发现凝胶形成的起点和时间;通过测定不同种类多糖对复合凝胶储存模量和损失模量的改变,可以研究影响凝胶弹性微观结构的机理。动态流变学是研究蛋白-多糖复合凝胶体系及其转变极为有效的方法[40]。
3 蛋白-多糖复合凝胶形成过程中微观结构的变化
蛋白质和多糖互作包含吸引或排斥,分别导致络合或热力学不相容性。蛋白质和多糖热力学不相容并在宏观上发生相分离形成两个体系,是因其微观结构上分子性质,如形状、大小或所带电荷等差异所致。在蛋白-多糖凝胶化的过程中形成宏观的均相体系,相分离发生在微观水平上。由此说明复合凝胶的最终微观结构是相分离和凝胶化过程间的平衡[49]。
为观察凝胶的微观结构,目前多采用共聚焦激光扫描显微镜 (CLSM) 和扫描电子显微镜(SEM)分别在超微米(CLSM)和亚微米(SEM)的水平上分析凝胶的网络结构。
3.1 共聚焦激光扫描显微镜观察结果
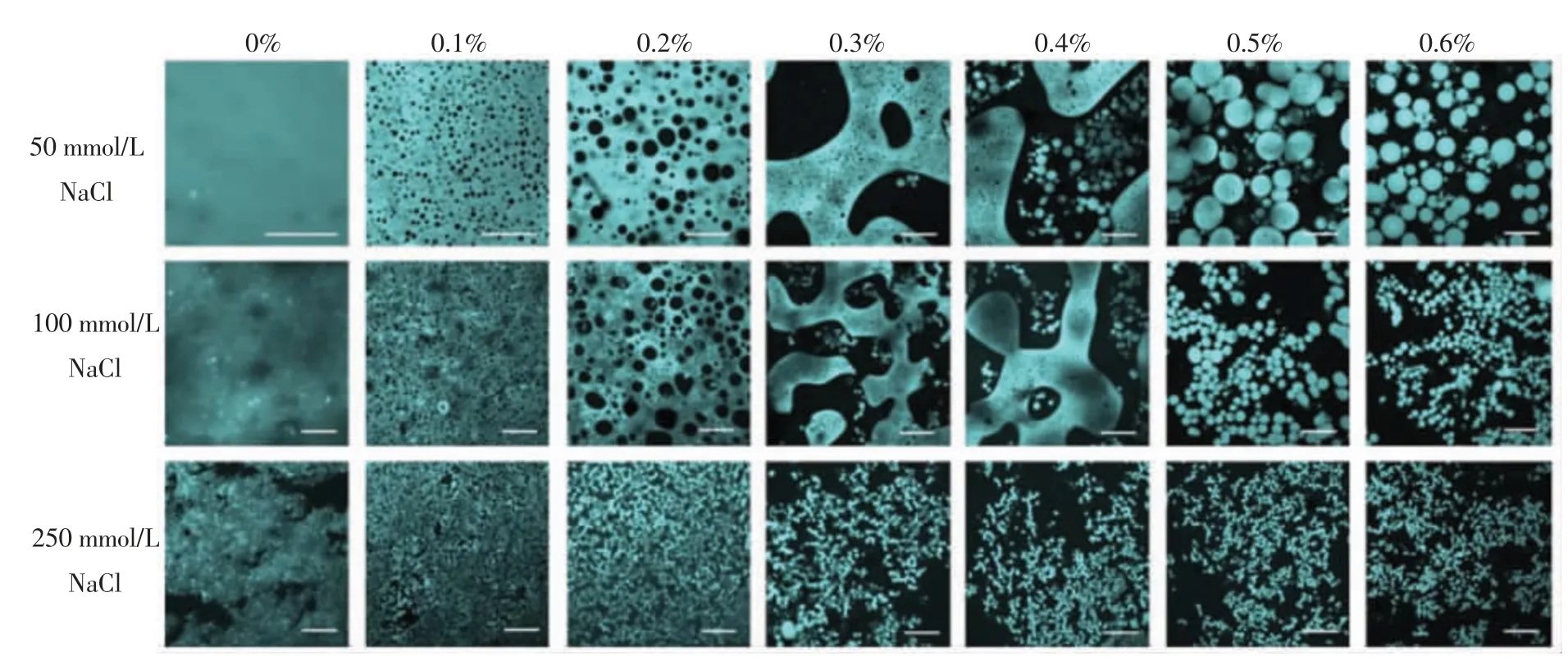
图1 3 种离子强度下乳清蛋白/κ-卡拉胶混合凝胶的微观结构[14]Fig.1 Microstructure of WPI/ k-carrageenan mixed gels at three ionic strengths as determined by CLSM[14]
借助Wang 等[46]发现乳清蛋白/κ-卡拉胶复合凝胶中,在低浓度阳离子条件下,当卡拉胶浓度较低时凝胶表现出均匀的性质;随着卡拉胶浓度的增加,在含0.3%~0.4%κ-卡拉胶时,κ-卡拉胶相的体积分数增大,连续蛋白质网络被破坏,分散的κ-卡拉胶穿过乳清蛋白相转变成连续的通道,形成双连续微结构;在0.5%~0.6%κ-卡拉胶时,蛋白质相的连续性消失,网络倒置成κ-卡拉胶的连续结构;在高盐浓度下,蛋白质与多糖的不相容性更为明显。当果胶质量分数>0.2%时,Munialo C D等[4]也通过CLSM 在乳清蛋白/果胶复合凝胶中观察到相分离现象。朱建华等[28]研究表明大豆分离蛋白-葡聚糖复合凝胶随葡聚糖浓度及分子质量的增加,样品微观结构中的相分离程度加大,对凝胶结构有协同弱化效应。Shen 等[9]在燕麦β-葡聚糖-大豆分离蛋白复合凝胶中,用刚果红分子标记燕麦β-葡聚糖分子的红色区域,与大豆分离蛋白的黑色区域存在一定的交叉,表明两者具有显著的相互作用,形成相同的混合区域。又通过分子模拟外推出两者之间的相互作用主要是氢键。Nunes等[18]通过激光扫描共聚焦显微镜观察豌豆蛋白-卡拉胶复合凝胶及其在不同降温条件下的结构,发现快速冷却使蛋白质聚集体的分布更加均匀,提高了结面积,减慢了相分离过程,更加有利于蛋白质网络化。
3.2 扫描电子显微镜观察结果
为了在亚微米水平上显示微观结构,Çakır E等[14]使用SEM 观察,发现在低浓度下,普鲁兰多糖-乳清蛋白复合凝胶在孔径大小、链厚、粗度等方面没有明显的变化,而在高浓度条件下发生变化。Aguilar 等[49]借助SEM 观察到:含有0.3%的κ-卡拉胶-蛋黄凝胶,在pH3.5 的条件下形成的微结构松散,凝胶形成能力差于在pH4.5 和pH6 时形成的凝胶,推断带正电荷蛋白表面和带负电荷的多糖大分子之间的静电吸引作用抑制了蛋白质聚集体间的作用,有利于将蛋白质聚集体包裹到多糖网络中。
由于多糖和蛋白质是大分子物质,具有分散性,分析检测方法有限,并且多糖的分子结构尚不明确,因此目前对蛋白-多糖复合物结构的研究较少,相关研究应该深入。现阶段有研究者采用分子模拟的手段进行研究,然而其使用范围有限,并且准确性有待联合其它方法同时使用来加以佐证。
4 蛋白-多糖复合凝胶的应用

图2 不同pH 值条件下含45%固体的蛋黄凝胶、蛋黄/κ-卡拉胶混合凝胶的SEM 图像Fig.2 SEM images for EY and EY/κC gels containing 45% solids at different pH values
蛋白质和多糖是食品的主要成分,二者的相互作用在食品工业上有重要的应用,如在生产食品、制备微型胶囊或在分离和纯化蛋白质等方面。许多食品以凝胶的形式销售,例如果酱、果冻、糖果制品、甜点、速成凝胶以及水果蔬菜制品、豆制品。蛋白-多糖复合凝胶在食品中的作用如下:
1)改善食品感官特性 利用一些蛋白-多糖复合凝胶所表现出的协同能力,提高凝胶的物理特性。多糖具有控制食物质地和控制风味释放的能力,在蛋白质凝胶中加入多糖,有助于提高食品的感官特性和口感[31]。Tolstoguzov 等[50]申请了蛋白质-多糖复合物模拟肉末的专利,其中蛋白质来源有大豆蛋白、酵母蛋白等,多糖来源为果胶酸盐、海藻酸盐或低酯果胶。对混合物热处理得到的产物可以很好地模拟肉末质地。Lin M 等[20]用分离的豌豆蛋白、黄原胶和乳化剂混合物进行研究,制备适合素食主义者的无蛋蛋糕。
2)改善食品凝胶稳定性 蛋白-多糖复合凝胶被认为是一种新型的胶凝剂,可以提高食品体系的凝胶稳定性,通过控制蛋白-多糖复合凝胶形成条件,控制凝胶的流变特性。例如,酪朊酸钠与海藻酸钠形成的凝胶,在80 ℃不融化。更为有意义的是:两大分子组分在不能单独形成凝胶的条件下,混合后能形成凝胶体,如明胶-海藻酸钠复合物,其凝胶特性随组成配比、pH 值和离子强度的变化而变化[52]。
目前食品行业针对蛋白-多糖复合凝胶的研究主要有两个方向:一是提高凝胶性质的复合体系来提高现有产品特性;二是开发出具有肉类咀嚼性,可替代肉类的素食模拟产品[53]。目前前者居多,后者较少。由于素食越来越受消费者喜爱,因此应加强开发替代肉类的素食模拟产品。

图3 燕麦β-葡聚糖(4%)和 燕麦β-葡聚糖-大豆分离蛋白(4%,8∶2)构象模拟[9]Fig.3 The simulation of conformation of OG (4%) and OG/SPI (4%,8∶2) [9]
5 小结
综上所述,目前在蛋白-多糖复合凝胶性质及微观结构研究方面还存在以下问题:1)影响蛋白-多糖复合凝胶的因素有pH 值、多糖种类、离子种类及强度,蛋白质与多糖配比等。目前相关研究多停留在蛋白和多糖在纯体系中的相互作用和微观结构,能给予实际生产中的食品加工复杂体系的指导意义有限,因此需要在此基础上开展复杂体系中蛋白和多糖的作用、凝胶性质和结构的研究,寻找适合加工凝胶食品的原料和条件所具备的特征。2)由于大分子的分散性和多糖分子结构研究尚未透彻以及分析检测方式有限等原因限制了相关研究。针对蛋白-多糖复合凝胶形成过程中微观结构的变化,现在多采用共聚焦激光扫描显微镜和扫描电子显微镜,仅在超微米和亚微米的水平上分析凝胶的网络结构。3)目前国内外已开展大豆蛋白、豌豆蛋白与多糖复合凝胶相关研究,而花生作为我国的优势作物,花生蛋白作为亟待开发的优势资源,花生蛋白与多糖复合凝胶尚有待进一步研究。
针对上述问题,亟待开展以下研究:
1)将理论研究与实际生产相结合,寻找适合加工凝胶食品的原料和条件所具备的特征要求。
2)进一步结合多糖分子结构最新研究,结合分子间相互作用的研究,从多尺度、各层级对复合凝胶形成过程中的微观结构进行研究。
3)进一步加深对花生蛋白与多糖的复合凝胶体系的研究,为开发重组食品和具有足够机械完整性、长货架期、营养以及消费者可接受性的新型食品奠定基础。

