高F值寡肽M2和M3对小鼠肠道微生态的影响
王春利 王志高 王一凡 余新威 罗红宇*
(1 浙江省海产品健康危害因素关键技术研究重点实验室 浙江海洋大学 浙江舟山316022 2 舟山市疾病预防控制中心 浙江舟山316021)
随着近年生命科学技术的发展,越来越多的研究证实人体的健康不仅与自身的基因有关,还与其肠道中微生物有着重要联系。人体肠道菌群的编码基因组被看作人体的第二基因组,人体自身基因的表达与肠道微生物相互协调、和谐一致,共同影响着人体的营养摄入、代谢和免疫的调控。到目前为止,众多对肠道菌群的研究证明,其通过影响宿主的代谢显型、营养物质的产生和吸收[1]以及改善和调整机体的免疫功能[2],进而影响机体的健康状况。肠道内菌群的动态平衡若被打破则会导致人体功能紊乱,从而引发各类疾病。生物活性肽具有多种理化性质,对多种代谢途径和生理环境起着积极作用,肠道菌群作为体内代谢活动的一部分,生物活性肽对此有着重要的影响,如乳源生物活性肽(MDBPs)主要是通过蛋白酶水解乳汁中的乳清蛋白和酪蛋白(casein,CN)或者微生物发酵乳制品制备得到的小分子肽段,这种小分子肽不仅可以促进肠道对于营养物质吸收,促进肠道免疫细胞增殖和增强巨噬细胞吞噬作用,还可以缓解断奶或肠炎引发的氧化应激反应,同时对于抑制肠道有害致病菌,改善肠道微生态环境均有一定的功效[3]。近年来,抗菌肽(Antimicrobial peptides,AMPs) 作为饲用抗生素替代品的研究与应用成为饲料添加剂研究热点之一。翟少伟等[4]在饲料中添加抗菌肽Surfactin,可提高吉富罗非鱼肠道皱襞高度,调节肠道菌群,提高肠道抗氧化能力,从而改善吉富罗非鱼肠道健康状态。印虹等[5]研究表明生物活性肽对肠道SIgA 有一定促分泌作用,同时能够增加肠绒毛长度,改善肠黏膜结构,因而在促进肠黏膜免疫,改善肠道黏膜结构,减少肠道有害菌群数量和增强肠道生物屏障方面具有积极作用。伴大豆球蛋白酶解肽是模拟人体肠道环境,用胃蛋白酶水解大豆蛋白所得产物。左伟勇[6]推测,伴大豆球蛋白酶解肽不仅能促进体内双歧杆菌的增殖,而且对机体黏膜免疫功能也有一定的作用。杨玉荣[7]用大豆活性肽饲喂的肉鸡的肠道黏膜消化吸收功能增强,在肉鸡生长过程中,大豆活性肽提高肉鸡肠道有益菌/有害菌的比值,且高于抗生素组,验证了大豆活性肽可以改善肠道黏膜结构。在其它研究中也发现大豆活性肽能够提高肉鸡的生产性能[8]。在哺乳仔猪日粮中添加一定量植物活性肽,能够大大增强大肠内乳酸菌等有益菌群的繁殖,有效抑制大肠杆菌、沙门氏菌等有害菌群的繁殖[9]。
高F 值寡肽是由2~9 个氨基酸残基所组成且支链氨基酸与芳香族氨基酸比值大于20 的一种混合肽,其独特的氨基酸构成、生理调节功能和易消化吸收等诸多优点,成为近年来保健和医学领域研究的热点。对高F 值寡肽的研究多集中在制备及体外活性方面,而其在消化吸收过程中对肠道菌群结构的影响未见报道。
课题组前期利用水产加工下脚料制备了高F值寡肽,通过分离纯化得到5 个寡肽单体,并测定了寡肽的氨基酸序列。通过分析选取其中的两个寡肽M2、M3 进行合成。本文采用合成的两个寡肽灌胃小鼠,分析其肠道菌群结构的变化。目的是探究高F 值寡肽调控小鼠肠道菌群结构的变化规律,找出其显著干预的关键菌属,为高F 值寡肽及相关的益生菌制剂的研发提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试剂 高F 值寡肽M2(Leu-Leu-Asp-Val-Tyr;)、M3 (Leu-Leu-Phe-Thr-Thr-Gln;)(纯度大于95%),由上海波泰生物科技有限公司合成;DNA 快速提取试剂盒,杭州荣邦生物科技有限公司;硫酸葡聚糖(Dextran sulfate sodium,36 000~50 000,MPBiomeidcals 公司;白细胞介素10(IL-10)ELISA 试剂盒、肿瘤坏死因子(TNF-α)ELISA试剂盒,舟山市新城科博实验仪器有限公司。
1.1.2 实验动物 清洁级Balb/c 小鼠,7 周龄,雄性,体重18~23 g,购于浙江省实验动物中心。动物饲养于清洁级动物房中,温度(24±1) °C,12 h 光照/黑暗循环,动物饲养使用标准鼠粮和水。所有动物实验按照浙江海洋大学动物伦理委员会有关规定进行。
1.2 主要设备与仪器
日立CR21G 型高速离心机,日本日立公司;HHS 型恒温水浴锅,上海迅播实业有限公司;Nano Drop2000,Thermo Fisher Scientific 公司;BT125D 型电子天平,塞利多斯科学仪器有限公司;THERMO 酶标仪,上海辅泽商贸有限公司。
1.3 试验方法
将40 只小鼠进行1 周的适应性喂养后,挑选身高、体重相近,精力旺盛的小鼠,按每组10 只随机分为3 组,分别命名为M2 组、M3 组与空白组。在正常饮食的基础上,每天18:00 对各组小鼠分别灌胃M2、M3 及等量的水,灌胃量均为0.1 mL/小鼠,具体灌胃方案见表1。1 周后处死小鼠,收集肠道内容物并提取肠道菌群DNA。用nano drop2000 微量紫外分光光度法检测提取的DNA浓度。抽取每组浓度最高的5 个样品进行16s rRNA 测序,相似性分析(Anosim)、韦恩图(OTUvenn)、从主成分分析 (OUT PCA)、主坐标分析(PCoA)、组间群落差异分析(LDA EffectSize)。

表1 小鼠的分组及给药方案Table 1 Grouping of mice and dosing regimen
2 试验结果
2.1 样品组成的组间及组内差异分析
Anosim 分析是利用R 参数值检测组间差异是否显著大于组内差异,若R 大于0,说明组间差异大于组内差异,且P 值越小组间差异越大。PCoA 分析是通过UniFrac 算法计算样品两两间的距离,样品间距离越近,两个样品的组成越相近,也可反映各样品间差异的大小。
试验样品的Anosim 分析如图1所示。R 值为0.491,P 值为0.001,远小于0.05,说明3 组小鼠肠道菌群组成差异极其显著,且组间差异远大于组内差异,分组是成功的。
试验样品的PCoA 分析如图2所示。A、B 两组样品集中分布在图的左中央,样品两两间距离较近,然而,同组样品间距离小于组间样品距离;空白组样品主要分布于图的右侧区域,5 个样品间距离较远。由此说明,A、B 两组样品组内组成相似,而组间存在差异。两个寡肽组与空白组样品的差异极显著,和用Anosim 分析的结论一致。图1中A 组有一个样品与B 组的一个样品间距太小以至于重合,可能是因个体差异所致的偶然误差。

图1 Unweighted unifrac anosim 分析得到各组小鼠肠道菌群的分布图Fig.1 Distribution map of the intestinal flora of each group of mice obtained from the analysis of Unweighted unifrac anosim

图2 Unweighted unifrac PcoA 分析得到的3 组小鼠肠道菌群分布图Fig.2 Distribution map of the intestinal flora of three groups of mice obtained from the analysis of unweighted unifrac anosim
2.2 样品的物种组成分析
2.2.1 OTU Venn 图分析 OTU Venn 图分析是基于高通量测序获得的序列相似度进行归类分析的,序列相似度大于97%的reads 划分为同一个OTU,视为一个微生物物种,否则划分为新的OTU。OTU 代表序列与数据库进行比对,可获得对应样品的物种信息,并判断组间共有或特有的OTU[10]。本试验的OTU 代表序列混合聚类结果,如图3所示。15 个样品共得到931 个OTU,A 组有456 个OTU,6 个OTU 为特有;B 组450 个OTU,4 个OTU 为特有;C 组889 个OTU,430 个OTU为特有,3 组共享OTU 373 个,占总OTU 的40.1%。由此可知,灌胃寡肽后,小鼠肠道内的原生菌群减少,肠道菌群的多样性降低,说明高F 值寡肽可显著改变小鼠肠道的菌落结构,减少菌群多样性的同时,激活某些肠道菌成为优势菌。
2.2.2 OTU PCA 分析 OTU PCA 分析是将不同样品的OTU 差异以距离的形式反映在二维坐标轴上,以对样品OTU 方差贡献最大的前两个特征值为坐标轴。该分析可反映组内与组间的样品分散和聚集的情况,从而评判相同条件下样品OTU组成是否存在相似性[11]。样品的距离越近,说明样品微生物群落组成越相似。

图3 各组小鼠肠道内OTU Venn 图分析Fig.3 Analysis of intestinal OTU venn plot in mice
3 组样品和A、B 两组样品的OTU PCA 分析分别见图4a、4b。因A、B 两组OTU 组成相似,故图中两组间及组内的样品点均集中分布于坐标轴(-10,-10)附近区域,且样品间的距离很近。A 组样品点集中于左侧上方区域,B 组样品点集中于左侧下方区域,表明两组物种组成仍存在差异;而C 组平均分布于坐标轴(0~20,0~10)区域,且C 组与A、B 两组OTU 组分差异较大,表现为组间样品点与点之间的离散程度很大,同组内的点离散度也较大。这与样品分组的Anosim、OUT PCA 分析结论以及OTU Venn 图分析结果是一致的。

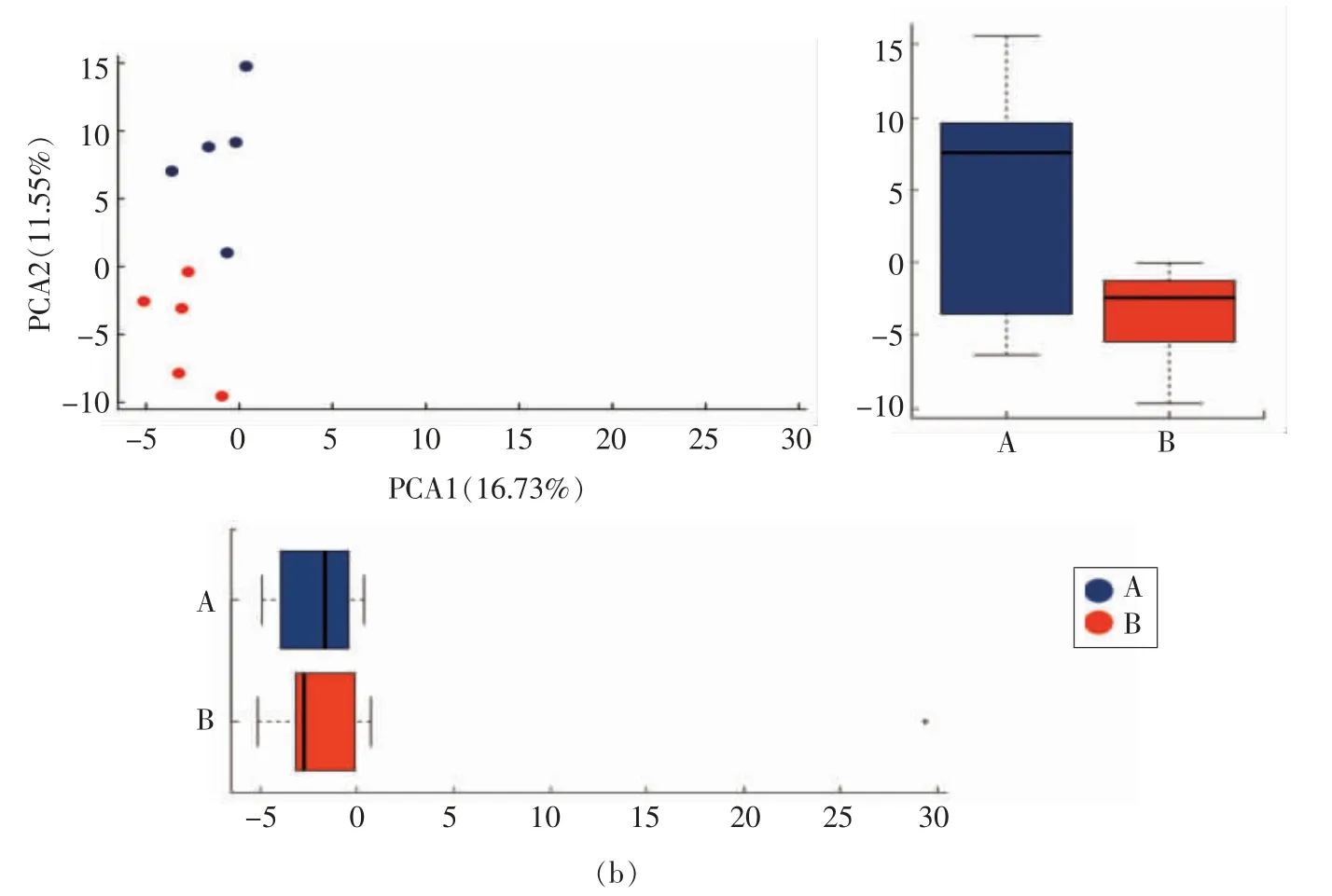
图4 样品的OUT PCA 分析Fig.4 OUT PCA analysis of samples
2.3 物种丰度分析
根据3 组样品的测序结果,绘制门、科水平上肠道菌群中各物种的相对丰度柱状图 (图5、图6),其中不同颜色代表不同菌属,色块长度代表其相对丰度比例。从图5和图6中反映不同分类等级中各组丰度较高物种及其比例,
对门水平上的物种丰度分析显示:拟杆菌门和硬壁菌门所占比例在3 组的丰度中均位列第一、第二,两门的总量在A、B、C 组3 组中分别为90.17%,91.73 和88.20%;A、B 组中丰度较高的菌属都是变形菌门和柔膜菌门,两门所占比例在A组中分别为5.83%和3.48%,在B 组中分别为4.00%和3.65%,而C 组中丰度较高的仅有变形菌门,所占比例为10.64%。

图5 小鼠肠道菌群在门水平上的组成Fig.5 Phylum level barplot of intestinal flora in mice

图6 小鼠肠道菌群在科水平上的组成Fig.6 Family level barplot of intestinal flora in mice
对科水平上的物种多样性分析显示:3 组样品丰度排名前5 的分别为紫单胞菌科(Porphyromonadaceae)、毛螺菌科(Lachnospiraceae)、理研菌科 (Rikenellaceae)、普雷沃氏菌科(Prevotellaceae)和拟杆菌科(Bacteroidaceae),5 类菌总量均超过80%,属于3 组中的优势菌。然而,同一类菌所占比例存在组间差异,C 组紫单胞菌科含量为46.47%,占绝对优势,显著高于A、B 组中的含量。A、B 两组紫单胞菌科和毛螺菌科含量相近,且两组中毛螺菌科、理研菌科、普雷沃氏菌科总量明显高于C 组。A、B、C 3 组中拟杆菌科所占比例相似(表2)。

表2 科水平上小鼠肠道菌种的含量分布Table 2 Content distribution of intestinal flora in mice at the level of family
2.4 LDA EffectSize(LefSe)组间群落差异分析
LefSe 分析可显示不同组中丰度有显著差异的物种,柱状图的长度代表显著差异物种的影响程度,进化分支图由内至外辐射的圆圈代表从界到属的分类级别,黄色表示无显著差异的物种,差异物种用分组颜色表示。因菌种对肠道菌群的影响主要体现在科、属水平上,故探讨各组样品于科、属水平上的特有菌种。如图7所示,绿色、红色和蓝色分别代表空白组、M3 寡肽组和M2 寡肽组含量具有明显差异的菌种。空白组的菌种最多,与前述的OTU venn 的分析一致。M2 寡肽组的特有菌种主要为无形小体科(Anaeroplasmataceae),M3寡肽组的特有菌种为理研菌科、另枝菌属(Alistipes)和甲基杆菌科(Methylobacteriaceae),空白组的特有菌种为紫单胞菌科和莫拉菌科(Moraxellaceae)。

图7 小鼠肠道菌群的LefSe 分析Fig.7 LefSe analysis of intestinal flora in mice
3 结论
通过Anosim 分析验证样品分组成功后,采用OTU PCA 和PCOA 分析A、B 两组和C 组之间存在差异,而A、B 两组的菌群差异较小,与C 组的菌群组成存在较大差异。
在门水平上进行物种丰度分析时发现,A、B两组中拟杆菌门和硬壁菌门的总量分别为90.17%和91.73%,而C 组总量为88.20%。一般情况下,正常机体的拟杆菌门和硬壁菌门的总量大于90%[12],这说明通过灌胃M2、M3 寡肽可以改善小鼠肠道菌群在门水平上的分布并趋于正常。在对小鼠生理活性影响较大的科水平分析来看,A、B 两组相较于C 组存在大量的毛螺菌科、理研菌科和普雷沃氏菌科,而C 组比A、B 两组存在更多的紫单胞菌科。有研究表明,毛螺菌科在肠道中分解氨基酸并将其转换为肠道细胞的营养来源过程中起很大作用影;Dubin 等[13]在药物对转移性黑色素瘤病人治疗效果的研究发现,药物治疗后有些患者会患有肠炎,与没有肠炎副反应的患者相比,其体内的拟杆菌群,特别是理研菌科的含量显著降低,据此推测理研菌科具有保护肠道,减少应激条件下发生肠炎的概率。刘蓉蓓[14]在对腹泻主导的肠易刺激综合症(IBS)患者研究时发现,普雷沃氏菌属可能抑制肠道菌群结构紊乱;紫单胞菌科是人体和动物肠道与口腔中的土著微生物,然而,紫单胞菌科中某些菌种会导致人或动物的感染[15]。如吴芳等[16]研究发现,牙周病炎症患者口腔中比正常人的紫单胞菌属显著增加。由此推测,给小鼠灌胃M2、M3 寡肽可增加小鼠肠道中的有益菌,同时减少肠道有害菌,改善了小鼠肠道的菌群结构,保持健康的肠道微生态环境。
进一步分析各组小鼠肠道含量较高的特有菌时发现,M2 寡肽组的优势特有菌为无形小体科。Kawahara[17]在对日本野生小鼠及蜱虫体内分离出的无形小体科分析时发现,无形小体科属于小鼠及蜱虫内常驻菌,当人体被带有无形小体科的小鼠或蜱虫叮咬后导致人粒细胞无形体病(HGA)的发生。M3 寡肽组的优势特有菌为理研菌科、另枝菌属和甲基杆菌科,理研菌科具有预防肠炎,保护肠道的功能。目前另枝菌属的功效尚不明确,有研究发现,随着季节变换,森林姬鼠(Apodemusdraco)食物由昆虫转变为植物种子时,另枝菌属在森林姬鼠肠道内的数量显著提高[18]。据此推测另枝菌属的增加可能是为了适应食物来源的改变,具有某种特定消化功能,对机体无害;甲基杆菌是一类产红色色素、特异性甲基营养型细菌,不仅可以水解淀粉,而且除利用果糖外还有独特的碳源利用特性[19]。空白组的优势特有菌为紫单胞菌科和莫拉菌科,莫拉氏菌为人和动物器官黏膜中的常驻菌,属条件致病菌,损害机体免疫而导致支气管、肺部的感染[20]。近年来对不液化莫拉氏菌所引发的败血症报道较多。
综上分析,本文研究发现,对小鼠灌胃高F 值寡肽单体M2、M3,可以明显改变小鼠肠道菌群的结构。与空白组相比,虽然肠道菌群的多样性下降,但是小鼠肠道菌群中益生菌相对增加,并成为优势菌,特别是灌胃M3 寡肽组的小鼠肠道优势菌和特有菌对防病治病都显示一定的功效。后续将研究高F 值寡肽M3 在抗炎方面的活性。
——细胞生长因子

