食管上段异位胃黏膜危险因素的研究
吐尔逊阿依·热夏提 高 峰
新疆维吾尔自治区人民医院消化内科(830001)
背景:近年食管上段异位胃黏膜(HGMUE)逐渐受到重视,HGMUE引起的食管狭窄、食管网、异型增生和食管上段腺癌的发生率逐渐增高。目的:总结HGMUE患者的临床病理特点,分析其可能的危险因素。方法:收集2018年9月—2019年10月新疆维吾尔自治区人民医院确诊的150例HGMUE患者,以150例非HGMUE患者作为对照。对HGMUE的相关危险因素行单因素分析和多因素分析。结果:单因素分析结果显示,HGMUE组饮酒(P=0.029)、合并Barrett食管(P=0.003)、合并反流性食管炎(P=0.001)的发生率显著高于对照组,而两组性别、年龄、BMI、吸烟史、PPI服用史、阿司匹林服用史、是否合并食管裂孔疝、Hp感染、消化性溃疡相比差异无统计学意义。非条件多因素Logistic回归分析显示,饮酒、合并Barrett食管或反流性食管炎均为HGMUE的独立危险因素(P<0.05)。结论:饮酒、合并Barrett食管或反流性食管炎可提高患HGMUE的风险。
食管上段异位胃黏膜(heterotopic gastric mucosa of upper esophagus, HGMUE)于1805年首先由Schmidt报道[1],是一种位于颈段食管的异常胃底型上皮。目前HGMUE的发病机制仍未阐明。由于其多位于食管括约肌附近,而该部位肌肉常处于紧缩状态,故HGMUE常被多数内镜医师所忽略。异位胃型柱状上皮包括壁细胞[2],能分泌酸性分泌物。持续的酸分泌和反流可导致反酸、烧心、吞咽困难、吞咽痛、咳嗽、胸骨后不适、声音嘶哑、不典型胸痛、异物感等食管和食管外症状。研究表明,20%~73.1%的HGMUE患者表现出相关咽喉部症状[3]。病灶局部持续受大量酸性物质的刺激,导致局部食管狭窄[4]、食管蹼、食管糜烂、肠化生[5]、高级别上皮内瘤变[6]、食管腺癌[7]等诸多并发症。因此,了解HGMUE的危险因素有助于干预暴露因素,使HGMUE的发生风险有所下降,并减少并发症的发生。本研究通过分析HGMUE患者临床病理特点和一般资料,旨在探讨HGMUE可能的危险因素,从而为其临床诊治提供一定的理论依据。
对象与方法
一、研究对象
纳入2018年9月—2019年10月新疆维吾尔自治区人民医院确诊的HGMUE患者150例,选取同期胃镜检查证实无HGMUE的患者150例作为对照组。为排除有痛胃镜对患者依从性差异的干扰,入选病例均自愿行无痛胃镜。内镜下发现与周围正常食管鳞状上皮有明显分界的红色或玫瑰色卵圆形指肚样病灶为可疑HGMUE病例,并进一步完善病灶活检证实胃型黏膜的存在,从而明确诊断为HGMUE。纳入标准:①年龄≥18岁;②临床资料完整;③病例组、对照组均为行无痛胃镜的患者,其中病例组需经病理检查明确诊断为HGMUE。排除标准:①不符合纳入标准者;②内镜检查前准备不充分者(包括未按照内镜检查要求空腹以及因胃肠动力因素影响内镜诊断者);③既往有食管、胸腹部手术史;④上消化道出血者;⑤严重的食管病变影响诊断者。本研究方案由新疆维吾尔自治区人民医院伦理委员会审批通过。所有入选病例均签署知情同意书。
二、研究方法
1. 胃镜检查:胃镜检查由数位胃镜操作例数超过一万例的资深内镜医师完成,参与内镜检查的所有医师开始研究前接受统一培训,对颈段食管给予特殊关注。所有入选者自愿行无痛胃镜,患者术前两天接受半流质饮食,术前8~12 h禁食。患者采取左侧卧位,当缓慢退镜至距门齿30 cm处时,反复短暂充气并旋转镜身对该部位进行仔细检查并摄片,注意观察该段食管全周黏膜的颜色改变。
2. 数据收集:采用回顾性研究方法,通过电话随访、问卷调查和翻阅病历资料等方式,详细记录患者性别、年龄、文化程度、BMI、吸烟史、饮酒史等一般资料以及反酸、烧心、吞咽困难、吞咽痛、咳嗽、胸骨后不适、声音嘶哑、不典型胸痛、异物感等相关症状,分析HGMUE可能的危险因素。入选者均接受电话随访并填写统一化调查问卷。问卷内容包括吸烟史、饮酒史、行胃镜检查前3个月PPI或H2受体拮抗剂类药物使用史、阿司匹林和其他NSAID类药物使用史等。问卷同时涉及临床症状的记录,若有不适症状,应详细记录其发生频率、持续时间、缓解方式等。
3. 相关指标的定义
①HGMUE:HGMUE在标准胃镜下呈红色或玫瑰色卵圆形指肚样病灶,多位于距门齿15~20 cm处,与周围正常食管鳞状上皮有明显的分界。病变形态可以是平的,也可突出食管表面表现为隆起性病变,一些特殊病例亦可表现为息肉样病变。内镜下疑似HGMUE的患者需完善病灶活检证实胃型黏膜的存在,从而明确诊断。
②Barrett食管:Barrett食管的诊断标准参照2011年我国Barrett食管诊治共识[8],即肠化生的单层柱状上皮取代食管原有的复层鳞状上皮,无论伴或不伴肠化生。普通白光下Barrett食管表现为与HGMUE相似的天鹅绒样粉红色病灶,常位于食管中下段。Barrett食管病理分型根据内镜下表现分为贲门腺型、胃底腺型、特殊类型肠化生型。
③反流性食管炎:反流性食管炎的分级使用洛杉矶分类标准,正常:食管黏膜无任何损伤;A级:直径<5 mm的食管黏膜破损至少存在1个或以上;B级:存在1个或以上的长径>5 mm的黏膜破损,但未融合;C级:出现融合性病变,且病变范围<75%的食管环周;D级:食管黏膜融合性病变至少>75%的食管环周。在安静呼吸过程中,如患者膈肌上方胃褶的最大长度为20 mm或更长,则认为存在食管裂孔疝。
④饮酒:有长期饮酒史,一般超过5年,折合乙醇量男性≥40 g/d,女性≥20 g/d;或近2周内有大量饮酒史,折合乙醇量>80 g/d。乙醇量(g)=饮酒量(mL)×乙醇含量(%)×0.8。
⑤吸烟:吸烟指数>30定义为吸烟,吸烟指数=平均每天吸烟支数×吸烟年数。
三、统计学分析

结 果
一、HGMUE的内镜下鉴别
HGMUE在标准内镜下表现为玫红色-橙红色天鹅绒状指肚样黏膜斑块,在常规成像下与周围食管灰色正常黏膜有分明的界限。异位的黏膜可单个出现,也可呈现为两个或以上的病灶。在规定的研究时间段内,共发现HGMUE患者186例,检出率为1.4%。其中,6例内镜下HGMUE患者的活检标本过浅,无法证实柱状上皮的存在,故排除;30例经内镜和病理检查确诊的患者临床资料不完整,故剔除。在最终纳入的150例HGMUE患者中,男性 105例(70.0%),女性45例(30.0%),平均年龄(49.5±10.3)岁。在150例对照组中,男性104例(69.3%),女性46例(30.7%),平均年龄(47.9±11.2)岁。
二、HGMUE危险因素的单因素分析
单因素分析发现,HGMUE患者饮酒史、合并Barrett食管或合并反流性食管炎的发生率显著高于对照组(P<0.05),而两组不同性别、年龄、BMI、吸烟史、是否服用PPI和阿司匹林、是否合并食管裂孔疝、Hp感染、消化性溃疡的发生率相比差异无统计学意义(P>0.05;表1)。
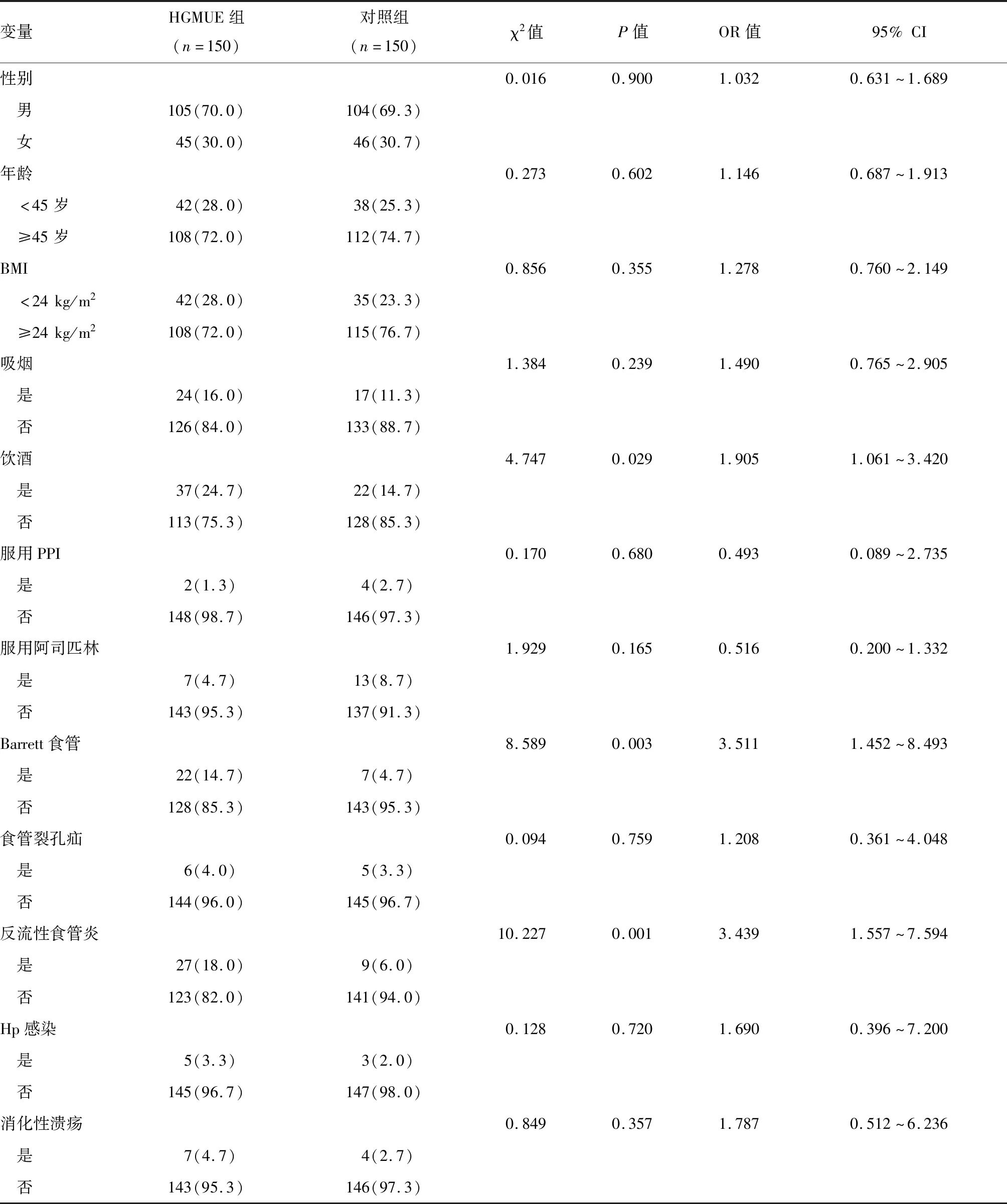
表1 HGMUE危险因素的单因素分析n(%)
三、HGMUE危险因素的多因素分析
多因素非条件Logistic回归分析结果显示,饮酒、合并Barrett食管或合并反流性食管炎是发生HGMUE的危险因素(P<0.05;表2)。

表2 HGMUE患者危险因素的多因素分析
讨 论
HGMUE多位于食管上括约肌附近,由于病变位置特殊,常被内镜医师所忽略。国外报道一般人群中HGMUE的发病率为0.18%~14%[9],而我国的检出率约为4.9%[10],可能与内镜医师缺乏对该病的重视有关。研究[11]表明,当内镜医师有意识地加强对颈段食管的探查,HGMUE的检出率可从0.29%增至2.27%。目前HGMUE的病因、发病机制尚未完全阐明,诊疗方法未统一。已有研究表明,异位胃黏膜可通过肠化生-异型增生-腺癌途径导致食管腺癌[12]。近年由HGMUE导致的临床症状和并发症逐渐受到关注,可引起食管和食管外症状以及食管腺癌等并发症,影响患者的生活质量和生命,因此需迫切明确HGMUE可能的危险因素,为其预防和控制给予指导建议。
目前,国内外已有较多关于HGMUE临床病理和内镜下特点的相关研究,但相关危险因素的研究较少。本研究对HGMUE的危险因素行单因素和多因素分析发现,饮酒、合并Barrett食管、合并反流性食管炎为HGMUE的独立危险因素,可明显提高HGMUE的风险。国外一项退役军人的研究[13]表明,HGMUE的发生与患者年龄、人种、家庭收入、BMI或腹围并无相关性,但HGMUE患者有更严重的吸烟史(P=0.006)。有研究提出男性和吸烟为HGMUE的危险因素[14]。本研究结果显示吸烟与HGMUE之间无明显相关性。另一项研究[5]发现HGMUE患者的平均终生饮酒量明显高于无胃黏膜异位患者(P=0.020),并指出HGMUE与Barrett食管以及胃溃疡之间存在显著关联,这两种病变可将HGMUE的发生风险增加3~4倍。
目前认为HGMUE与Barrett食管之间具有致病共性,两者均伴有柱状上皮。多数研究认为,胚胎发育阶段柱状上皮被复层鳞状上皮替换过程不完全,在食管上段的遗留部分发育成HGMUE,而食管下段的残余部分形成Barrett食管。随后有研究指出Barrett食管是由于长期酸反流导致食管下段原有鳞状上皮被更耐酸的柱状上皮所替代[15]。形态上,HGMUE与Barrett食管均为圆形玫红色斑块,与周围正常食管黏膜有明显的界限。此外,两者拥有相同的黏蛋白谱分布模式[16]。本研究结果显示HGMUE患者中合并Barrett食管的发生率明显高于对照者,但无法明确是由于共同发病机制导致两者共存还是由于酸反流在HGMUE的发病中亦起有一定作用。针对两种疾病的关联,有待后续研究深入探索。
对于HGMUE与酸反流的关系,目前仍存在争议。已有大量研究证实异位胃黏膜病灶含壁细胞,可分泌酸性分泌物。病灶分泌的酸性分泌物反流至咽喉部,咽喉部组织在长期慢性酸刺激下导致局部肠化生、萎缩、异型增生、腺癌等病理学改变,进一步促进HGMUE的发展。
本研究为回顾性病例对照研究,HGMUE与各危险因素之间的因果关系并不强烈。此外,本研究未对食管功能进行检测,无法证实动态pH值测量、阻抗监测等检查对本研究结果的影响。本研究亦未提及HGMUE的病理类型,不能判断临床症状是否会因病理类型和酸分泌量的不同而有所差异。已有研究证实内镜窄带成像(narrow-band imaging,NBI)技术有助于识别潜在的浅表性食管癌[17]。但本研究未采用NBI作为检查手段,有待后期进一步改善。
综上所述,饮酒、合并Barrett食管以及合并反流性食管炎为HGMUE的高危因素。合并此类情况的患者完善内镜检查时应提高对食管上段的关注度,尽量发现病灶,及早处理,避免发生并发症。

