局部巨块型宫颈癌患者手术治疗的疗效及预后分析
张妮娜,李 震,叶明侠,王 楠,孟元光
解放军总医院第一医学中心 妇产科,北京 100853
宫颈癌是世界范围内威胁女性健康的发病率最高的恶性肿瘤之一,其中发达国家发病率为(6.0 ~ 9.5)/100 000,发展中国家则高达 43.1/100 000[1]。我国2015年约有9.89万新发宫颈癌病例,并有3.05万妇女死于该病[2]。局部病灶直径≥4 cm者为局部巨块型宫颈癌(locally advanced bulky cervical cancer,LABCC),根据国际妇产科联合会(International Federation of Obstetrics and Gynecology,FIGO)2018宫颈癌分期系统,LABCC包括ⅠB3期(原ⅠB2期)与ⅡA2期宫颈癌,治疗方案有同步放化疗、根治性手术等方法[3]。随着新辅助化疗(neoadjuvant chemotherapy,NACT)逐步应用,LABCC患者的手术治疗成为研究热点[4]。本研究观察我中心LABCC患者手术治疗的疗效,并分析相关预后指标,为临床实践提供参考。
资料和方法
1 资料 选取我中心妇产科2013年1月- 2015年1月手术治疗的354例宫颈癌患者临床资料。两组一般资料见表1。纳入标准:1)由宫颈活检和锥切或宫颈环形电切术等手术病理诊断为宫颈癌;2)完整的病史记录、专科查体,血清学化验以及超声、盆腔CT/MRI、PET-CT/PET-MRI等检查结果评估病情;3)临床分期(本研究采用FIGO2009分期标准)为ⅠA2期~ⅡA2期;4)接受宫颈癌根治术(广泛子宫切除+盆腔淋巴结清扫术。排除标准:1)诊断为宫颈癌但未实施宫颈癌根治术;2)实施根治性同步放化疗;3)病例资料缺失。
2 治疗方法 采用新辅助化疗+宫颈癌根治手术或直接实施宫颈癌根治手术治疗。1)新辅助化疗方案 :顺铂 (60 ~ 70 mg/m2)+ 紫杉醇 (135 ~ 175 mg/m2),每3周一疗程,1 ~ 3个周期;每程化疗后评估肿块大小、化疗效果及手术机会。2)宫颈癌根治术:采用开腹/腹腔镜/机器人手术入路施术。手术要点:①常规开腹进腹腔(腹腔镜与机器人手术入路施术则常规建立气腹、穿刺置镜,安装机器人手臂),探查盆腹腔情况。②腹主动脉旁淋巴结清扫:打开后腹膜,暴露腹主动脉分叉,认清输尿管走行,依次切除腹主动脉旁左、右两侧淋巴结;盆腔淋巴结清扫:切除骶前淋巴结;分离右侧髂内动脉,切除闭孔淋巴结、宫旁淋巴结、腹股沟深淋巴结、髂外淋巴结、髂总淋巴结;同法切除对侧盆腔淋巴结。③广泛子宫切除:高位短扎骨盆漏斗韧带(保留卵巢者做双侧卵巢悬吊),游离髂内动脉,解剖子宫动脉并于髂内动脉分支水平断扎;将输尿管从腹膜游离,分离直肠侧窝和膀胱侧窝、下推膀胱至宫颈外口3 cm;打开输尿管隧道、外推输尿管,广泛切除宫旁组织(主韧带等侧方宫旁切除至髂血管内侧水平,骶韧带等背侧宫旁切除至近骶骨水平)。④距宫颈外口2 cm环形广泛切除阴道壁,取出病理标本,缝合阴道残端、冲洗止血(逐层关腹/缝合腹壁穿刺孔),术毕[5]。
3 分组及随访方法 将ⅠB2期(n=57)和ⅡA2期(n=34)病例(局部病灶≥4 cm者)纳入LABCC组,将ⅠA2期(n=12)、ⅠB1期(n=189)和ⅡA1期(n=62)病例(局部病灶<4 cm者)纳入对照组。
随访方法:采用住院、门诊、微信、短信、电话等方式进行随访,随访截止时间为2019年12月31日或者以患者死亡日期为准。以初诊时间点与末次随访时间/死亡日期间计算生存时间。失访者以末次随访时间为随访终点。随访指标:1)围术期指标:年龄、体质量指数(body mass index,BMI)、临床分期、腹部手术史、病理学类型、是否进行NACT治疗、手术用时、术中出血量、输血率、淋巴结切除数、术后住院时间。2)并发症发生情况:近期并发症,如输尿管膀胱泌尿系损伤、肠道损伤、肠梗阻、感染、下肢水肿和血栓;远期并发症,如淋巴囊肿、肾盂积水和输尿管扩张。3)生存分析指标:根据随访资料采用Kaplan-Meier乘积极限法比较LABCC组与对照组的术后生存分析函数。
4 统计学方法 使用SPSS23.0进行研究资料分析。观测资料中的计量数据,均通过正态性检验,以-x±s表示。两组间的比较为成组t检验或校正t检验。计数资料以例数及率描述。两组间比较采用χ2检验或校正χ2检验。此外,生存等时间队列资料建立Kaplan-Meier乘积限生存曲线模型,组间生存率比较为log-rank检验。统计推断的检验水准α=0.05。
结 果
1 两组围术期指标比较 LABCC组纳入91例,对照组纳入263例。LABCC组接受新辅助化疗比例高于对照组[69例(75.8%) vs 45例(17.1%),P<0.001]、术中出血量和输血率高于对照组[(598.1±135.3) ml vs (450.8±117.5) ml,P< 0.001;11例(12.1%) vs 14例(5.3%)。P=0.030]、术后住院时间长于对照组[(14.1±1.4) d vs(12.1±1.5) d,P<0.001]。两组年龄、平均BMI、腹部手术史、病理学类型、手术用时以及淋巴结切除数差异无统计学意义(P>0.05)。见表1。
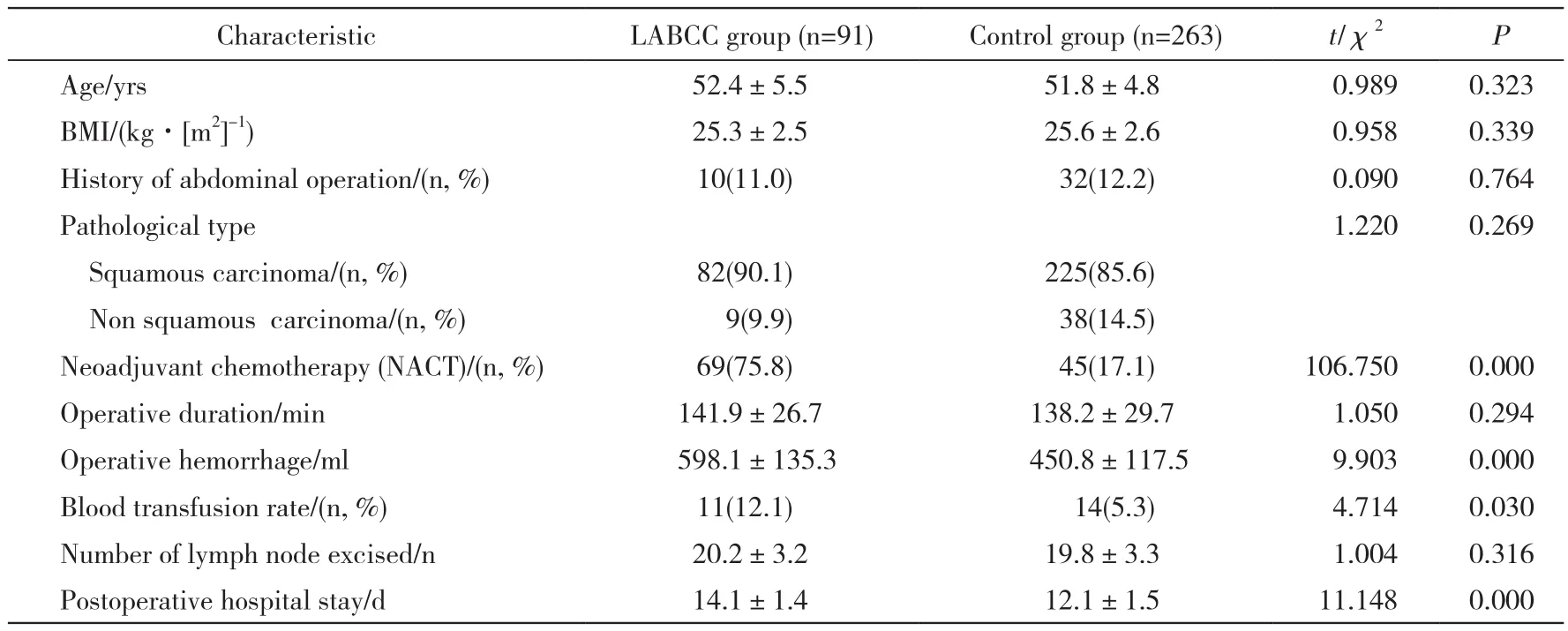
表1 两组一般资料及围术期观察指标比较Tab. 1 Comparison of general data and perioperative indexes between the two groups
2 两组随访情况比较 1)近期并发症:LABCC组泌尿系损伤发生率高于对照组[5例(5.5%)vs4例(1.5%),P=0.038],两组肠道损伤、肠梗阻、感染、下肢水肿和血栓发生率差异无统计学意义(P>0.05)。2)远期并发症:两组淋巴囊肿、肾盂积水和输尿管扩张发生率差异无统计学意义(P>0.05)。3)死亡率和复发率:随访5年,LABCC组死亡率高于对照组[9例(9.9%)vs11例(4.2%),P=0.042],两组复发率无统计学意义(P>0.05)。见表2。
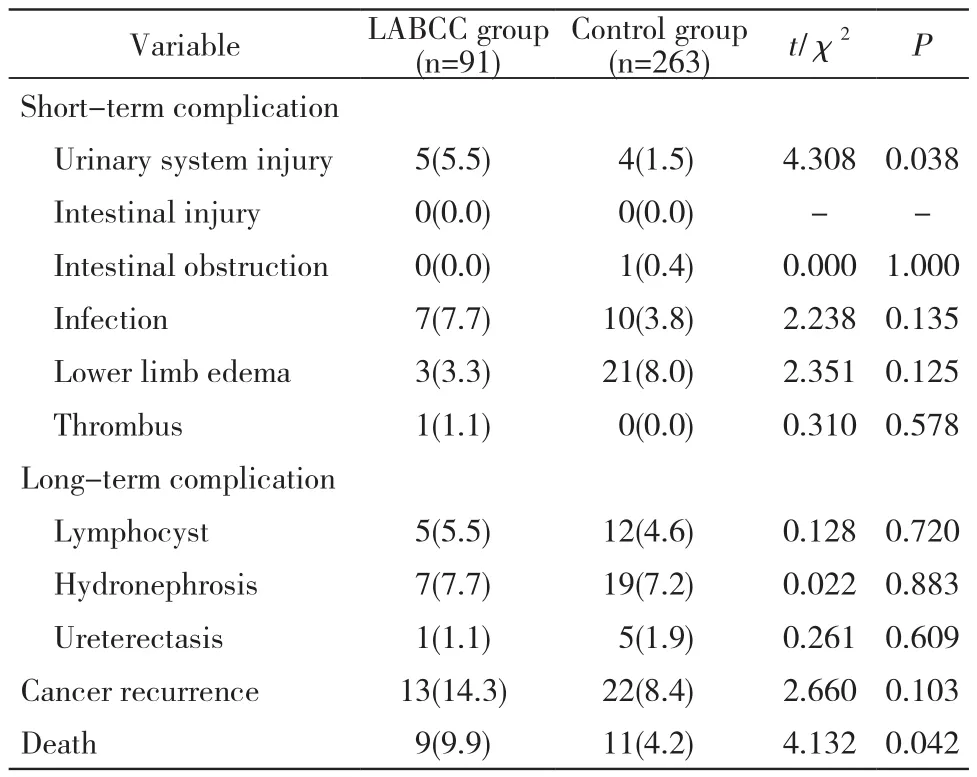
表2 两组并发症及复发、死亡率比较(n, %)Tab.2 Comparison of complications, recurrence and mortality between the two groups (n, %)
3 两组5年生存率比较 LABCC组5年生存率为64.8%(62/91),累积生存时间为(4.3±0.1)年,截尾数据为84例;对照组5年生存率为82.1%(216/263),累积生存时间为(4.6±0.1)年,截尾数据为216例。LABCC组生存率低于对照组(log-rank检验:χ2=11.892,P=0.001)。见图1。
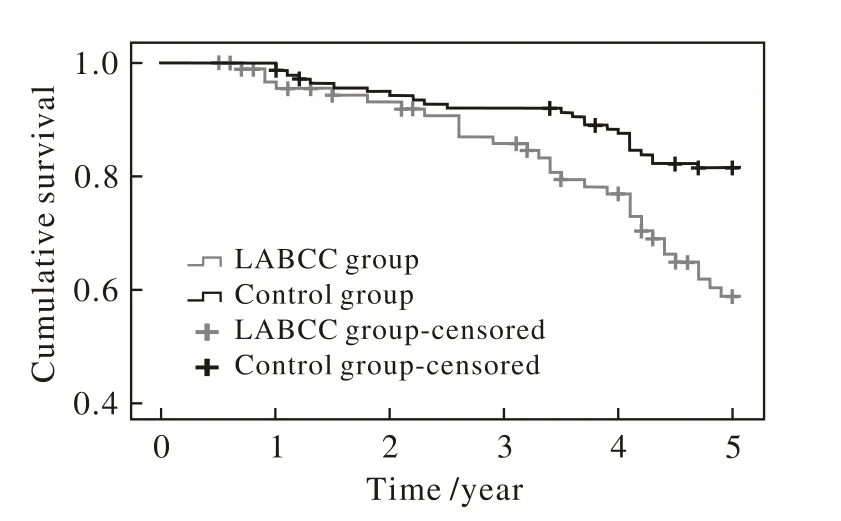
图1 两组宫颈癌患者术后生存分析曲线图Fig. 1 Postoperative survival analysis of cervical cancer patients in the two groups
讨 论
FIGO于2018年对宫颈癌分期系统做出修订,其中重要的变化是将局部病灶大小做了进一步的风险分层,如将原来的ⅠB1期细分为两层(病灶≤2 cm与<4 cm)等[6]。近年来,学界对宫颈癌T分期的认识逐步深入,如Wright等[7]的研究总结了美国国家癌症数据库(American National Cancer Database)2004 - 2015年62 212例宫颈癌病例资料,其中ⅠB3期患者的5年生存率为76.1%(95%CI:74.3% ~ 77.8%), 低 于 Ⅰ A2 期 [95.0%(95%CI:92.2% ~ 96.7%)]、 Ⅰ B1 期 [91.6%(95%CI:90.4% ~ 92.6%)]和 Ⅰ B2 期 [83.3%(95%CI:81.8% ~ 84.8%)];ⅡA2期患者的5年生存率为65.3%(61.6% ~ 68.6%),低于Ⅱ A1 期 [70.3%(95%CI:65.9% ~ 74.3%)]。可见肿瘤局部大小是患者预后的重要影响因素。目前观点认为,对于ⅠB3期(2009版FIGO分期的ⅠB2期)和ⅡA2期LABCC患者,同步放化疗与根治性手术均为有效的治疗手段。Gupta等[8]的Ⅲ期临床随机对照研究分析了635例LABCC患者(316例接受根治性手术vs317例接受同步放化疗),两组的5年生存率分别为75.4%和74.7%,无统计学差异(P=0.870),但根治性手术组的直肠、膀胱和阴道并发症发生率低于同步放化疗组[19.9% vs 36.9%(P=0.002),2.8% vs 7.3%(P=0.017),19.9% vs 36.9%(P< 0.001)]。另有研究认为LABCC患者接受根治性手术治疗较同步放化疗有更显著的生存获益[9-10]。
本研究结果显示,与对照组比较,LABCC组接受NACT治疗比例更高、术中出血量和输血率更高、术后住院时间更长、泌尿系损伤并发症发生率更高;手术用时、淋巴结切除数以及其他并发症发生率无统计学差异(P>0.05)。随访资料显示,LABCC组的5年累积生存率低于对照组(64.8% vs 82.1%,P<0.05),死亡率高于对照组(9.9% vs 4.2%,P<0.05),两组复发率差异无统计学意义(P>0.05)。针对LABCC患者的手术治疗,我们有以下体会:1)NACT+宫颈癌根治术目前已广泛应用于LABCC患者的临床治疗[11-13]。Zhao等[14]的研究总结了北京地区7个医学中心303例LABCC患者病例资料,接受NACT者中12.35%达到完全缓解(CR)、51.69%达到部分缓解(PR),且NACT组的术中出血量更少,更有利于实施手术治疗。2)笔者团队体会,LABCC患者宫旁血运更加丰富,术中在游离输尿管(打输尿管隧道)、下推膀胱以及切除主骶韧带过程中较其他临床早期病例更加困难,更易出血和发生泌尿系损伤;因此一方面应采用NACT缩小肿瘤体积与负荷后施术,另一方面术前可放置输尿管支架,术中和术后保护输尿管,以减少副损伤发生率[15]。3)一项纳入了17 173例宫颈癌患者生存分析结果显示,宫颈病灶直径≥4 cm是影响患者预后的独立危险因素(OR=2.62,95% CI:0.99 ~ 6.90)[16],这与本研究结论相符。值得注意的是,本研究中两组病例治疗后复发率无统计学差异,进一步说明了手术治疗对LABCC患者的有效性。
综上,新版NCCN指南同时推荐同步放化疗和手术治疗作为LABCC患者的一线治疗方案[17]。本研究结果显示,临床早期宫颈癌患者接受手术治疗能够彻底切除病灶,且通过预后分析显示疗效确切可靠。有研究指出LABCC患者的主要治疗挑战是局部肿瘤控制、降低治疗相关不良反应发生率以及防止肿瘤的蔓延和转移,同时主张利用手术、化疗、放疗以及靶向治疗等方法实施多学科的综合治疗[18-19]。因此如何更好地配伍各种治疗方式、合理进行诊疗决策、把握手术时机仍需在临床实践中不断总结和探索。

