红耳龟植物血凝素反应峰值与血液指标的关系及温度对其反应模式的影响
吴文欣,吴海燕,杨雨晴,冯文红,许洋溢,刁迎珠,汪寅,张志强
(安徽农业大学动物科技学院,合肥230036)
植物血凝素(phytohemagglutinin-P,PHA-P)是一种从红肾豆Phaseolus vulgaris中提取出来的有丝分裂原,外源注射该抗原后,被注射部位可产生肿胀反应,肿胀程度逐渐达到峰值,之后开始下降,最初用于反映家禽和鸟类细胞介导的免疫反应(Goto et al.,1978;Smits et al.,1999),因操作简便、重复性好,在小型哺乳动物和两栖动物研究中也有较多应用(Brock et al.,2014;张志强,2015;Zhang et al.,2017),但对爬行动物的研究很少(Zimmerman et al.,2010;Finger et al.,2013)。脊椎动物对PHA-P 的反应机制复杂多样,免疫系统的天然免疫、细胞介导的免疫和体液免疫等多个组分都可能参与该反应过程(Martin et al.,2006;Brock et al.,2014;Zamora-Camacho,2019),反应峰值可被前移或延迟,随季节(Merlo et al.,2014)、繁殖状态(张志强等,2015)和发育阶段(高慧清等,2017;张志强等,2020)等因素变化而变化。
红耳龟Trachemys scripta elegans是对我国生态系统有严重危害的一种入侵物种,22~32℃是最适宜其生存的温度范围(周婷,1997)。红耳龟稚龟对PHA-P的反应在注射后3 h和6 h都高于中华草龟 Chinemys reevesii(周赞等,2016),成体对PHA-P的反应峰值随季节而变化(Zimmerman et al.,2010),但关于PHA-P反应峰值与血液指标的关系以及温度对PHA-P反应模式的影响,尚无研究。本文在22℃条件下,筛选了适用于红耳龟研究使用的最适PHA-P溶液注射浓度,确定了反应峰值与血液指标的关系,并进一步比较了20℃、24℃、28℃和32℃处理6周后,红耳龟对PHA-P反应模式和峰值的影响,旨在为龟类免疫生态学研究提供基础资料。
1 材料与方法
1.1 实验材料
实验用红耳龟于2019年6月购自安徽省合肥市裕丰花市,共72只,体质量为101.3 g±2.7 g,不区分性别,塑料箱(长60 cm×宽36 cm×高36 cm)饲养,共8箱,每箱10只或8只(各4箱)。空调控制室温为24℃ ±1℃,加热棒控制箱体内水温为22℃ ±1℃,水深约10 cm,石块压箱,部分石块露于水面。以市售龟粮饲喂,每隔2 d换曝气24 h以上的自来水一次。室内暂养15 d后,测其体质量,分组备用。
1.2 PHA-P最适注射浓度的确定
选择每箱10只红耳龟3箱,任一箱中都以后足第二趾和第三趾交界处对应的足垫部位作为注射部位,一侧后足注射浓度为 1.0 g·L-1、2.5 g·L-1或 5.0 g·L-1的 PHA-P 溶液 100 μL,对侧后足注射等量灭菌后的0.7%生理盐水。水温控制为22℃ ±1℃,注射前后均用70%乙醇消毒足垫部位。为连续监测注射前后足垫厚度(瑞士Tesa数显卡尺,±0.01 mm)的变化情况,参照Finger等(2013)和Zhang等(2017)设定测量时间点:注射前(0 h)和注射后 6 h、12 h、24 h、48 h、72 h。每个测量时间点每只龟由同一人重复测定3次。用左、右足皮肤组织增厚的百分率来表示红耳龟对PHA-P的反应,即红耳龟对PHA-P的反应(%)=(注射PHA-P的一侧足垫部位的厚度-对侧注射等量生理盐水的足垫部位的厚度)×100/对侧注射等量生理盐水的足垫部位的厚度。以峰值明显且用量经济为标准,选取最适注射浓度(高慧清等,2017;彭兵龙等,2019)。
1.3 PHA-P反应峰值与各型白细胞百分比和血浆杀菌能力的关系
在最适PHA-P注射浓度条件下处理10只红耳龟,注射前(0 h)和对PHA-P的反应达峰值时,分别用一次性注射器(1 mL)从其背甲下静脉窦采血,每次每只龟采血约0.3 mL,取20 μL血液制作血涂片2张,剩余血液置于经肝素钠处理后的离心管内,离心后留测血浆杀菌能力。使用快速瑞氏吉姆萨染液(南京建成生物工程有限公司,产品编号:D010)处理血涂片,鉴别和计数血液中嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、单核细胞和淋巴细胞的百分比;参照对中华蟾蜍Bufo gargarizans(彭兵龙等,2019)和黑线仓鼠Cricetulus barabensis(Zhang&Zhao,2015)血清杀菌能力的测定方法测定红耳龟血浆杀菌能力。将大肠杆菌Escherichia coli干粉(广东省微生物菌种保藏中心,ATCC#8739)制成细菌液,激活后稀释成细菌工作液,通过预实验确定细菌的最适工作液浓度;同时,将10 μL 血浆样品加入200 μL 含有 2.34 mg L-谷氨酸盐的非 CO2依赖的培养基(Invitrogen,Gibco Media#18045)中混匀,添加最适细菌工作液20 μL后,再次混匀并37℃孵育30 min,之后每板50 μL样品涂胰蛋白酶大豆琼脂糖平板,每个样品2个重复。阴性对照组不添加血浆样品,孵育液全部为液体培养基,每一批次均设置3个阴性对照平板。平板倒置,37℃培养箱内,孵育至24 h时,取出计数。阴性对照组的菌落范围数为52~234个/平板。血浆杀菌能力(%)=(1-每个样品的菌落数/阴性对照组的平均菌落数)×100%。
1.4 温度对PHA-P反应模式和峰值的影响
将32只红耳龟分成4组,分别在20℃、24℃、28℃和32℃下饲养6周后,左后足足垫部位注射最适浓度的PHA-P溶液,右后足足垫部位注射等量的生理盐水溶液,测定注射前(0 h)和注射后6 h、12 h、24 h、48 h、72 h 的足垫部位厚度,并测定不同温度组实验开始和结束时的体质量。
1.5 数据统计与分析
用SPSS 19.0进行数据处理。用单因素方差分析(One-Way ANOVA)比较不同PHA-P注射浓度组、不同温度组体质量的组间差异,以及不同浓度、不同温度最大PHA-P反应的组间差异。以不同浓度的PHA-P溶液或不同温度作为组间因子,注射前(0 h)和注射后 6 h、12 h、24 h、48 h 和 72 h等时间点为组内因子,用重复测量方差分析(repeated measurement ANOVA)比较不同浓度组之间或不同温度下红耳龟对PHA-P反应的差异情况,以及同一浓度内或同一温度不同时间点之间的差异。用独立样本t检验比较注射前(0 h)和注射后到达反应峰值时各型白细胞的百分比和血浆杀菌能力的差异。文中数值均以E表示,P<0.05为差异有统计学意义。
2 结果
2.1 红耳龟的PHA-P最适注射浓度
1.0 g·L-1、2.5 g·L-1和5.0 g·L-1浓度组红耳龟注射前(0 h)的初始体质量分别为124.4 g±5.6 g、121.5 g±4.7 g和112.0 g±2.8 g,72 h后的终止体质量分别为122.4 g±5.5 g、119.6 g±5.3 g和110.4 g±2.9 g,组间及同一组内0 h和72 h之间的体质量差异均无统计学意义(P>0.05)。
重复测量方差分析结果表明,1.0 g·L-1、2.5 g·L-1和5.0 g·L-1浓度组对 PHA-P 的反应之间的差异无统计学意义(F2,27=0.173,P>0.05),但不同浓度组对PHA-P的反应随时间点变化明显(F5,135=27.990,P <0.05):1.0 g·L-1浓度组的反应值在24 h显著高于6 h和72 h(F5,45=6.298,P < 0.05),其他时间点的差异无统计学意义;2.5 g·L-1浓度组的反应值在48 h最高,24 h其次,都显著高于 0 h、6 h和 72 h(F5,45=12.759,P < 0.05);5.0 g·L-1浓度组的反应值在24 h最高,48 h其次,都显著高于0 h(F5,45=12.367,P < 0.05)。1.0 g · L-1、2.5 g·L-1和 5.0 g·L-1浓度组分别在注射后24 h、48 h和24 h达到反应峰值,增厚的百分比分别为6.83% ±1.53%、7.81% ±1.48%和8.63% ±0.62%,组间差异无统计学意义(F2,27=0.499,P>0.05)(表1)。依据反应明显且用量经济的原则,选取2.5 g·L-1为最适注射浓度。
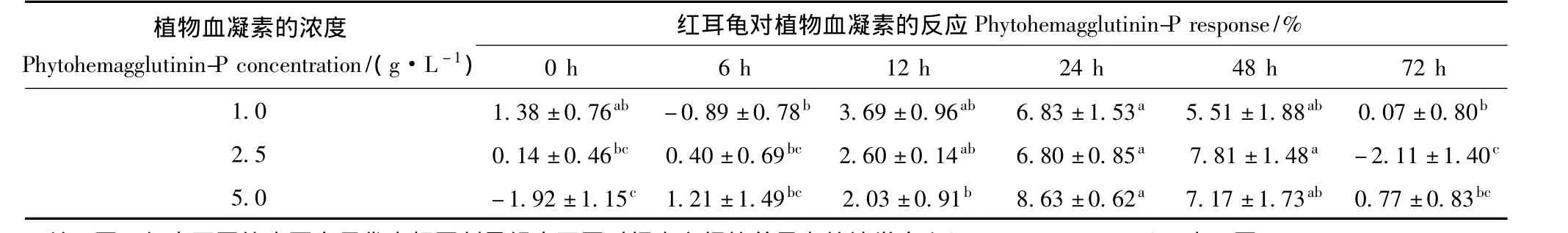
表1 不同注射浓度组红耳龟对植物血凝素的反应比较Table 1 Comparisons of phytohemagglutinin-P response among different injection dose groups
2.2 PHA-P反应峰值与各型白细胞百分比和血浆杀菌能力的关系
独立样本t检验分析结果表明,2.5 g·L-1浓度组红耳龟注射前(0 h)和48 h的体质量之间的差异无统计学意义(P>0.05),48 h时对PHA-P的反应值和淋巴细胞的百分比都显著高于0 h(P<0.05),但嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞和单核细胞的百分比,以及嗜中性粒细胞与淋巴细胞的比值和血浆杀菌能力在2个时间点之间的差异均无统计学意义(P>0.05)(表2)。
2.3 温度对PHA-P反应模式和峰值的影响
20℃、24℃、28℃和32℃组红耳龟的初始体质量分别为74.7 g±6.4 g、92.2 g±4.9 g、81.0 g±5.9 g和78.3 g±3.6 g,6周后的终止体质量分别为111.1 g±1.6 g、126.5 g±4.6 g、117.7 g±3.2 g和110.6 g±5.0 g,体质量分别增加55.0% ±11.3%、39.5% ±8.3%、50.7% ±11.5%和42.5% ±7.0%,组间差异均无统计学意义(P>0.05)。
20℃组对PHA-P的反应值在48 h最高,显著高于0 h 和6 h(F5,42=4.231,P <0.05),但与其他时间点的差异无统计学意义;24℃组对PHA-P的反应值在注射后24 h最高,48 h与24 h接近,都显著高于 0 h、6 h 和 72 h(F5,42=7.730,P <0.05);28℃组的反应值在注射后24 h最高,48 h与24 h接近,都显著高于 0 h(F5,42=5.406,P <0.05);32℃组的反应值在注射后24 h最高,48 h其次,24 h显著高于0 h 和6 h(F5,42=4.881,P <0.05)。20℃、24℃、28℃和32℃组对PHA-P的反应的最高值之间也无明显的组间差异(F3,28=0.840,P>0.05)(表3)。
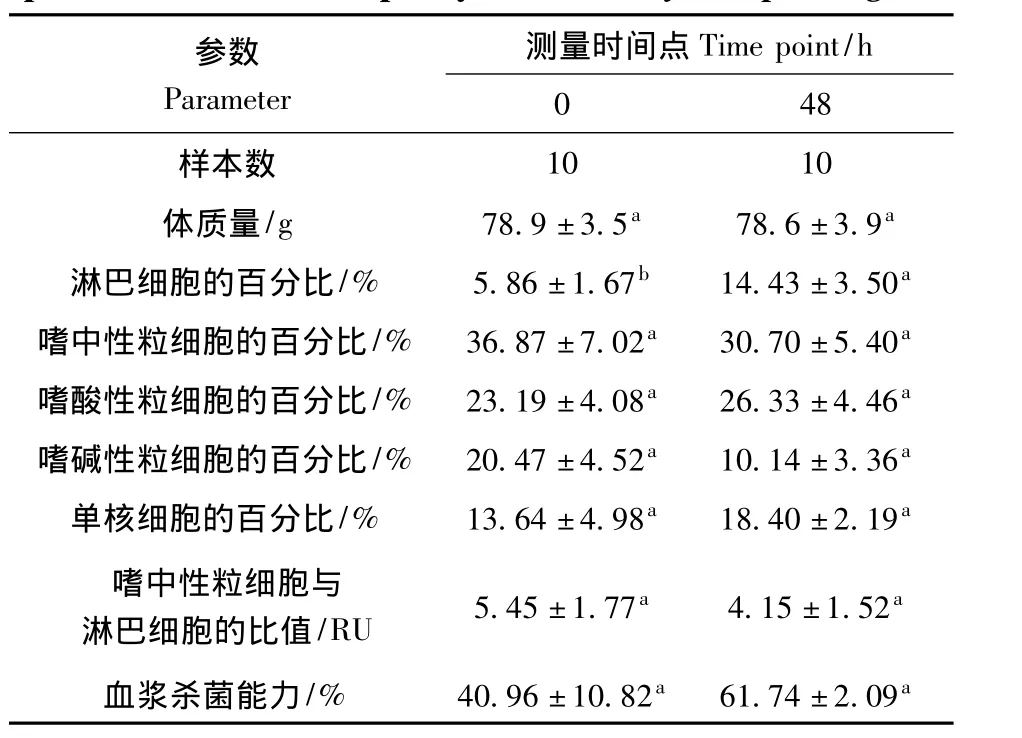
表2 红耳龟对植物血凝素的反应峰值与各型白细胞百分比和血浆杀菌能力的关系Table 2 The relationship between maximal phytohemagglutinin-P response,different subtypes of leukocyte,and plasma bactericidal capacity in Trachemys scripta elegans
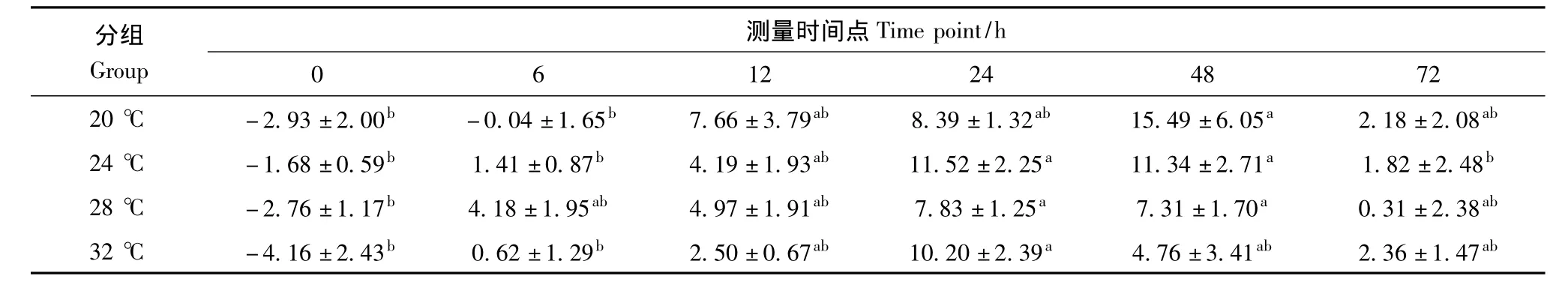
表3 不同温度组红耳龟对植物血凝素的反应比较Table 3 Comparisons of phytohemagglutinin-P response among different temperature groups
3 讨论
3.1 红耳龟对PHA-P的反应的最适浓度选择及反应机制
22℃下,亚成体红耳龟的体质量与中华蟾蜍相似(Zhang et al.,2017;彭兵龙等,2019),因此足垫部位选用了相同的100 μL的注射剂量,经分别为 1.0 g·L-1、2.5 g·L-1和 5.0 g·L-1PHA-P 溶液注射后,反应峰值分别出现于注射后24 h、48 h和24 h,但各浓度组的峰值无明显差异。从节省试剂和便于实践操作的角度考虑,红耳龟对PHA-P反应的最适注射浓度确定为2.5 g·L-1。除足垫外,趾蹼也被选择用于外源注射PHA-P溶液,如32℃下对3月龄湾鳄Crocodylus porosus的研究表明,趾蹼注射 PHA-P 溶液20 μL,注射后 12 h,1.0 g·L-1和2.0 g·L-1PHA-P溶液组达到峰值,注射后24 h,5.0 g·L-1PHA-P溶液组达到峰值,对幼鳄而言,2.0 g·L-1PHA-P溶液为最适注射浓度(Finger et al.,2013)。红耳龟和湾鳄都为爬行动物,但对PHA-P反应的最适浓度和剂量不同,这可能与湾鳄为幼鳄、体质量小,而红耳龟为亚成体、体质量较大有关。虽然PHA-P反应无明显的剂量依赖性,但通过被注射部位和体质量的大小来确定合适的注射剂量仍是可取的。
红耳龟在最适注射浓度条件下达反应峰值时,血液中只检出淋巴细胞的百分比显著升高,这与中华蟾蜍对PHA-P的反应相似,但后者血液中嗜酸性粒细胞的百分比也显著下降(彭兵龙等,2019)。目前,关于爬行动物对PHA-P反应的机制性基础研究,仅见于湾鳄,即在注射PHA-P后12 h,湾鳄趾蹼部位皮肤组织中除淋巴细胞的数量外,粒细胞和巨噬细胞的数量也都高于对照组(Finger et al.,2013)。淋巴细胞分为T细胞、B细胞和自然杀伤细胞:T细胞受抗原刺激激活后,参与细胞免疫,B细胞激活后与体液免疫有关(Davis et al.,2008)。红耳龟在注射PHA-P抗原后,肿胀程度主要与获得性免疫能力有关。
3.2 温度对红耳龟PHA-P反应模式的影响
经外源注射PHA-P抗原后引起的肿胀反应,虽然反应机制不同,可能并不完全等同于更强的免疫功能,但作为反映脊椎动物健康状态的一个近似指标,仍适用于同一物种不同环境条件下的比较研究(张志强,2015;Zamora-Camacho,2019)。季节性环境条件下,从4月底至9月初气温逐渐升高,但红耳龟对PHA-P的反应峰值却在5月底最高,9月初其次,说明红耳龟对PHA-P的反应不只受温度影响,也可能受病原体、食物可利用性等其他因素影响(Zimmerman et al.,2010)。本文选定的20℃、24℃、28℃和32℃与红耳龟22~32℃的适宜生存温度范围大体上相匹配(周婷,1997),20℃组红耳龟对 PHA-P的反应值在注射后48 h最高,24℃组、28℃组和32℃组在注射后24 h时最高,随温度升高,PHA-P反应的峰值前移,但无明显的组间差异;达反应峰值时,红耳龟血液中淋巴细胞的百分比增加明显,说明升温可提前激活细胞介导的免疫反应和/或体液免疫反应。温度对龟鳖类动物的天然免疫和获得性免疫影响不同。例如,28.8℃能显著提升红耳龟B细胞产生抗体的能力,但对其吞噬功能无明显影响(Palackdharry et al.,2017;Zimmerman et al.,2017);在恒定温度28℃和波动温度(28±2)℃条件下孵化的中华鳖Pelodiscus sinensis卵,波动温度孵化条件下的新生中华鳖幼体对细菌的抵抗能力更强,但对PHA-P的反应与恒定温度组的差异不显著(吴琼等,2017)。此外,脊椎动物对PHA-P的反应也受特定生活史阶段的影响。例如,花背蟾蜍Pseudepidalea raddei 42期蝌蚪对PHA-P的反应为反应迅速、持续时间短的单峰值,其他水生阶段反应峰值有后延现象,且在登陆后对PHA-P的反应峰值强度下降、持续时间延长,这可能与陆地多变的环境条件有关(高慧清等,2017);与非繁殖期、妊娠期和断乳期相比,黑线仓鼠哺乳期对PHA-P的反应峰值后延,这对其存活可能不利,但有助于繁殖进程的延续和后代的生长发育(张志强等,2015)。红耳龟亚成体对温度变化有较强的耐受性,16~36℃下单位体质量的静止代谢率随温度升高而增加(刘哲,2015),在适宜的温度范围内,红耳龟对PHA-P的反应峰值随温度升高前移,这有利于动员和激活细胞介导的免疫反应和体液免疫反应,提高红耳龟的适应能力,可能是全球气候变化背景下红耳龟易于扩散的生理基础之一。
本研究发现红耳龟对PHA-P反应的最适注射浓度为 2.5 g·L-1,剂量为 100 μL,对 PHA-P的反应峰值与淋巴细胞的百分比有关,反应峰值随温度升高而前移。然而,红耳龟对PHA-P的反应只能部分反映其免疫功能的变化情况。作为严重危害我国生态系统安全的生物入侵种,关于红耳龟扩散能力与天然免疫、获得性免疫等免疫系统不同组分之间的关系,仍有待于深入研究。

