RAP1A和EPAC1在卵巢子宫内膜异位症组织中的表达及意义*
沈利聪,板得莹,张瑜
(中南大学湘雅医院 妇科,湖南 长沙410008)
子宫内膜异位症是最常见的妇科慢性疾病之一,育龄期妇女发病率为10%~15%[1]。子宫内膜异位症主要引起疼痛、不孕和盆腔包块,70%~93%青少年期女性痛经因其引起,而15%~50%的女性不孕症是由其导致[2]。据中国妇科疾病负担调查显示,子宫内膜异位症的疾病负担为妇科疾病的第3 位[3]。子宫内膜异位症是良性疾病,却具有恶性肿瘤的一些特性,如侵袭性、复发性及远处转移,约有1%患者可能恶变,被称为“良性肿瘤”[4]。但目前子宫内膜异位症的发病机制尚不清楚。
多种假说如经血逆流种植学说、免疫学说、体腔上皮化生学说、干细胞学说、细胞增殖与凋亡失衡等从不同角度阐释可能引起子宫内膜异位症的病因及发病机制,然而,没有一种学说能完全解释其内在机制[1,5],表明子宫内膜异位症是一种多因素、多种机制参与导致的慢性疾病。RAS 相关蛋白1(Ras-associated protein 1, RAP1)是RAS 小G 蛋白家族中的一员,通过调节多种信号通路参与肿瘤的发生、发展。RAP1由2 种异构体组成,即RAP1A 和RAP1B。研究发现,RAP1A 在肝癌、胰腺癌、食管癌、宫颈癌、卵巢癌等多种肿瘤中高表达,通过参与细胞增殖、侵袭、迁移、凋亡失衡等多种生物学过程促进肿瘤的发生、发展[6-11]。环磷酸腺苷交换蛋白1(the exchange protein directly activated by cAMP1, EPAC1)是一种非蛋白激酶A 依赖的信号分子,是环磷酸腺苷cAMP 的下游效应分子。EPAC1 参与GDP/GTP 交换,将RAP1 结合的鸟苷二磷酸置换为鸟苷三磷酸,引起RAP1 激活。EPAC1/RAP1 通路参与细胞增殖、分化、黏附等多种生物学功能[12-14]。然而,RAP1A 和EPAC1 在子宫内膜异位症的作用尚无研究报道。
本研究通过免疫组织化学法及Western blotting 法检测RAP1A 和EPAC1 在卵巢子宫内膜异位症及正常子宫内膜的表达,并探讨两者的相关性。
1 资料与方法
1.1 研究对象
2019年6月—2020年1月中南大学湘雅医院妇科因卵巢子宫内膜异位症行腹腔镜手术患者18 例,年龄22 ~45 岁,平均(32.72±4.95)岁;取异位及在位内膜组织各18 份。取15 例卵巢单纯性囊肿或畸胎瘤(镜下未见卵巢及盆腔内膜异位病灶)患者的子宫正常内膜组织作为对照,年龄20 ~43 岁,平均(30.28±4.41)岁。所有组织经甲醛固定、脱水后石蜡包埋。所有研究对象均为月经周期规律的育龄期妇女,根据末次月经及病理检查证实所有内膜组织均为增生期,术前3 个月未接受任何激素治疗,术后病理检查证实为卵巢子宫内膜异位症或子宫正常内膜。根据r-AFS 分期标准,卵巢子宫内膜异位症患者均为Ⅲ、Ⅳ期。各组年龄比较差异无统计学意义(P>0.05)。本研究获得医院医学伦理委员会审查并批准执行(#201910255)。
1.2 试剂及仪器
兔抗人RAP1A 单克隆抗体(MA1-103)购自美国Invitrogen 公司,兔抗人EPAC1 单克隆抗体(ab109415)购自美国Abcam 公司,免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司,HRP 标记山羊抗兔IgG、RIPA 裂解液及BCA 蛋白定量试剂盒购自武汉赛维尔生物科技有限公司。电泳仪购自北京六一仪器厂,扫描仪购自爱普生(中国)有限公司,显微镜购自德国Leica 公司,转膜仪、图像分析仪购自美国Bio-Rad 公司。
1.3 免疫组织化学检测
石蜡包埋的组织标本进行4 μm 连续切片,将切片置于65℃恒温箱烤片30 min,接着予松节油脱蜡、梯度酒精水化。切片经柠檬酸盐缓冲液微波抗原修复15 min,3%过氧化氢室温孵育20 min 灭活内源性过氧化物酶,牛血清白蛋白封闭20 min,一抗孵育(RAP1A 按1 ∶200 稀释,EPAC1 按1 ∶100 稀释,阴性对照用PBS 代替一抗)4℃冰箱过夜,37℃复温45 min,清洗后加入二抗室温孵育1 h。最后,经DAB显色、苏木精复染、脱水、透明、封片后,倒置显微镜下观察并采集图片。
每张切片计数5 个高倍镜视野(×40),染色结果判读采用免疫反应评分(IRS),分别记录染色强度(SI)和阳性细胞百分比(PP)。阳性结果为细胞核、细胞质或细胞膜出现浅黄色至棕褐色颗粒,每次阅片时需保证白平衡、亮度等参数设置一致。根据阳性信号强弱将染色强度分为4 个等级:0 分为阴性,1 分为弱阳性,2 分为中度阳性,3 分为强阳性。根据阳性细胞所占百分比分为5 个等级:0 分,<5%;1 分,5% ~25%;2 分,>25% ~50%;3 分,>50%~75%;4 分,>75%。最后计算IRS 值,IRS=SI×PP,获得组织染色半定量评分。IRS 为0 ~12 分,IRS ≤3 分定义为低表达,IRS>3 分定义为高表达。
1.4 Western blotting 检测
组织剪碎后加入RIPA 裂解液,置于冰上裂解,离心后提取总蛋白;用BCA 蛋白定量试剂盒测蛋白浓度;将蛋白溶液按照4 ∶1 的比例加入5×蛋白上样缓冲液,沸水浴变性;取50 μg 总蛋白行SDSPAGE 电泳;恒压100 V 转膜1 h;5%脱脂牛奶封闭1 h;1 ∶1 000 稀释RAP1A 一抗,1 ∶1 000 稀释EPAC1 一抗,1 ∶1 000 稀释GAPDH 一抗,4℃孵育过夜;在室温下用TBST 洗膜3 次,加入1 ∶3 000稀释的二抗,于摇床上室温孵育1.5 h;用TBST 洗膜3 次,加入ECL 溶液进行显色反应,曝光,最后显影和定影。保存图片并用Alpha 软件处理系统分析目标蛋白条带的灰度值。
1.5 统计学方法
数据分析采用SPSS25.0 统计软件。计量资料以均数±标准差(±s)表示,比较采用方差分析,两两比较采用LSD-t检验;相关性分析用Pearson 法。P<0.05 为差异有统计学意义。
2 结果
2.1 各组内膜RAP1A 的表达
RAP1A 表达于细胞质,在异位内膜和在位内膜的表达明显高于正常内膜,在在位内膜腺上皮细胞呈强阳性表达(见图1)。免疫组织化学半定量评分显示,异位内膜、在位内膜及正常内膜的IRS 分别为(5.688±0.651)分、(8.700±1.144)分、(0.787±0.053)分,3 组比较,经方差分析,差异有统计学意义(F=45.005,P=0.009);异位内膜、在位内膜的IRS 水平均高于正常内膜(P<0.05);异位内膜与在位内膜比较,差异无统计学意义(P>0.05)(见图2)。
2.2 各组内膜EPAC1 的表达
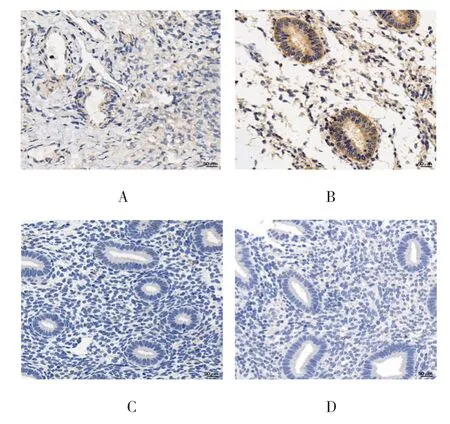
图1 RAP1A 在各组内膜的表达 (免疫组织化学×40)
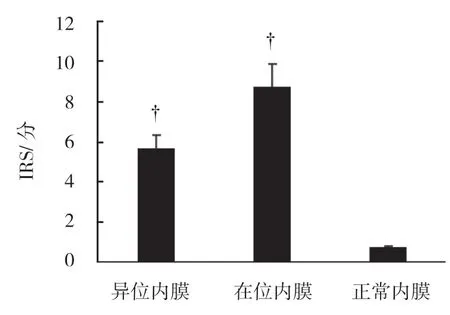
图2 RAP1A 在各组内膜的IRS 比较 (±s)
EPAC1 在腺上皮细胞的细胞质表达,在间质细胞的细胞质和细胞核都有表达;其在异位内膜和在位内膜的表达明显高于正常内膜,在腺上皮细胞的细胞质呈强阳性表达(见图3)。免疫组织化学半定量评分显示,异位内膜、在位内膜及正常内膜的IRS 分别为(8.100±1.153)分、(8.878±1.829)分、(2.520±0.138)分,3 组比较,经方差分析,差异有统计学意义(F=42.850,P=0.002);异位内膜、在位内膜均高于正常内膜(P<0.05);异位内膜与在位内膜比较,差异无统计学意义(P>0.05)(见图4)。
2.3 各组内膜RAP1A 蛋白相对表达量的比较
RAP1A 在异位内膜、在位内膜及正常内膜的蛋白相对表达量分别为(0.518±0.059)、(0.479±0.381)、(0.177±0.012),3 组比较,经方差分析,差异有统计学意义(F=6.664,P=0.006);异位内膜、在位内膜均高于正常内膜(P<0.05);异位内膜与在位内膜比较,差异无统计学意义(P>0.05)。见图5。
2.4 各组内膜EPAC1 蛋白相对表达量的比较
EPAC1 在异位内膜、在位内膜及正常内膜的蛋白相对表达量分别为(0.813±0.067)、(0.829±0.052)及(0.228±0.041),3 组比较,经方差分析,差异有统计学意义(F=24.069,P=0.005);异位内膜、在位内膜均高于正常内膜(P<0.05);异位内膜与在位内膜比较,差异无统计学意义(P>0.05)。见图5。
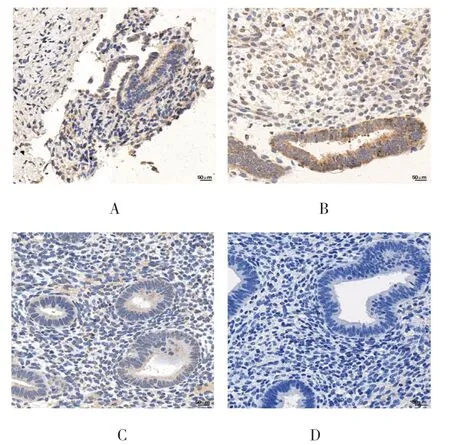
图3 EPAC1 在各组内膜的表达 (免疫组织化学×40)

图4 EPAC1 在各组内膜的IRS 比较 (±s)

图5 各组内膜中RAP1A 和EPAC1 的表达
2.5 RAP1A 和EPAC1 表达的相关性
采用Pearson 法对RAP1A 和EPAC1 在各组内膜的表达分别进行相关性分析,结果显示:RAP1A 和EPAC1 的表达在异位内膜(r=0.635,P=0.033)和在位内膜(r=0.697,P=0.005)及正常内膜(r=0.436,P=0.018)均呈正相关。
3 讨论
子宫内膜异位症是育龄期妇女的常见病,在育龄期长期处于活跃状态,由于发病机制尚不明确,目前临床尚缺乏针对性的、长期有效的生物治疗手段。寻找在子宫内膜异位症差异表达的分子,探索可能的治疗生物靶点,具有重要意义。本研究发现RAP1A 和EPAC1 在卵巢子宫内膜异位症的表达升高,表明其可能参与疾病的发病过程。
RAP1A 通过调控多种分子信号通路参与肿瘤的发生、发展。RAP1A 通过激活ERK/MAPK/Notch 信号通路调控上皮间质转化,从而促进卵巢癌生长和转移[11]。RAP1A 基因多态性导致肝移植后肝癌的复发风险升高[6]。LI 等[9]通过体内及体外实验发现,RAP1A 可通过激活Akt 信号通路促进上皮间质转化、刺激细胞迁移和侵袭,从而促进食管癌的转移。LIU等[15]发现RAP1A 在结直肠癌高表达,并揭示其通过激活PTEN/FOXO3/CCND1 通路促进结直肠癌的侵袭。刘立果[16]发现RAP1A 可通过PTEN/FOXO3/CCND1信号通路调控上皮间质转化,进而促进结直肠癌的发生、发展,并通过临床回顾分析发现RAP1A 可作为结直肠癌患者总体生存的独立预后因素。有研究进一步发现,在前列腺癌细胞敲除RAP1A 后,癌细胞的增殖、黏附和侵袭能力下降[17]。上述研究表明,RAP1A在细胞增殖、侵袭、黏附等多种生物学过程中发挥重要作用。本研究发现,RAP1A 在卵巢子宫内膜异位症异位内膜和在位内膜的表达高于正常内膜,提示RAP1A 可能在子宫内膜异位症的发生、发展中具有重要意义,可能参与子宫内膜异位症的细胞增殖、侵袭、黏附等过程。有趣的是,孙树凯等[18]发现脊髓神经损伤小鼠的RAP1A 表达升高,机械痛阈明显降低,而脊髓组织分离培养的星形胶质细胞的自噬标志分子表达及自噬水平均升高,表明RAP1A 高表达促进神经病理性疼痛的发展,该过程可能与RAP1A 对星形胶质细胞自噬水平的调节有关。因此,笔者推测,RAP1A 在子宫内膜异位症高表达,不仅参与疾病的发生过程,还可能通过自噬参与痛经的发生过程,后续进一步研究RAP1A 及自噬在子宫内膜异位症的作用将可能揭示发生痛经的新机制。
EPAC1 是细胞内一种非依赖PKA 的介导cAMP 效应的重要分子,在多种生物学功能中发挥核心作用[19-20]。EPAC1 可活化鸟苷三磷酸酶,促进RAP1A 结合鸟苷三磷酸变成活化形式。EPAC1基因缺失在体外抑制微血管形成,在病理性血管生成的进展中起关键作用。EPAC1-RAP1A-NHE3通路可能调节血管紧张素Ⅱ诱导的炎症细胞因子的表达,促进肾小管间质炎症发生[21]。在结直肠癌中,EPAC1 呈高表达,且对评估患者预后具有重要价值[22]。近年来,多个研究发现EPAC1 激活可能引起痛觉受体过敏,从而导致机体疼痛发生[23-24]。本研究发现,EPAC1 在卵巢子宫内膜异位症异位内膜和在位内膜的表达高于正常内膜,推测其可能通过促进腹腔子宫内膜异位症病灶新生微血管生成参与子宫内膜异位症的病理生理过程。本研究发现,EPAC1 与RAP1A 的表达呈正相关,推测两者可能相互协同,共同促进子宫内膜细胞增殖、侵袭和黏附过程。最近研究表明[25],炎症在子宫内膜异位症发病过程中可能发挥重要作用,EPAC1 高表达也可能通过促进炎症过程而参与子宫内膜异位症的发生及发展。子宫内膜异位症引起疼痛的确切机制尚不清楚,RAP1A 及EPAC1两者高表达,可能协同参与子宫内膜异位症发生的慢性疼痛。
在子宫内膜异位症的发病机制研究中,“经血逆流种植学说”是最早被广泛接受的学说,活性的子宫在位内膜通过输卵管逆流到腹腔,在腹腔环境下,需经过黏附、侵袭和血管形成才能在腹膜或卵巢等盆腹腔形成异位病灶。在该过程中,在位内膜的分子生物学特征起重要作用,决定了异位内膜的生物学行为,这就是郎景和院士提出的经典的“在位内膜决定论”[26]。本研究中,异位内膜及在位内膜RAP1A 和EPAC1 的表达差异无统计学意义,表明两者在异位内膜与在位内膜的表达均具有相似的特征,进一步证实在位内膜是子宫内膜异位症的根源,符合“在位内膜决定论”学说。由此可见,RAP1A 和EPAC1 可能成为子宫内膜异位症潜在的分子诊断和治疗靶点。
综上所述,本研究发现RAP1A 和EPAC1 在卵巢子宫内膜异位症异位内膜和在位内膜中高表达,且两者的表达呈正相关,推测RAP1A 和EPAC1 可能相互协同,参与疾病的发生、发展及痛经的调控过程。EPAC1 表达升高,可能加速置换鸟苷三磷酸,促进RAP1A 激活,进而增强在位内膜和异位内膜细胞的增殖、侵袭、黏附及新生微血管形成能力,还可能通过调节细胞自噬参与痛经的发生发展。本研究为进一步探索子宫内膜异位症的发病机制及探索可能的治疗新靶点提供了思路。

