高温对水稻根际细菌群落及功能代谢多样性的影响
邱虎森 ,甄 博 *,周新国
(1.中国农业科学院 农田灌溉研究所,河南 新乡453002; 2.中国农业科学院 商丘农田生态系统国家野外科学观测研究站,河南 商丘 476000)
0 引 言
【研究进展】目前,气候变暖已成为影响生态平衡和人类发展的全球性问题。随着气候变暖趋势的加剧,尤其是在作物生育期内,极端高温气候出现频率的增加,无疑成为影响作物生长和生产的致灾性因子[1-2]。每年的7 月中旬至8 月中旬为全国范围内的高温多发期,正值单季稻拔节期,这无疑会影响到水稻的光合作用及营养生长[3]。水稻在遭受高温胁迫时,会通过调节生理生化过程抵御和减轻高温伤害[4],其代谢过程的变化通过影响根系沉积物质形态及含量的改变进而影响到土壤微环境和微生物群落结构及功能[5]。
根际是受植物根系活动的影响,在物理、化学和生物学性质上不同于土体的微域土区,也是微生物聚集和生长的热区,是植物根系与土壤微生物之间相互作用所形成的独特圈带[6-8]。细菌作为土壤微生物中的主要类群,由于其在数量、种类和功能多样性上的优势,使其在土壤物质循环和能量流动中起着不可忽视的作用[9]。根际细菌通过根系与地上植物紧密联系,地上植物可以通过凋落物以及根系分泌物等形式影响土壤理化性质及微环境,进而影响细菌种群和功能。土壤细菌作为养分循环的驱动者,影响着土壤养分形态及含量,根际细菌及其种群结构可以通过调整功能代谢过程调整土壤养分形态,进而影响作物对土壤养分的吸收以及作物对外界环境胁迫的防御能力[10]。【切入点】因此,了解根际细菌代谢功能特性对环境胁迫的响应规律对于更好的理解土壤生态系统服务功能、生物地球化学循环具有重要作用。众所周知,土壤微生物通过编码相关酶的功能基因表达实现相关酶的合成及生理代谢功能,而这些编码序列作为土壤微生物功能标记物,成为深入了解微生物功能多样性信息与土壤物质循环之间关系的纽带[11]。随着高通量测序技术的发展,土壤微生物多样性及种群结构对环境的响应特征有了深入研究,但相应的细菌生理代谢功能基因表达对环境胁迫的响应还不清楚。
PICRUSt(Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)作为细菌功能和代谢的分析软件,结合高通量测序技术可以预测细菌代谢功能谱,有助于根际细菌群落组成和功能分析。
【拟解决的关键问题】本研究采用Miseq 测序技术,在对水稻根际细菌进行测序分析多样性和组成的同时,通过OTU 进行COG(Clusters of Orthologous Groups)功能注释分析高温胁迫对水稻根际土壤细菌组成及参与细菌生理代谢功能基因的影响。【本研究的重要意义】这为深入了解水稻根际细菌群落结构及功能基因组成对高温胁迫的响应和微生物养分代谢机制提供理论支撑,同时为在极端气候条件下如何改善田间管理模式,防止灾害的发生提供可靠的理论依据。
1 材料与方法
1.1 试验设计
水稻盆栽试验在河南商丘农田生态系统国家野外科学观测研究站(北纬34°35.22′,东经1115°34.52′)开展。供试土壤为砂壤质潮土。采用多点采样法采集耕层(0~20 cm)土样,样品去除动植物残体及碎石,风干后过2 mm 筛,然后充分混合,按照四分法取少量混合样品测定土壤基本理化指标,其中土壤有机碳量为12.90 g/kg,全氮量为0.78 g/kg,剩余土壤混合均匀用于盆栽试验。
选择健康且长势一致的水稻(获稻008)幼苗移栽到装有10 kg 风干土的塑料桶(高29.5 cm、桶口直径25 cm、桶底直径21.5 cm)。在水稻苗移栽定植后(每盆3 棵水稻苗),每桶施入相当于1.5 g 纯氮的尿素,相当于1 g 纯磷(P2O5)的过磷酸钙和相当于1 g纯钾(K2O)的氯化钾。在水稻对温度较敏感的拔节期进行为期7 d 的高温胁迫处理。试验设置对照Control(淹水5 cm)和高温T(淹水5 cm)2 个处理,其中,对照组在户外完成,高温胁迫处理在人工气候室内完成。人工气候室模拟温度设定具体为:00:00—05:00 为30 ℃,06:00 为31 ℃,07:00 为32 ℃,08:00 为33 ℃,09:00 为34 ℃,10:00 为35 ℃,11:00为37 ℃,12:00 为39 ℃,13:00 为41 ℃,14:00 为40 ℃,15:00为39 ℃,16:00为37 ℃,17:00为35 ℃,18:00 为34 ℃,19:00 为33 ℃,20:00 为32 ℃,21:00为31 ℃,22:00—24:00 为30 ℃。对照在户外完成
1.2 样品采集与测定
1.2.1 样品采集
在高温胁迫处理结束后,先将带土水稻植株从塑料桶中轻轻拔出,然后将与根系紧密结合的土壤取下为根际土。根际土混合均匀后,经过液氮速冻处理后,保存在-80 ℃冰箱,用于细菌群落多样性和代谢功能基因分析。
1.2.2 样品测定
采用Fast DNA®SPIN 试剂盒(Qbiogene Inc., USA)提取土壤总DNA,DNA 浓度和纯度利用NanoDrop2000 进行检测,利用1%琼脂糖凝胶电泳检测DNA 提取质量。在设计测序引物时,在序列中添加bar-code 序列以区分各个样品测序数据。用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和 806R(5′-GGACTACHVGGGTWTCTAAT-3′)[12]引 物 对V3-V4 可变区进行PCR 扩增,扩增程序为:95 ℃预变性3 min,27 个循环(95 ℃变性30 s,55 ℃退火30 s, 72 ℃延伸30 s),最后72 ℃延伸10 min(PCR仪:ABI GeneAmp® 9700 型)。扩增体系为20 ul,4 ul 5×FastPfu 缓冲液,2 ul 2.5 mM dNTPs,0.8 ul 引物(5 uM),0.4 ul FastPfu 聚合酶;10 ng DNA 模板。使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences, Union City, CA, USA)进行纯化,Tris-HCl 洗脱,2%琼脂糖电泳检测。利用QuantiFluor™-ST(Promega, USA)进行检测定量。根据定量结果和测序量要求,取PCR 产物构建测序文库。构建好的文库在Illumina Miseq PE300 测序平台测序。
1.3 数据处理与分析
原始测序序列使用Trimmomatic 软件质控,使用FLASH 软件进行拼接,使用UCHIME 软件剔除嵌合体,使用的 UPARSE 软件(version 7.1 http://drive5.com/uparse/),根据97%的相似度对序列 进 行 OTU 聚 类。 利 用 RDP classifier (http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva 数据库(SSU123),设置比对阈值为70%。
数据统计在Excel 2007 中完成,α-多样性的计算在QIME1.80 中完成;细菌群落功能基因预测基于PICRUSt 分析实现[13],通过PICRUSt(PICRUSt 软件存储了greengene ID 对应的COG 信息)对OTU 丰度表进行标准化,并去除16S marker gene 在物种基因组中的copy 数目的影响;然后通过每个OTU 对应的greengene ID,获得OTU 对应的COG 家族信息;并计算各功能基因对应的各COG,根据COG 数据库的信息,从eggNOG数据库中解析各COG的描述信息,以及其功能信息,并能根据OTU 丰度计算各功能类别的丰度。
该分析可在http://huttenhower.sph.harvard.edu/galaxy/中在线实现。基于R3.4.3 的vegan 包,采用非参数多元统计比对组间细菌群落结构差异;基于SPSS16.0配对T 检验研究组间微生物α 多样性的差异;基于STAMP 的Welch's t-test 检验对比组间功能丰度差异。
2 结果与分析
2.1 根际细菌多样性及群落结构的差异
基于Miseq 测序结果,对水稻根际细菌在分类水平上进行比对分析,共发现40 门、100 纲、194 目、366 科、626 属。其中门水平上变形菌门、酸杆菌门、放线菌门、绿弯菌门、芽单胞菌门、硝化螺旋菌门、厚壁菌门和拟杆菌门,占总细菌丰度的93%以上,而其余32 个门仅占7%左右(图1)。配对T 检验结果发现,高温胁迫未改变水稻根际细菌群落的覆盖度、丰富度和均匀度,但显著提高了细菌群落Shannon 指数(表1,p<0.05)。与对照相比,虽然高温处理未改变水稻根际细菌群落结构(表2),但LEfSe(LDA阈值为2)差异分析发现处理间仍有种群富集的差异,其中相对丰度较高的放线菌门、厚壁菌门和栖热菌门在对照组中显著富集,而芽孢单菌门、浮霉菌门、Latescibacteria、螺旋菌门、Microgenomates 和Candidatus_Berkelbacteria 等5 个门类主要在高温胁迫处理中富集(图1)。与对照相比,高温胁迫提高了在属(417∶444)水平上根际细菌网络中的连接数,其中正相关连接数为(对照∶高温胁迫=243∶273),负相关连接数为(对照∶高温胁迫=174∶171)(图2)。
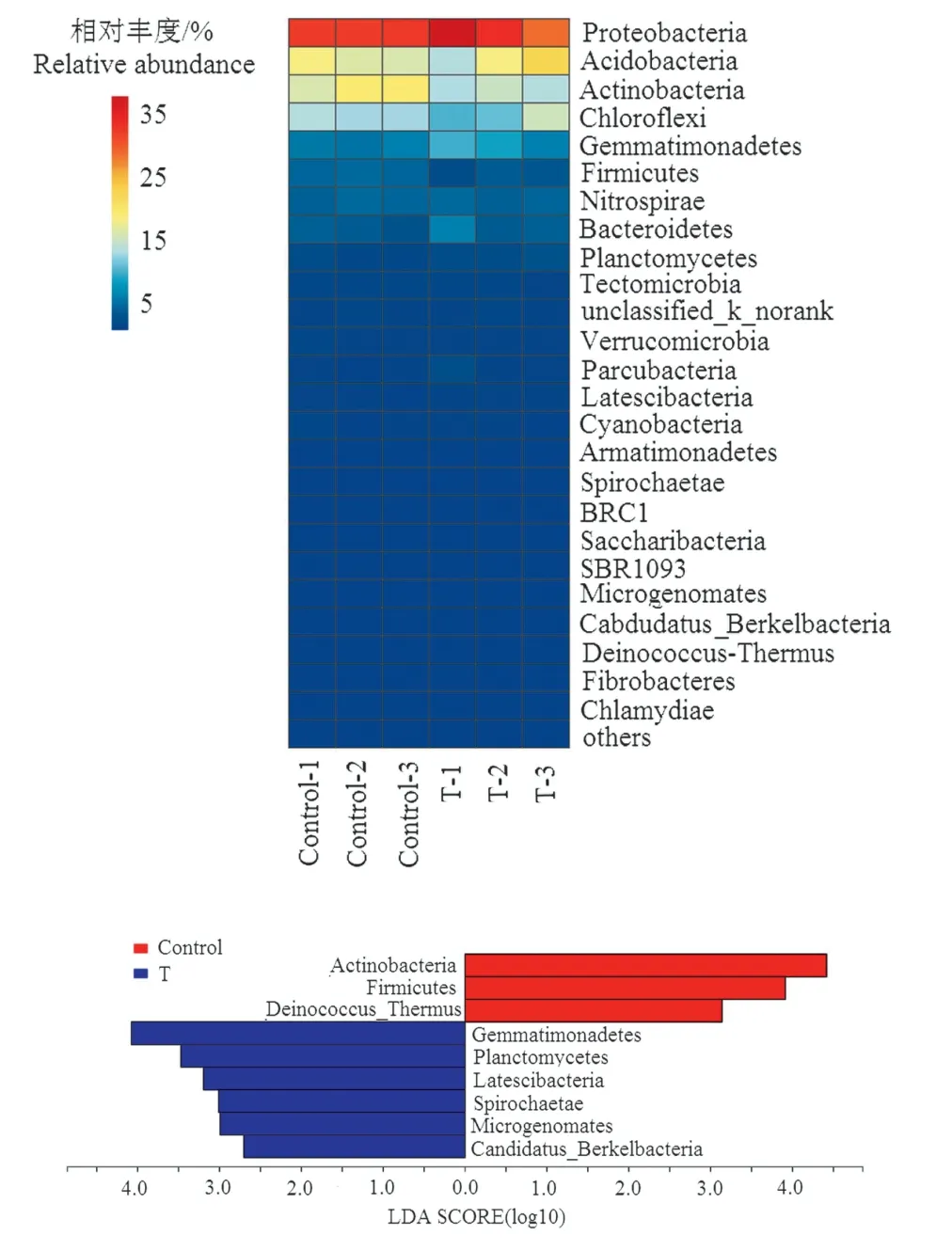
图1 基于门水平的细菌微生物群落结构差异 Fig.1 Difference of bacterial community structure between treatments based on phylum

表1 基于OTU 水平的细菌α 多样性 Table 1 Bacterialα-diversity based on OTU
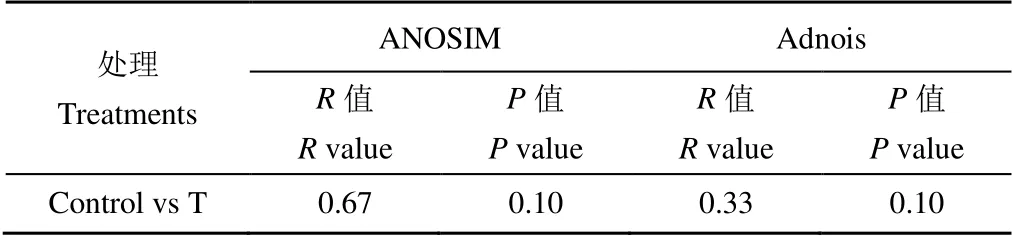
表2 处理间细菌群落结构差异 Table 2 Difference of bacterial community structure between treatments
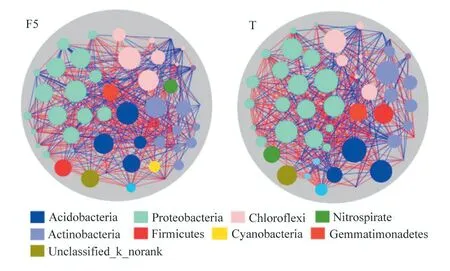
图2 基于属水平的物种相关性网络分析 Fig.2 Network analysis on genus level
2.2 水稻根际细菌COG 功能分类及差异
通过COG 数据库比对,所有基因的功能可归为24 个功能亚类。其中与新陈代谢相关的基因相对丰度占40%~41%,其中以能量代谢、氨基酸代谢和碳水化合物代谢为主,说明高温胁迫并未改变细菌以能量获取为核心的代谢活动。与细胞加工和信号传递相关的基因相对丰度占24%~25%,与信息储存和加工以及功能预测和功能未知相关的基因相对丰度各占约17%,而与细胞外结构、细胞骨架和染色质结构及动力相关的基因相对丰度小于1%。Welch'st 检验的结果发现高温胁迫显著提高了与细胞加工和信号传递基因相对丰度,但同时显著降低参与新陈代谢和信息储存和加工基因的相对丰度(图3,p<0.05)。
基于24 个功能亚类,比较组间丰度差异发现高温胁迫主要提高了参与细胞加工和信号传递基因相对丰度,主要包括细胞运动、信号传导机制、胞内运转、分泌和囊泡运输和细胞壁/膜/器形成基因的相对丰度。但高温胁迫显著降低了参与新陈代谢的某些功能基因相对丰度,如氨基酸运输和代谢、脂质转运和代谢、次生代谢生物合成;同时,高温胁迫降低了参与翻译的相关基因的丰度(图4,p<0.05)。
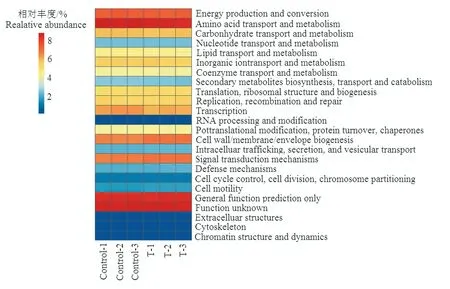
图3 基于COG 数据库的水稻根际土壤细菌功能基因热图 Fig.3 Heatmap of bacterial COG function classification in rice rhizosphere
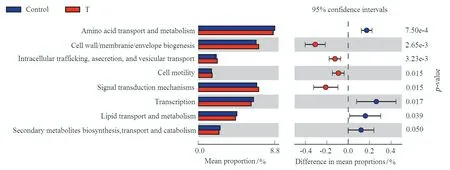
图4 基于COG 功能分类的水稻根际土壤细菌功能基因相对丰度差异 Fig.4 Difference of the relative abundance of bacterial functinonal genes in rice rhizosphere based on COG function classification
3 讨 论
3.1 高温胁迫对根际细菌多样性及种群结构的影响
研究发现,高温处理可以提高根际土壤细菌Shannon 多样性,说明高温条件下根际土壤有更多可被微生物利用的养分和有机物质。在外界环境水分充足的条件下,高温可以提高水稻气孔导度,促进光合作用[14-15]。植物根系可以将输入到根部的光合碳释放到土壤中为根际周围微生物生长和活性的提高提供更多的碳源[16-17]。这些改变都可能会影响水稻根际周围环境,提高根际土壤的异质性,从而导致根际细菌多样性的提高。
与对照相比,高温处理并未改变水稻根际细菌群落结构,说明水稻可通过生理调节过程维持了土壤大环境的稳定,并未造成根际细菌群落结构的改变。影响土壤微生物种群结构的因素主要是土壤环境的改变引起的,研究发现温度和水分是影响土壤微生物活性、数量及种群结构的2 个关键因子[18]。高温胁迫可以直接影响细菌群落组成[19-20],但这种影响受土壤水分的调节,对于淹水稻田土壤,充足的水分可能会削弱甚至抵消高温胁迫对土壤细菌群落结构的影响。另一方面,水稻会通过一系列生理过程的调节来适应高温胁迫,在这一过程中可能会导致根际泌氧、根系分泌物形态和含量的变化等,这些都可能会抵消高温胁迫对细菌菌群的影响[21],从而有利于水稻根际细菌群落结构的稳定。水稻根系分泌物对根际细菌群落结构的选择性塑造可能会在不影响群落结构稳定性的情况下促使某些物种门类的富集。也有可能,在高温胁迫时,水稻通过主动增加气孔导度,提高蒸腾速率等方式来降低叶片温度,以减少伤害,并未对根际微环境和细菌菌群产生影响[21-22]。
基于物种网络相关性分析的结果,与对照相比,高温胁迫提高了在属水平上根际细菌网络中总连接数和正相关连接数所占比例,说明根际土壤中微生物之间的竞争关系减弱,共生关系增强。究其原因,可能由于高温促进了水稻光合作用及根际沉积碳的形成,为微生物生长提供了充足的碳源,降低物种之间因为能量匮缺引起的竞争关系[23-24]。放线菌门和厚壁菌门作为参与土壤稳定性有机碳分解的关键门类[25],在对照组中的富集在一定程度上说明土壤可利用碳源的不足使对照组中微生物之间的竞争关系强于高温胁迫处理。另外,高温引起的植物根系生理代谢使根际微环境更适合微生物的生存,从而有利于微生物共生关系的发生。
3.2 高温胁迫对细菌代谢功能基因的影响
有研究认为土壤微生物群落结构的改变可能会影响微生物功能组成[26-27],而本研究发现即使细菌群落结构稳定,细菌的功能基因组成也会存在差异。从本研究的细菌组成来看,70%以上的细菌活性基因主要源于变形菌门、酸杆菌门、放线菌门和绿弯菌门等优势门类。
土壤微生物基因表达特征及功能代谢过程的改变反映了微生物对环境的适应性和应激性[28]。高温胁迫可以直接或者间接通过影响作物生长改变根际土壤微环境,诸如根际土壤pH 值、含氧气量、养分形态等,进而影响根际细菌的生长和功能组成。本研究发现,高温胁迫条件下,细菌细胞壁/膜/器形成等与细胞过程相关基因的相对丰度的提高代表着土壤可利用碳源和营养物质的提高[29]。与此同时,高温胁迫主要提高了参与细胞运动、信号传导机制、胞内运转、分泌和囊泡运输说明高温胁迫改变了细菌细胞的生长和死亡周期,而这一过程可能有助于提高根际细菌对因高温引起的根际微环境变化的适应能力[30]。相反,高温胁迫降低了氨基酸运输和代谢、脂质转运和代谢、次生代谢生物合成以及参与翻译的相关基因的丰度(p<0.05)。说明高温胁迫对细菌次生代谢物的形成和蛋白质的生物合成过程具有一定的抑制作用,究其原因可能是受由于高温胁迫导致的水稻根系分泌物多样性以及分泌物形态的限制。有研究认为,土壤可利用碳源、氮源等养分的高低与细菌多样性呈正比[23],本研究中高温胁迫可能促进了根际土壤微生物对养分的周转代谢过程,同时有助于增强根际土壤微生态的稳定性。
4 结 论
1)高温胁迫提高了水稻根际细菌多样性,促进了丰度相对较低的细菌门类的富集,加强了细菌菌群之间共生关系。
2)高温胁迫并未改变细菌以能量获取为核心的代谢活动,却促进了细胞的更新速度,降低了参与蛋白代谢的基因表达。

