气质联用法测定纸和纸制品中百菌清残留量
王成云 ,沈雅蕾 ,林君峰 ,谢堂堂 ,张嘉丽
(1.深圳市检验检疫科学研究院,广东 深圳 518010;2.深圳海关工业品检测技术中心,广东 深圳 518067;3.深圳职业技术学院应用化学与生物技术系,广东 深圳 518055)
采用在纸和纸制品中添加抗菌剂的方法可以有效地提高纸和纸制品的抗菌性能[1-2],通常情况下,可以使用内部施胶、表面施胶、喷洒抗菌剂、表面涂布和使用抗菌纤维技术等5种方式来生产抗菌纸。内部施胶时,将抗菌剂直接加入到纸浆中;表面施胶时,将抗菌剂和表面施胶剂混合后对纸和纸制品进行表面施胶;表面涂布时,将抗菌剂和涂布材料混合后,涂布在纸和纸制品上;喷洒抗菌剂时,将抗菌剂以喷洒的方式均匀地喷洒到纸和纸制品上;使用抗菌纤维技术时,首先对化学纤维进行抗菌改性,制成抗菌纤维,再将抗菌纤维按特定的比例和纸张纤维进行配抄来生产抗菌纸。真菌细胞中含有三磷酸甘油醛脱氢酶,百菌清与该酶中含有半胱氨酸的蛋白质结合后使酶失去活性,破坏真菌细胞的新陈代谢,导致其失去生命力[3]。百菌清可以有效地灭杀子囊菌纲、担子菌纲、半知菌纲等真菌,大量用于纸和纸制品的抗菌防霉处理[4]。但是已有研究成果表明百菌清对人和动物有危害,尤其对鱼类和水生无脊椎动物的毒性极大[5];啮齿动物暴露在百菌清中后则会导致肾脏和胃部损害以及肿瘤的产生;作为一种强致敏物,百菌清能引起人体迟发型变态反应性皮炎[6]。百菌清具有远距离迁移性,而且毒性还能在生物体内明显蓄积[7]。因此,百菌清被世界卫生组织国际癌症研究机构列为2B类致癌物,欧盟委员会发布法规EU 2019/677,禁止使用百菌清[8]。百菌清曾广泛使用于纺织、木材防腐、皮革、水果、食品和涂料等行业,其检测方法主要有紫外分光光度法、液相色谱法、气相色谱法、气质联用法等几种[9-24],但测定纸和纸制品中百菌清的含量的检测尚未见文献报道。本文采用超声萃取技术提取纸和纸制品中残留的百菌清,提取物浓缩定容后进行气相色谱/质谱-选择离子监测法(GC/MS-SIM)分析,外标法定量,从而建立了一种快速测定纸和纸制品中百菌清残留量的气质联用方法。
1 实验部分
百菌清标准品(纯度99.9%)由德国Dr.Ehrenstorfer GmbH公司提供,用色谱纯甲醇(美国Tedia公司)配制成质量浓度为428 g/mL的标准贮备液,并稀释至质量浓度分别为 0.1、0.2、0.5、1.1、2.1、5.4、10.7、21.4和 42.8 g/mL。
采用浆内施胶工艺制备自制阳性样品,分别以不含百菌清的瓦楞纸、白卡纸、铜版纸、新闻纸和涂布白卡纸为基材,将其用ZB-JLQ纤维标准解离器(杭州纸邦自动化技术有限公司)疏解成纸浆,在纸浆中添加适量的百菌清,用IMT-TAPP102简易方形抄片机(东莞市英特耐森精密仪器有限公司)进行抄纸,得到5个不同百菌清含量水平的自制阳性样品,供超声萃取条件优化实验用。
将待测样品用QYB-3自动制样机(中山市启元机械科技有限公司)裁成5 mm×5 mm的小块,称取1 g样品,置于35 mL玻璃反应瓶中,加入25 mL萃取溶剂,温度40℃下超声萃取30 min。将萃取液过滤至鸡心瓶中,在Cool acecca-1100旋转蒸发仪(日本Eyela公司)中真空蒸发至近干,转移至N-Evap112氮吹仪(美国Organomation Associates公司)中,用干燥氮气缓慢吹干。残留物用1 mL甲醇溶解,所得溶液经0.45 μm尼龙有机相针式滤器(上海安谱实验科技股份有限公司)过滤后进行GC/MS-SIM分析,必要时,先进行适当稀释。
样品分析在Agilent 6890A-7000B三重四极杆气质联用仪(美国Agilent公司)上进行,所用色谱柱为 DB-5MS 色谱柱(30 m×0.25 mm×0.25 μm),载气为高纯氦气(纯度>99.999%),载气流速为1 mL/min,溶剂延迟3 min;程序升温,初始温度为90℃,保持1 min后以40℃/min速度升至290℃,保持2 min;进样量为1.0 μL,进样方式为不分流进样;进样口、传输线、离子源温度分别为270、280和290℃;电离方式为电子轰击电离(EI),电离能为70 eV;全扫描方式定性,扫描范围为m/z 45~m/z 550,定性离子为m/z 109、m/z 264和m/z 268;选择离子监测模式定量,定量离子为m/z 266。
2 结果与讨论
2.1 超声萃取条件的优化
超声萃取效率取决于萃取溶剂种类、萃取温度、萃取时间和萃取溶剂体积。以甲醇为萃取溶剂对5个自制阳性样品中的百菌清进行超声萃取,测定每个样品中百菌清的萃取量。首先单独考虑萃取温度(因素A)、萃取时间(因素B)、萃取溶剂体积(因素C)中某个因素对萃取量的影响。结果发现,当萃取时间为30 min时,3号、4号样品萃取量均达到最大值,1号、2号和5号样品在萃取时间为35 min时萃取量均达到最大值;当萃取温度为35℃时,2号样品萃取量达到最大值,当萃取温度为40℃时,1号、4号和5号样品萃取量均达到最大值,当萃取温度为45℃时,3号样品萃取量达到最大值;当萃取溶剂体积为25 mL时,1号和2号样品萃取量均达到最大值,当萃取溶剂体积为30 mL时,3号、4号和5号样品萃取量均达到最大值。为考察3个因素对萃取量的综合影响,设计了表1所示的正交实验条件,在9个条件下 以甲醇为萃取溶剂对5个自制阳性样品进行超声萃取,测定百菌清的萃取量,结果见表1。根据表1中的数据计算3个因素的k值和极差,确定优方案,结果见表2。5号样品优方案为A2B2C3,其余4个样品优方案均为A2B2C2。综合考虑,最终确定的优方案为A2B2C2,即萃取温度为40℃、萃取时间为30 min、萃取溶剂体积为25 mL。
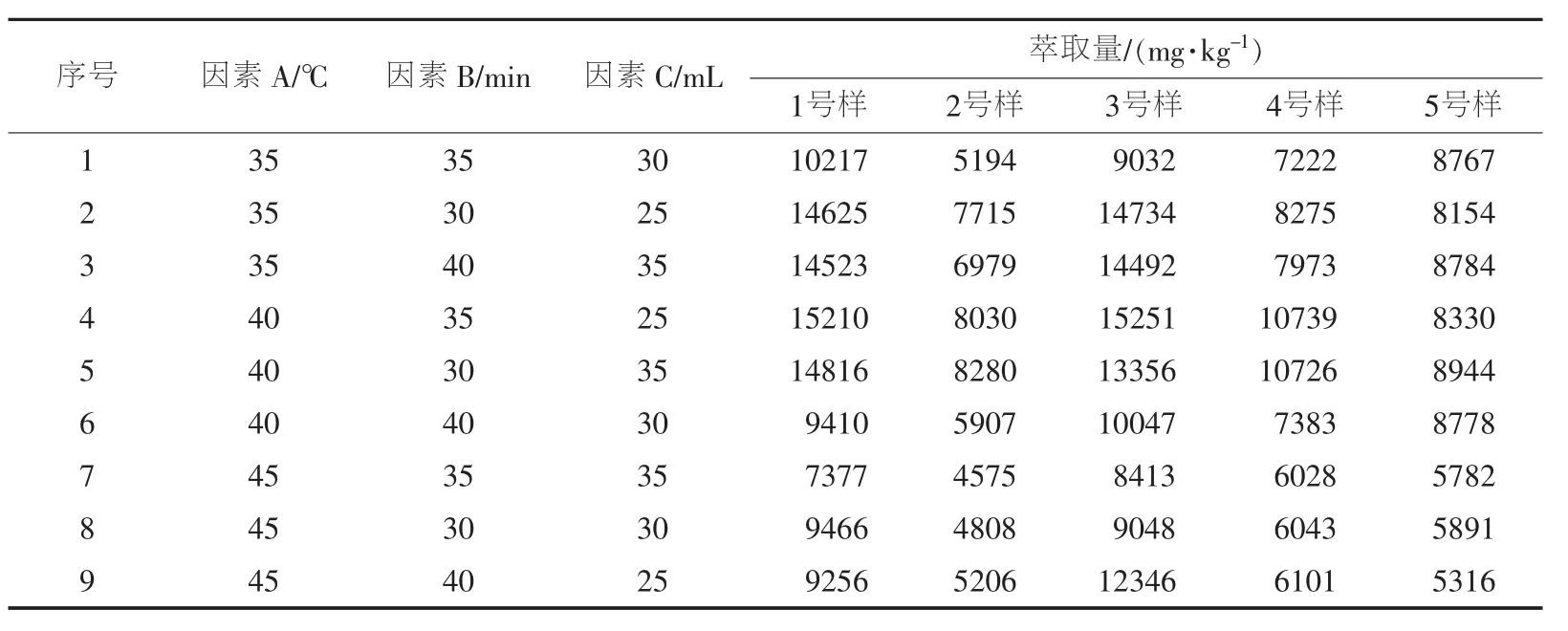
表1 超声萃取正交实验

表2 超声萃取正交实验数据分析 单位:mg/kg
在上述优方案给出的超声萃取条件下,分别以甲醇、乙酸乙酯、乙酸乙酯/二氯甲烷(1∶1,V/V)、二氯甲烷、叔丁基甲醚、丙酮、乙醚、正己烷/丙酮(1∶1,V/V)、正己烷、乙醇、石油醚和乙腈等 12 种常见溶剂为萃取溶剂,对5个自制阳性样品进行超声萃取,测定百菌清的萃取量,结果见表3。2号、4号和5号样品的最佳萃取溶剂分别为乙醇、二氯甲烷和丙酮,1号和3号样品的最佳萃取溶剂均为乙酸乙酯。为确保最终选定的溶剂对所有样品均有较高的萃取效率,以总萃取量作为判断依据。
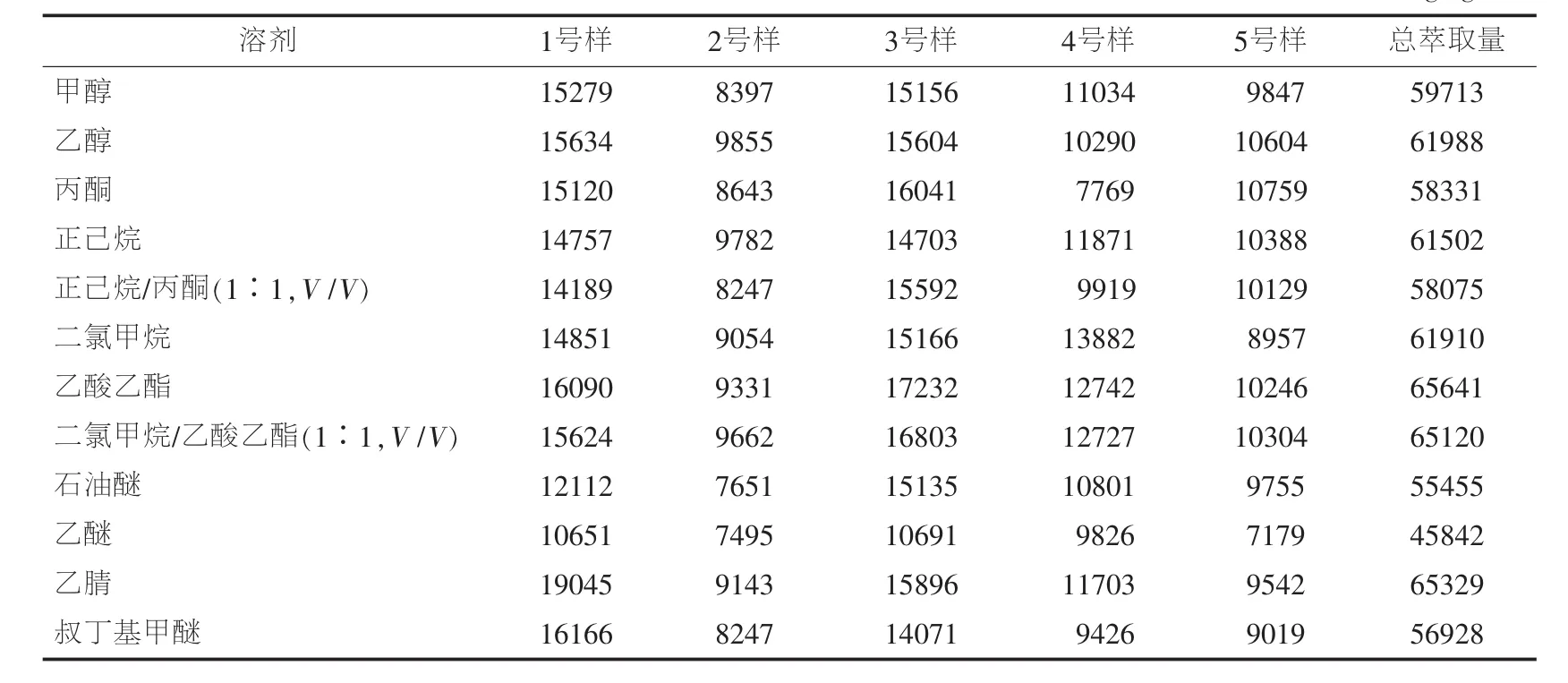
表3 不同溶剂的萃取效果 单位:mg/kg
从表3可知,当采用乙酸乙酯作为萃取溶剂时,总萃取量最大。因此,优化后的萃取条件为:以25 mL乙酸乙酯作为萃取溶剂,在温度40℃下超声萃取30 min。
2.2 分析条件的优化
不分流进样时,质谱信号强度取决于进样口温度(因素A)、离子源温度(因素B)和载气流速(因素C)。首先单独考察这3个因素对质谱信号强度的影响,发现质谱信号分别在进样口温度为260℃、离子源温度为280℃、载气流速为1.2 mL时达到最大值。因此设计了表4所示的9个正交实验条件[24],在这9个条件下对百菌清标准溶液进行分析,其峰面积(A)见表4。根据表4的数据计算各因素的k值和极差,确定优方案A3B3C2,即进样口温度为270℃、离子源温度为290℃、载气流速为1.0 mL/min。
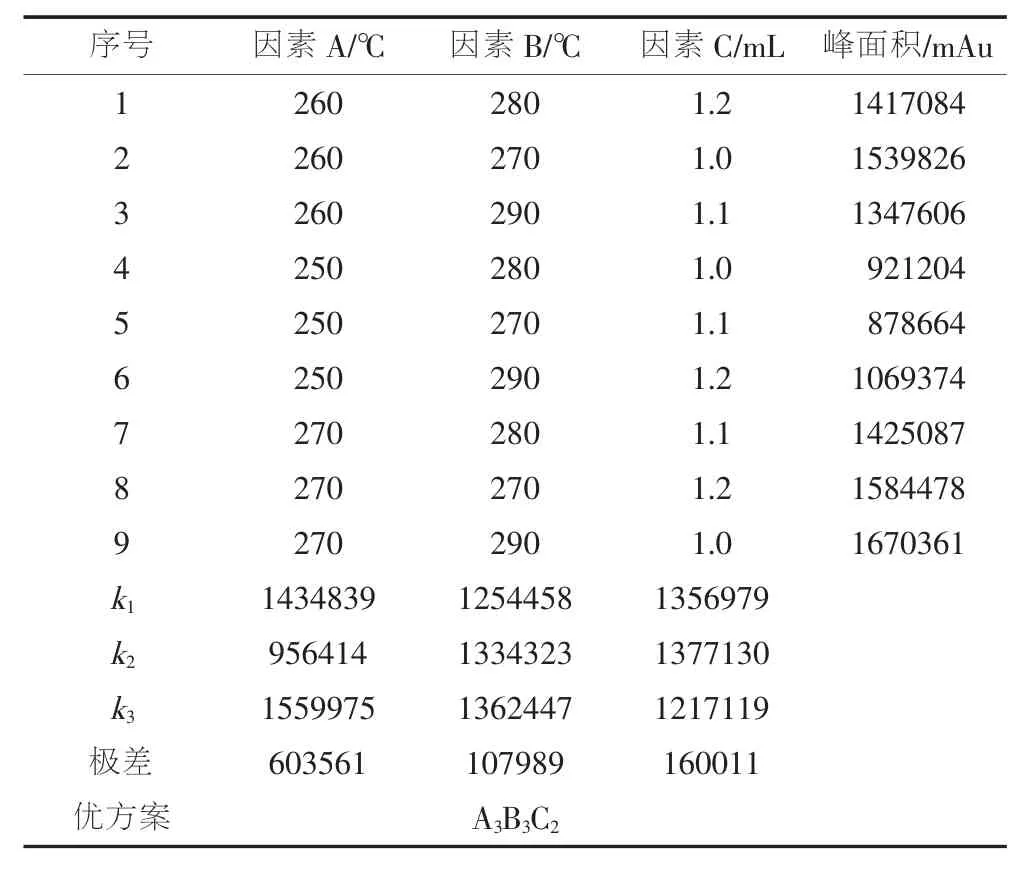
表4 分析条件正交实验
在此条件下对质量浓度(ρ)分别为 0.1、0.2、0.5、1.1、2.1、5.4、10.7、21.4 和 42.8 g/mL 的百菌清标准溶液进行GC/MS-SIM分析,观察百菌清峰面积(A)的变化情况,结果发现,当百菌清质量浓度为0.2~42.8 g/mL时,其峰面积与质量浓度之间存在良好的线性关系,线性方程为A=95399ρ-5085,线性相关系数r=0.9999。根据 3倍信噪比(S/N=3)计算方法检出限,该方法检出限为0.1 mg/kg。图1为百菌清标准溶液的GC/MS-SIM图,在图1中,在tR=5.659 min处出现1个对应于百菌清的尖锐谱峰。
2.3 方法的回收率和精密度
分别以不含百菌清的瓦楞纸、白卡纸、铜版纸、新闻纸和涂布白卡纸为空白基质,分别添加3个浓度水平(质量浓度分别为0.5、2.1和10.7 g/mL)的百菌清标准溶液,制成回收实验测试样,测定百菌清的回收率。每个添加浓度水平均进行9个平行样测试,计算平均回收率和相对标准偏差(RSD),结果见表5。
由表5可见,平均回收率为81.56%~95.87%,相对标准偏差(RSD)为1.57%~4.88%。

图1 百菌清标准溶液的GC/MS-SIM图
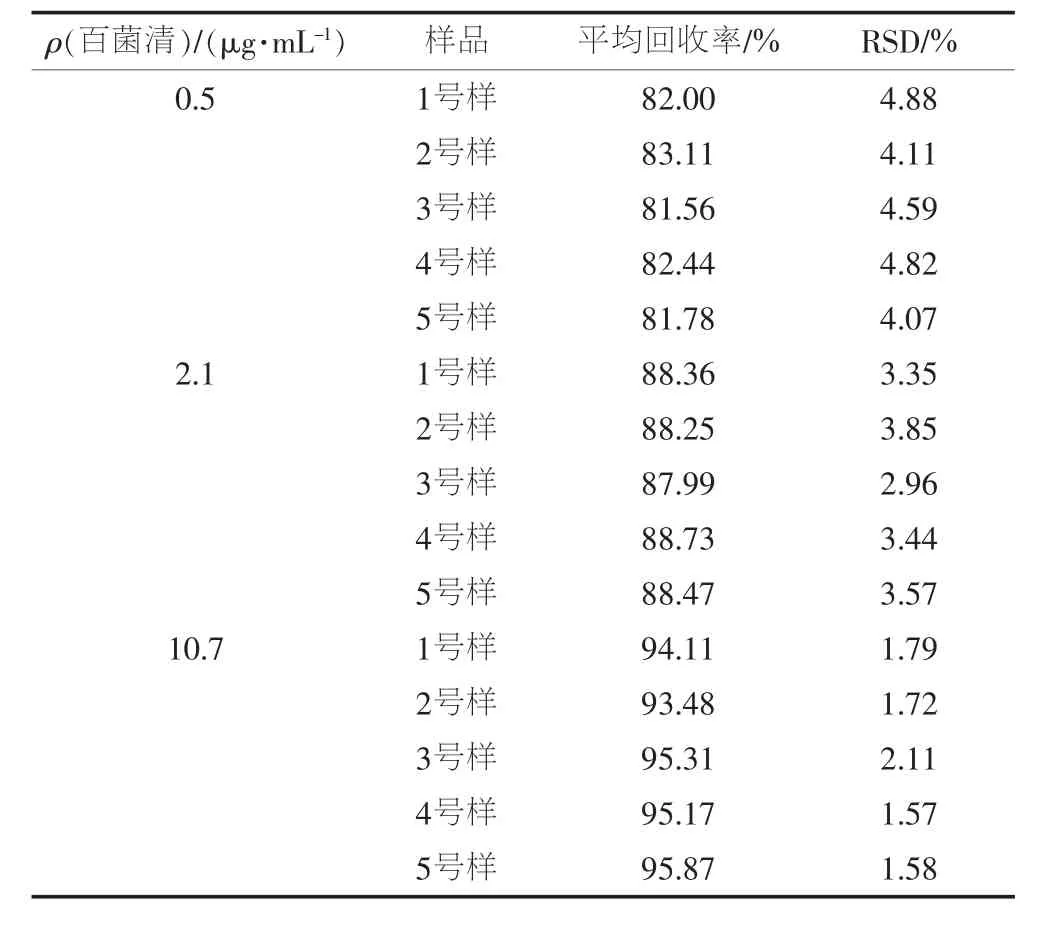
表5 方法的回收率和精密度
2.4 实际样品测试
应用本文建立的方法对49个市售纸和纸制品样品(包括瓦楞纸样品7个、白卡纸样品11个、牛卡纸样品9个、铜版纸样品5个、打印纸样品5个、涂布白卡纸样品7个和新闻纸样品5个)进行测试,结果均未检出百菌清。
3 结论
以乙酸乙酯为萃取溶剂,超声萃取纸和纸制品中残留的百菌清,萃取液浓缩定容后直接进行GC/MS-SIM分析,外标法定量,从而建立了一种测定纸和纸制品中百菌清残留量的气质联用分析方法。该方法简便快捷,灵敏度高,检出限低至0.1 mg/kg,完全满足欧盟法规(EU)2019/677的限量要求,可用于纸和纸制品中百菌清残留量的日常检测工作。

