注水瓶连续使用时间对其中水细菌污染情况的影响
刘明秀,舒成凤,王树英,杨 娟
(重庆市璧山区人民医院 1. 内镜中心; 2. 检验科,重庆 402760)
内镜对疾病的预防、诊断和治疗起到积极作用,但由内镜感染所致的严重风险已成为全球内镜领域内一个新的公共健康威胁,因而防止交叉感染是21世纪内镜检查面临的重大问题[1-3]。我国自2016年发布《软式内镜清洗消毒技术规范》[4]以来,内镜清洗消毒越来越受到医疗机构关注并逐渐规范化,而注水瓶及连接管(以下简称水瓶)作为间接污染源污染内镜往往被忽视[5]。当实施内镜治疗时,水瓶水直接进入患者血管使感染风险剧增,因此确保诊疗用水质量是防止内镜交叉感染的一项重要措施。Zhou等[6]对上海某大学附属综合医院肝移植病房的调查发现,自来水中普遍存在军团菌等水生病原体,因此规范规定了水瓶用水应为无菌水。研究[7]表明,即使使用无菌水仍会培养出致病菌,可能是污染液体通过内镜逆流至水瓶所致。然而国内规范尚未明确水瓶更换频率,而国外指南对水瓶更换频率亦缺乏统一标准。本研究将内镜水瓶灌注无菌水,每日诊疗结束于第1、2、3、4、5 天采集水标本进行微生物学检测,旨在探索水瓶连续使用时间,为进一步细化操作准则,完善内镜规范提供客观数据。
1 对象与方法
1.1 研究对象 便利抽取重庆市某三甲医院内镜中心,日均胃镜60人次、肠镜25人次,配置有3台胃肠镜主机(2台OlympusCV290、1台OlympusCV70),将临床使用中的5套水瓶(3套水封瓶及连接管和2套水泵及连接管)纳入试验对象,结构完整无漏水。2019年7—11月,将5套水瓶灌注无菌水,于第1、2、3、4、5天每日诊疗结束采集水标本进行微生物检测,并遵循《软式内镜清洗消毒技术规范》[4]每日更换注水瓶用水,水瓶每周采用环氧乙烷灭菌。
标本量计算采用G-power软件的χ2检验,设ES=0.28,α=0.05,1-β=0.95,df=5,计算总标本量约253份,因此最终纳入试验标本为250份。
1.2 方法 采用前瞻性、单中心、检验者单盲方法,每日诊疗操作前将水瓶灌注无菌水(四川科伦药业股份有限公司生产的500 mL瓶装无菌注射用水),诊疗操作结束于第1、2、3、4、5天采集水标本进行微生物检测,并倒掉水瓶剩余水第2天备用,整个操作遵循无菌技术原则,第5天采样结束将水瓶送消毒供应中心清洗灭菌。水瓶采样和检测操作均由专人负责。
1.2.1 水瓶采样 操作者戴口罩,采用速干手消毒剂消毒双手,打开无菌干燥容器,盖子内面朝上放置,将水封瓶倒置,水泵以脚踏开关控制,水自连接管流出。以密闭方式收集10 mL水后盖上盖子,将5份水标本标注为1~5号,采样后立即送检。
1.2.2 水瓶清洗 水瓶清洗流程遵循《医院消毒供应中心 第2部分:清洗消毒及灭菌技术操作规范》[8],即冲洗-洗涤(3M多酶液)-漂洗-终末漂洗-消毒(酸化水)-终末漂洗-干燥,再采用环氧乙烷灭菌。
1.2.3 检测方法 用无菌吸管吸取1 mL待测水标本接种1个无菌平皿,每份标本共接种4个平皿,每皿倾注冷至40~45℃的熔化营养琼脂15~20 mL,(36±1)℃恒温箱培养72 h,计算菌落数,并分离致病性微生物,用安图哥伦比亚血平板转种分纯后上机,采用法国梅里埃VITEK 2 Compact全自动细菌分析仪和梅里埃鉴定卡鉴定。菌落数(CFU/100 mL)=平均每皿菌落数×100。
1.2.4 效果评估 细菌菌落数参照英国、荷兰的指南和我国末洗水(纯化水)标准,以≤10 CFU/100 mL且不得检出致病微生物为合格。菌落数>100 000 CFU/100 mL不再计数,以100 000 CFU/100 mL表示。
1.3 统计方法 应用Excel表格录入数据,SPSS 24.0统计软件分析数据。计数资料采用频数和百分比描述,采用χ2检验比较细菌菌落数合格率,P≤0.05为差异有统计学意义。细菌菌落数符合正态分布采用均数±标准差表示,符合偏态分布采用M(P25,P75)间距描述。
2 结果
2.1 不同时间内镜水瓶水微生物污染情况 水瓶水第1天合格率96.0%,随着使用时间延长合格率逐渐降低,至第5天合格率仅为38.0%。水瓶水在不同时间微生物检测合格率比较,差异有统计学意义(χ2=46.321,P<0.001)。见表1。
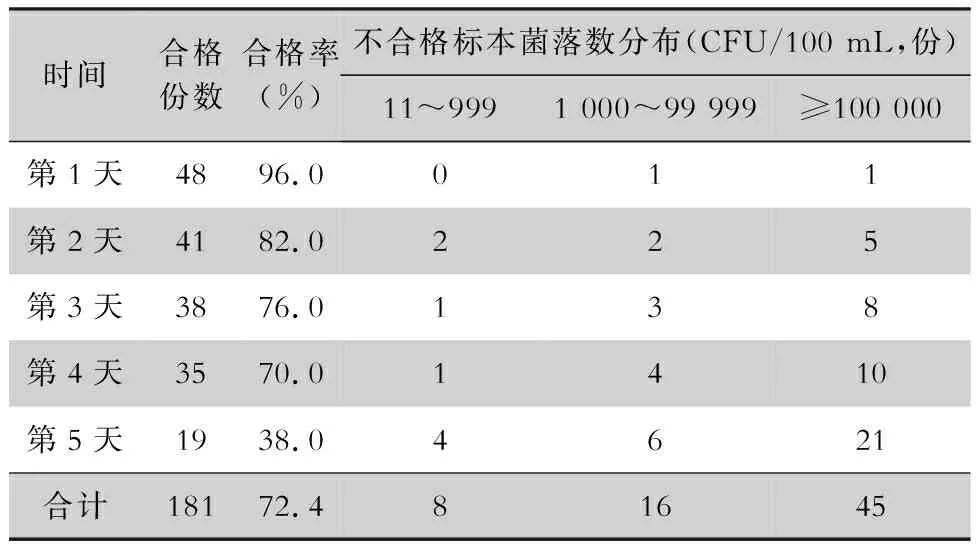
表1 不同时间内镜水瓶水微生物检测结果(n=50)Table 1 Microbial detection results of water injection bottles of endoscope at different times(n=50)
2.2 内镜水瓶水细菌种类 共检出细菌69株,均为条件致病菌。64株细菌鉴定到种类,共14种,4株革兰阳性杆菌因无鉴定卡未能鉴定细菌种类,1株革兰阴性杆菌未能鉴定细菌种类。其中解甘露醇罗尔斯顿菌最多(29株),铜绿假单胞菌次之(10株)。见表2。
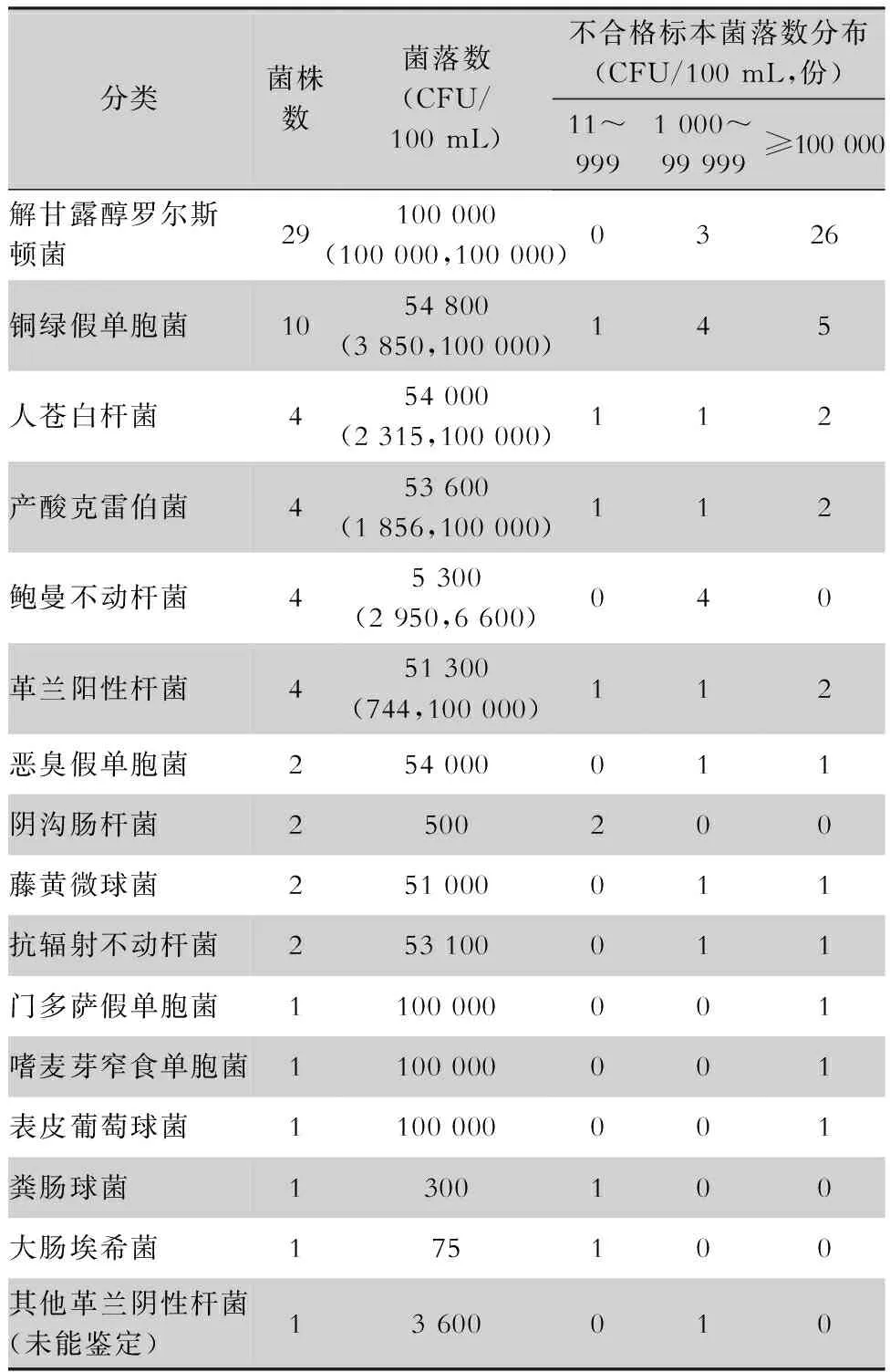
表2 内镜水瓶水细菌种类、菌落数及不合格标本菌落数分布Table 2 Bacterial species, colony count and distribution of colony count of unqualified specimens
3 讨论
近年来,各医疗机构充分重视内镜交叉感染的风险,但对诊疗用水等相关环节则关注较少。由于水瓶水为无菌水,且内镜管道全长约2 m,极少有人关注其微生物状况,因污染物逆流致水瓶水的微生物污染未引起充分重视。制造商较少关注因器械导致的交叉感染,一台内镜主机仅配备一套水封瓶和/或水泵,而内镜诊疗单元往往基于设备成本便忽略了水瓶污染。水封瓶水通过空气/水通道以冲洗镜头碎屑,水泵水通过辅助水通道或活检通道以冲洗胃肠黏膜、污染物,当胃肠道内容物需使用负压吸引时,细菌可能会随之进入空气/水通道、辅助水通道、活检通道,从而逆流至水瓶。美国食品药品监督管理局已收到污染液体自水通道回流至水瓶的报告[9]。
不正确使用可复用水瓶将增加患者交叉污染的风险,大连市23所二级以上医院检测注水瓶水78份,合格率为53.85%[10]。而现有文献对水瓶更换频率研究较少,因此明确水瓶连续使用时间对确保诊疗用水质量至关重要。本研究将水瓶灌注无菌水,于第1、2、3、4、5天每日诊疗结束采集水标本进行微生物检测,合格率分别为96.0%、82.0%、76.0%、70.0%、38.0%。结果显示随着使用时间延长,水瓶水合格率越来越低,致病菌滋生风险将越来越高,不同时间的微生物检测合格率比较,差异有统计学意义(P<0.001)。水瓶水使用1 d合格率为96.0%,为消除内镜诊疗安全隐患,提示水瓶连续使用时间应不超过1 d。在评估基准<10 CFU/100 mL下,Jouck等[11]采用过滤膜、R2A琼脂平板进行微生物培养,第1天细菌检测不合格率为17%,远高于本试验的4.0%,但细菌检测总不合格率为25%,略低于本试验的27.6%,因而表明应每日更换水瓶。较多协会、指南如美国胃肠科护士协会(SGNA)[12]、韩国胃肠道内镜学会(KSGE)指南[13]、美国胃肠内镜指南[14]、欧洲胃肠内镜学会(ESGE)和欧洲胃肠病内镜护理协会(ESGENA)指南[15]、加拿大感染预防控制指南[16]亦推荐水瓶至少每日更换,采用高水平消毒并彻底干燥。BSG指南[17]则建议每次内镜检查后即3 h更换水瓶,从现有研究结果分析,确实可有效降低致病菌滋生风险。本试验存在水瓶水前一天培养时细菌较多,而在第二天的标本中并未培养出细菌或数量减少的情况,分析原因可能是每日更换水瓶用水的措施阻断了一部分细菌传播。本中心内镜主机乃胃肠镜混合诊疗,如果将胃肠镜分机诊疗,能否延长胃镜水瓶时间或缩短肠镜水瓶时间有待于下一步探索。
250份标本经微生物鉴定共检出69株细菌,已鉴定的细菌有14种,均为条件致病菌,是医院感染重要病原菌及多重耐药菌,如铜绿假单胞菌、鲍曼不动杆菌、嗜麦芽窄食单胞菌、人苍白杆菌、阴沟肠杆菌、粪肠球菌等。69株细菌中,解甘露醇罗尔斯顿菌最多(29株),为革兰阴性菌、短杆、有芽孢、好氧、不需光照、耐药,正成为全球新兴的引起人类感染的条件致病菌,可导致肺炎、败血症等[18-19]。铜绿假单胞菌次之(10株),是一种重要的水源性致病菌,对抵抗力较弱人群可引起严重的甚至是致死性的脑膜炎、败血症等。69株细菌不能确定来源于哪类内镜检查时污染液体逆流,因此建议胃肠镜分机诊疗,有利于追根溯源。王伟民[2]对软式内镜微生物学监测结果显示,铜绿假单胞菌、藤黄微球菌在胃肠镜均有检出,肠球菌只在肠镜中检出。试验证明,水瓶水已成为内镜诊疗潜在污染源,因此应严格监管水瓶连续使用时间,充分重视诊疗用水的微生物污染。

