背根神经节中GABA 转运蛋白1 在神经病理性疼痛发生发展中的作用*
谢晓芳 让 凌 薛 锐 郑 飞 唐俊明 冉 然
( 湖北医药学院附属人民医院1 麻醉科;2 临床医学研究所,十堰 442000;3 湖北医药学院麻醉学研究所,十堰 442000)
神经病理性疼痛 (neuropathic pain, NP) 是由躯体感觉系统病变或疾病引起的一种临床常见的难治性疾病[1],深入研究NP 的发病机制,为其临床治疗提供高效可行的方案,将具有重要的临床意义。
神经元敏化是NP 的主要发病机制之一[1]。神经系统内兴奋性信号和抑制性信号的稳态失衡是导致神经元敏化的重要因素[2]。GABA 是神经系统中重要的抑制性神经递质,GABA 转运蛋白 1 (GABA transporter 1, GAT-1)介导的GABA 重摄取在GABA能信号调节中起重要作用[3]。研究发现,GAT-1 基因过表达的动物出现明显痛觉过敏的症状[4];有文献报道在坐骨神经慢性压迫损伤(chronic constriction injury, CCI)模型诱导的NP 模型中,在脊髓中GAT-1 的表达量明显增加[5],因此认为神经系统内GAT-1 的改变与NP 的发生、发展密切相关。
背根神经节 (dorsal root ganglion, DRG) 是伤害性信号从外周进入中枢的重要枢纽[6],研究发现正常大鼠DRG 上也存在有GAT-1 的表达[6],但神经损伤后DRG 上是否也发生GAT-1 表达的改变,这些改变在神经痛发病机制中的作用很少有研究涉及。因此,本研究通过构建大鼠CCI 模型,探讨DRG 中GAT-1 的改变,并且观察这些改变对疼痛症状的影响,旨在为NP 寻找以DRG 上GAT-1 为靶点的新治疗方法提供依据。
方 法
1.实验动物及分组
健康雌性SD 大鼠60 只,体重180~220 g,由湖北医药学院实验动物中心提供。60 只SD 大鼠采用随机数字表法分为 :对照组 (Sham)、CCI 组、CCI + NS 组、CCI + NO-711 组,每组15 只。NO-711购自美国Sigma Aldrich 公司,溶于0.9%生理盐水。
2.坐骨神经慢性压迫损伤模型
CCI 模型的制备方法参考Bennett[7]等文献。大鼠腹腔注射1% 戊巴比妥钠 (30 mg/kg) 麻醉。右股骨外侧切开皮肤,钝性分离肌肉,暴露坐骨神经干。在CCI 组大鼠中,在坐骨神经三支分叉上方用嗜铬羊肠线松结扎4 道,每道间隔约1 mm,结扎力度以见到肢体轻微抽动为宜。逐层缝合肌肉皮肤。Sham 组大鼠仅分离不结扎坐骨神经,其余步骤与CCI 模型一致。
3. DRG 局部给药
大鼠麻醉后,取俯卧位。在L5棘突旁0.5 cm 处,开2 cm 长的竖直切口,钝性分离棘突右侧缘肌肉层,充分暴露L5椎板。① DRG 局部单次注射:微量注射器插入L5右侧神经孔2 mm 左右,大腿肌肉抽动说明针尖接近DRG,固定针尖缓慢注射药物,逐层缝合切口;②DRG 局部置管给药[6]:在L5椎板上钻一个0.8 mm 的孔,将连接PE10 管的套管插入孔内2 mm,出现大鼠右后腿抽动动作说明置管成功。骨水泥固定套管,逐层缝合切口。
4. 行为学测试
行为学测试环境温度维持在22~24℃,湿度指数50%~60%,测量时间为上午9:00~11:00。热缩足反射潜伏期 (thermal withdrawal latency, TWL)测定:将大鼠放置在3 mm 厚的玻璃板上,罩上玻璃观察框,待大鼠适应30 min 安静后,用热痛刺激仪照射大鼠后足掌心,记录从照射开始至大鼠出现抬腿舔足等回避动作的时间;为避免组织损伤,自动切断时间设为 25 s;共测 5 次,间隔 5 min,平均值即为TWL。机械缩足反射阈值 (mechanical withdrawal threshold, MWT):将大鼠放置离桌面高50 cm 的铁丝网上,罩上玻璃观察框。用电子vonFrey 触痛仪的探针缓慢向上压迫大鼠后爪,记录电子vonFrey 触痛仪显示引起撤足反应的力;共测 5次,间隔 5 min,平均值即为MWT。
5. 蛋白免疫印记分析
大鼠腹腔注射1% 戊巴比妥钠 (40 mg/kg) 深麻醉后,取其右侧L4、L5脊髓节段及对应的DRG。RIPA 裂解组织后,离心取上清液,BCA 法测蛋白浓度。采用10% SDS-PAGE 凝胶电泳分离出30 μg蛋白样品, 转移至PVDF 膜上。PVDF 膜放入5%的脱脂奶粉中封闭60 min。分别加入α-Tubulin(鼠源,1:1000, Sigma)、GAT-1 一抗(兔源,1:500,Abcam),p-ERK(兔源,1:500,CST),c-Fos(兔源,1:1000,GeneTex),4 ℃孵育过夜。TBST 洗膜3次,辣根过氧化物酶偶联的二抗室温孵育1.5 h,继续TBST 洗膜3 次。ECL 化学发光法显影,Image J软件测灰度值进行半定量分析。
6. 免疫荧光
大鼠深麻醉下,经心脏灌注4%多聚甲醛固定,取L5水平脊髓及DRG。标本用多聚甲醛固定6 h,再浸入10%、20%、30%蔗糖梯度脱水,经OCT包埋后被切成20 μm 厚度的冰冻切片。切片用含有0.3% Triton X-100 的5%马血清封闭破膜30 min。DRG 切片加入GAT-1 一抗(兔源,1:300, Abcam),脊髓切片加入c-Fos 一抗(兔源,1:250,GeneTex),4℃孵育过夜。荧光二抗避光孵育1 h。脊髓切片用DAPI 染核10 min。 抗荧光淬灭剂封片,荧光显微镜下观察拍照,用Image J 计算平均光密度值,取各组的均数进行比较。
7. 统计学分析
采用SPSS 22.0 软件进行统计学分析,计量资料以均数±标准差 (±SD)表示。采用重复测量方差分析测量各组疼痛阈值;多组间比较采用单因素方差分析,两两比较采用最小显著性差异法。P< 0.05表示差异有统计学意义。
结 果
1. CCI 模型的建立
相比Sham 组,CCI 组的TWL 和MWT 均从术后1 天开始降低,第7 天降至最低值,至第14 天虽有缓解趋势,但仍处于较低水平,差异有统计学意义(P< 0.05,见图1),上述结果表明CCI 模型制作成功。
2. CCI 术后DRG 神经元中GAT-1 的表达
检测DRG 中的GAT-1 在神经损伤后不同时间点的表达水平,以探讨DRG 中的GAT-1 在NP 中的潜在作用。免疫荧光图像和Western blot 图像显示:在CCI 术后第7 天及第14 天,即疼痛最为明显的时期,DRG 中GAT-1 表达量升高(P< 0.05,见图2)。

图1 CCI 术后大鼠后足痛阈的改变 (n = 6, ±SD) (A) CCI 术后大鼠TWL的变化;(B) CCI 术后大鼠MWT 的变化Fig. 1 The change of pain threshold of the rats after CCI injury (n = 6, ±SD) (A) Thermal withdrawal latency (TWL) after CCI; (B) Mechanical withdrawal threshold (MWT) after CCI

图2 CCI 术后不同时间点DRG 中GAT-1 的表达 (±SD) (A, B) GAT-1 的荧光强度;(C, D) GAT-1 的蛋白表达量(n = 3)Fig. 2 GAT-1 expression in DRG at different time points after CCI (±SD) (A, B) GAT-1 immunofluorescence; (C, D) The expression of GAT-1 protein (n = 3)
3. DRG 注射GAT-1 抑制剂对CCI 大鼠TWL和MWT 的影响
CCI + NS 组和CCI + NO-711 组每组各6 只大鼠,于CCI 手术当天分别DRG 局部单次注射NO-711 (10 μg/μl, 10 μl)和10 μl 生理盐水后,观察两组大鼠术后2 周内痛阈值的变化。相比CCI + NS 组,CCI + NO-711 组术后第3、5、7 天热痛觉过敏反应明显降低(P< 0.05,见图3A),同时术后第3、5天的MWT 也得到了缓解(P< 0.05,见图3B)。CCI + NS 组和CCI + NO-711 组每组各9 只大鼠,于CCI 术后第7 天通过预留的DRG 套管分别将NO-711 (10 μg/μl, 10 μl ) 和生理盐水 (10 μl) 注射至大鼠的DRG 附近,其中每组3 只大鼠于给药后6 h取材,观察CCI + NS 组和CCI + NO-711 组剩余6只大鼠注射后术后第1 周的TWL 和MWT 的变化。相比CCI + NS 组,CCI + NO-711 组大鼠的TWL 和MWT 在给药后0.5 h 立即升高,2 h 时最明显,镇痛作用持续48 h(P< 0.05,见图3C、D )。
4. DRG 局部注射 NO-711 对CCI 术后DRG 中p-ERK 表达的影响
根据Western blot 结果:CCI + NS 组大鼠 p-ERK表达水平较 Sham 组升高(P< 0.05,见图4); DRG局部注射NO-711 后,CCI + NO-711 组大鼠p-ERK 蛋白表达量明显下降(P< 0.05,见图4)。说明抑制DRG 神经元GAT-1 的作用可降低DRG 神经元中p-ERK 的表达 。
5. DRG 局部注射NO-711 对CCI 大鼠脊髓中c-Fos 表达的影响

图3 CCI 手术当天和术后第7 天DRG 局部注射NO-711 对大鼠痛阈的影响 (n = 6, ±SD)Fig. 3 Effects of local DRG injection of NO-711 on pain threshold of rats on the day of CCI operation and the 7th after operation (n = 6, ±SD)
脊髓背角是DRG 突触后神经元的聚集部位,其激活状态对于伤害性信号的传递有着十分重要的作用。c-Fos 作为神经元激活标记物[6],可用来定量经DRG 套管注射NO-711 对大鼠脊髓突触后神经元激活的影响。Sham 组c-Fos 染色阳性的神经元细胞极少,神经损伤后c-Fos 阳性神经元表达增加,而DRG 局部注射NO-711 显著减少了CCI 术后脊髓c-Fos 阳性细胞的数量(见图5A)。Western blot 结果也表明相比CCI+NS 组,CCI + NO-711 组的c-Fos蛋白的表达明显减少(P< 0.05,见图5B、C)。这些数据说明抑制DRG 神经元GAT-1 的作用减少外周伤害性信号向脊髓的兴奋性输入。
讨 论
去抑制学说是近些年来关于NP 发生机制提出的新观点,认为NP 的发生和抑制系统的功能减弱有关[8]。GAT-1 介导了GABA 的重摄取,与GABA作用的终止密切相关。本研究发现,生理状态下,DRG 中的GAT-1 表达水平不高,而神经损伤后第7、14 天DRG 内GAT-1 表达上调,且在MWT 及TWL最明显的CCI 术后第7 天,GAT-1 的表达量最高。神经损伤后DRG 的GAT-1 的表达上调很可能加速细胞外的GABA 清除,降低了细胞外的GABA 浓度,进一步减弱GABA 能抑制信号,从而使神经元敏感性增高,引起NP 的症状。

图4 CCI 术后DRG 局部NO-711 注射对DRG 内p-ERK 蛋白表达量的影响 (±SD)Fig. 4 Changes of p-ERK protein expression in the DRG after NO-711 topically injection in CCI rats (±SD)
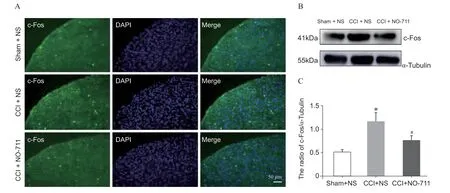
图5 CCI 术后DRG 局部注射NO-711 对大鼠L5 脊髓背角c-Fos 蛋白表达的影响 (±SD)Fig. 5 Changes of c-Fos protein in the L5 spinal dorsal horn in the L5 DRG topically injection of NO-711 (±SD)
为了探讨DRG 局部GAT-1 的表达升高对NP发生和发展影响,本研究采用DRG 局部注射技术将NO-711 局部注射到DRG 上,避免鞘内注射和全身给药带来的全身性作用对实验结果的影响;通过观察发现CCI 手术当天DRG 局部注射GAT-1 抑制剂后,痛觉过敏出现的时间延迟到术后第5 天才出现,而且术后第7 天在NP 症状稳定之后,在DRG局部单次给予NO-711,也发现CCI 大鼠MWT 和TWL明显升高,虽然镇痛作用只可持续48 h,以上结果说明逆转DRG 中GAT-1 的上调可以影响NP 症状的发生,靶向DRG 的GAT-1 有一定的治疗NP 作用。以往研究报道鞘内注射GAT-1 抑制剂可改善NP模型的痛觉过敏[3,9],当然这样的结果也不能排除鞘内注射后药物浸润到DRG 从而发挥的镇痛作用。
神经元兴奋性的改变在NP 的发生发展中起重要作用,细胞外信号调节激酶 (ERK) 介导的ERK通路在伤害性感觉的传递和神经元兴奋性调节过程中发挥重要作用[10,11],有报道称CCI 大鼠DRG 中ERK 磷酸化可抑制 A 型快速失活钾通道引起DRG神经元敏感性增高[12]。本研究也发现CCI 术后p-ERK升高,而DRG 局部注射NO-711 可以抑制p-ERK的表达,间接说明GAT-1 上调可能会使DRG 神经元致敏,而抑制GAT-1 的作用可以降低DRG 神经元兴奋性,从而产生镇痛作用。
痛觉信号的产生是通过外周伤害性信号传递到DRG,继而传递到脊髓背角等高级感觉中枢,c-Fos是脊髓背角感觉神经元激活的标志性蛋白。本研究发现CCI 术后脊髓背角内c-Fos 明显升高, DRG注射GAT-1 抑制剂NO-711 抑制了脊髓背角内c-Fos的表达,预示抑制GAT-1 的作用可以降低外周伤害性信号向中枢端的传递,从而抑制中枢敏化。因此,神经损伤后DRG 中GAT-1 的表达上调引起神经元敏化,易化了伤害性信号从外周向中枢的传递,可能是NP 的发生机制。靶向DRG 中的GAT-1 可能是有效缓解NP 的新方法。
本研究仍存在一定的局限性,本研究采用c-Fos和p-ERK 来表达来间接反应脊髓背角和DRG 局部的神经元的激活状态,如果直接用膜片钳对DRG及脊髓背角神经元兴奋性加以验证,将为实验结果提供更加有力的证据。

