独脚金内酯的生物合成及其调控
吴转娣 胡 鑫 昝逢刚 刘新龙 刘家勇 陈学宽 吴才文
(云南省农业科学院 甘蔗研究所/云南省甘蔗遗传改良重点实验室,云南 开远 661699)
独脚金内酯(strigolactones,SLs)是一类在植物根部产生的萜内酯,属于新型植物激素,可调控植物的整体结构形态[1-2]。已有研究表明SLs抑制植物分枝,塑造根的形态,促进叶片衰老,调节植物的次生长[3];还与干旱胁迫[4]、耐寒性[5]、耐盐性[6]、逆境胁迫[7-8]、光形态建成[9]有关。SLs也参与了豆科植物的结瘤[10-12],对作物产量的形成与品质的保持起着至关重要的作用。不同植物中可能存在多种多样、平行的SLs生物合成途径和信号转导机制[13-15]。独脚金内酯的功能一直是植物生物学研究的重点,因此,为了解SLs生物合成的最新研究进展,本研究以独脚金内酯生物合成为关键词,搜索2000—2020年NCBP数据库的相关文献资料,对独脚金内酯生物合成和调控方面的研究成果进行综述,以期为独脚金内酯及其相关基因的进一步研究提供依据。
1 独脚金内酯的结构与化学特性
独脚金内酯具有不同的结构和不同的三维立体专一性,这是其功能的多样性和灵活性的重要基础。独脚金内酯的核心结构由A~D 4 个环组成(图1),包含1 个三环ABC环系统,通过烯醇醚桥接到丁烯内酯D环[16]。丁烯内酯环的立体化学结构是保守的,根据立体化学差异B和C环将SLs划分为2 大类,独脚金醇类和列当醇类;进一步的修饰则可产生多种不同的独脚金内酯;D环结构是由类胡萝卜素裂解双加氧酶产生的立体异构体;独脚金内酯的生物活性依赖于C-D环,而C-D环也是高度保守的[16]。由于连接在A环和B环上的侧基不同,会产生相当大的差异[16]。目前已知的所有SLs在碳20 (C-20)位置(R构型)具有相似的立体化学结构[17-18]。独脚金内酯的人工合成类似物包括GR24、GR5和GR7[19]。
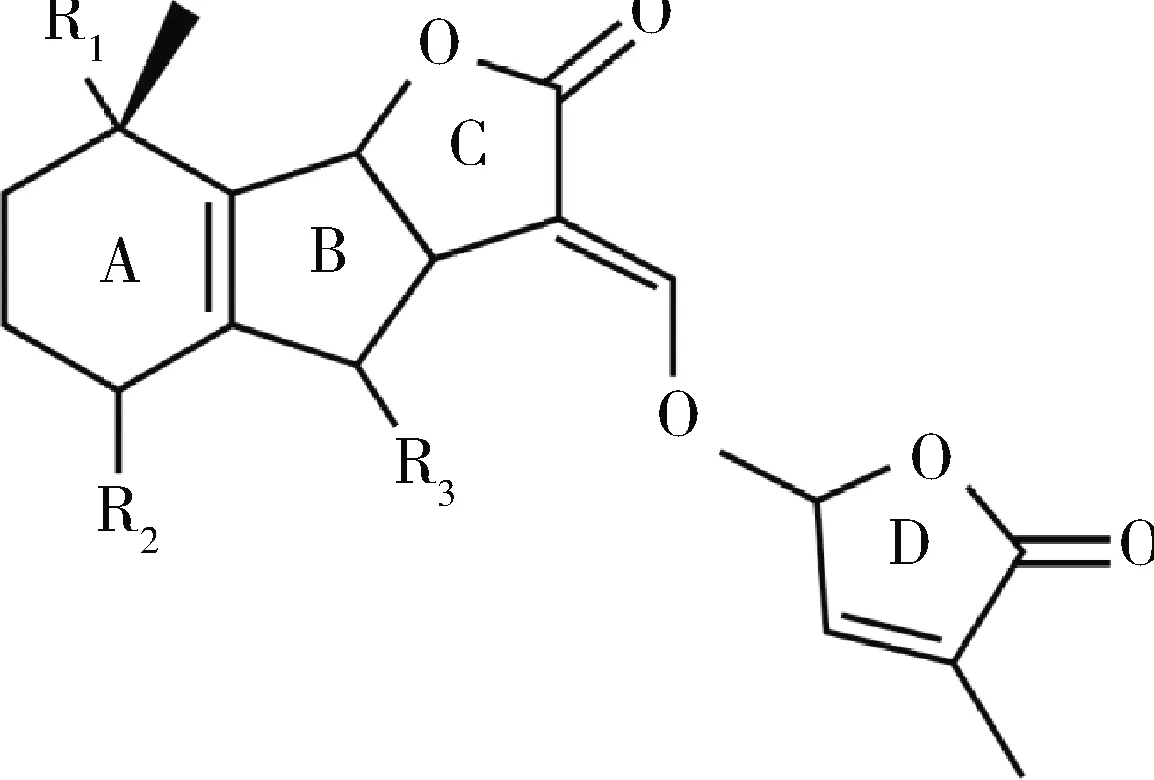
图1 独脚金内酯的化学结构[16]Fig.1 Chemical construction of strigolactones[16]
2 SLs的生物合成途径
SLs属于萜烯内酯类胡萝卜素衍生物,已经证明有5 个主要酶参与了SL的生物合成(表1),分别为异构酶DWARF27(D27)、类胡萝卜素裂解双加氧酶7(Carotenoid Cleavage Dioxygenase 7,CCD7)、类胡萝卜素裂解双加氧酶8(Carotenoid Cleavage Dioxygenase 8,CCD8)、细胞色素P450单加氧酶(MORE AXILLARY GROWTH 1,MAX1)和侧分枝氧化还原酶(LATERAL BRANCHING OXIDOREDUCTASE,LBO)[13]。
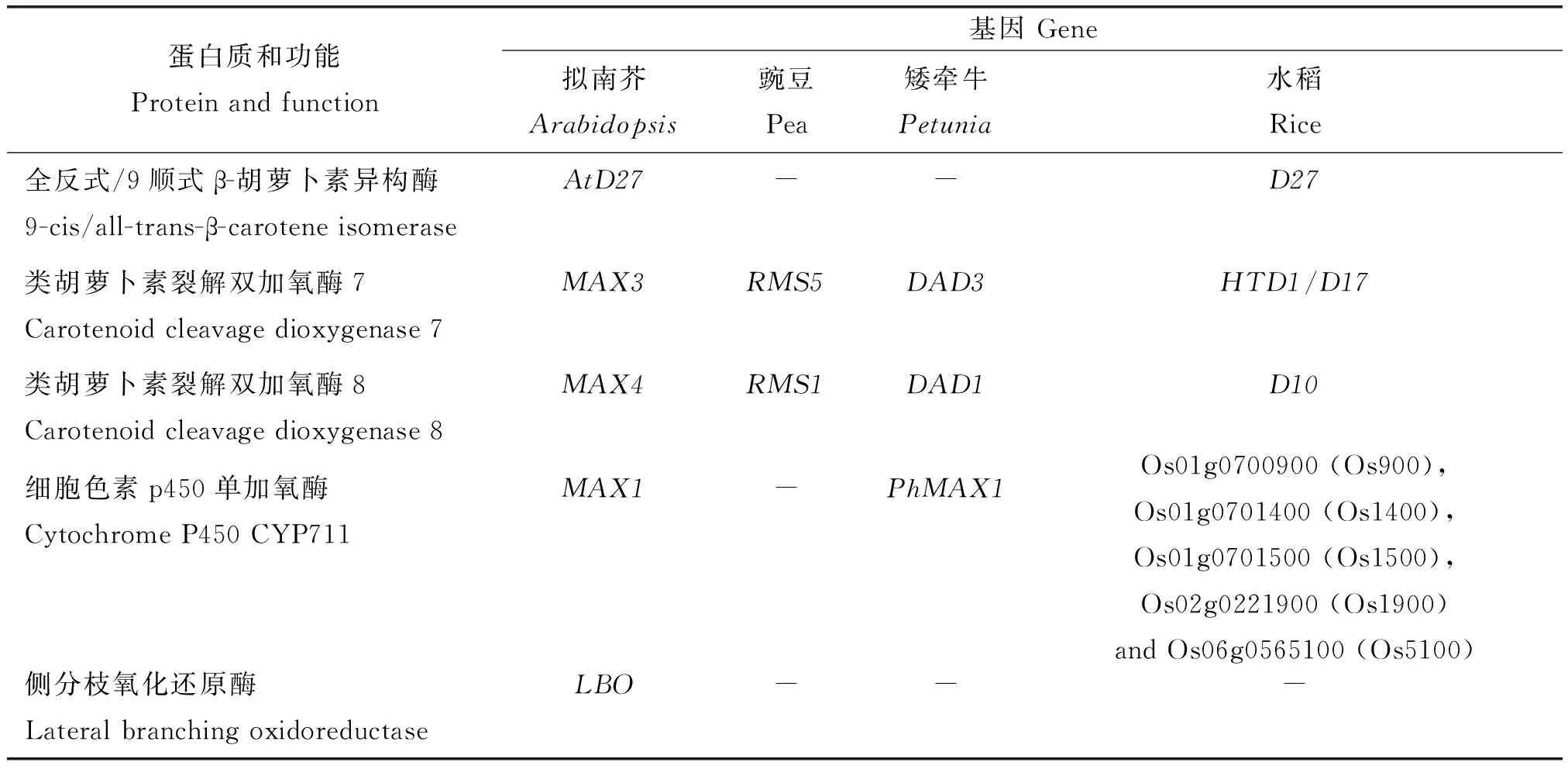
表1 不同植物中独脚金内酯生物合成相关的基因[45]Table 1 Genes involved in strigolactone biosynthesis[45]
遗传分析和酶学的研究表明SLs来源于all-trans-β-carotene途径(图2)。SLs生物合成的第1 步是以类胡萝卜素作为底物,在D27蛋白的催化作用下,完成1 个可逆的异构化反应,将trans-β-carotene异构化成为9-cis-β-carotene,再通过CCD7裂解催化产生9-cis-β-apo-10′-carotenal[18],接下来CCD8将这个裂解产物转化为己内酯[18],己内酯是所有已知SLs的生物合成前体,利用trans-β-carotene产生己内酯的通路是十分保守的[18],但在不同物种之间从己内酯到SLs的通路有所不同,并由此产生出多种类型的SLs。类胡萝卜素不仅是SLs的前体,也是其他重要的植物次生代谢物的前体,包括植物激素脱落酸(ABA)。除草剂氟啶草酮(fluridone)和达草灭(norflurazon)是已知的类胡萝卜素生物合成抑制剂[20]。
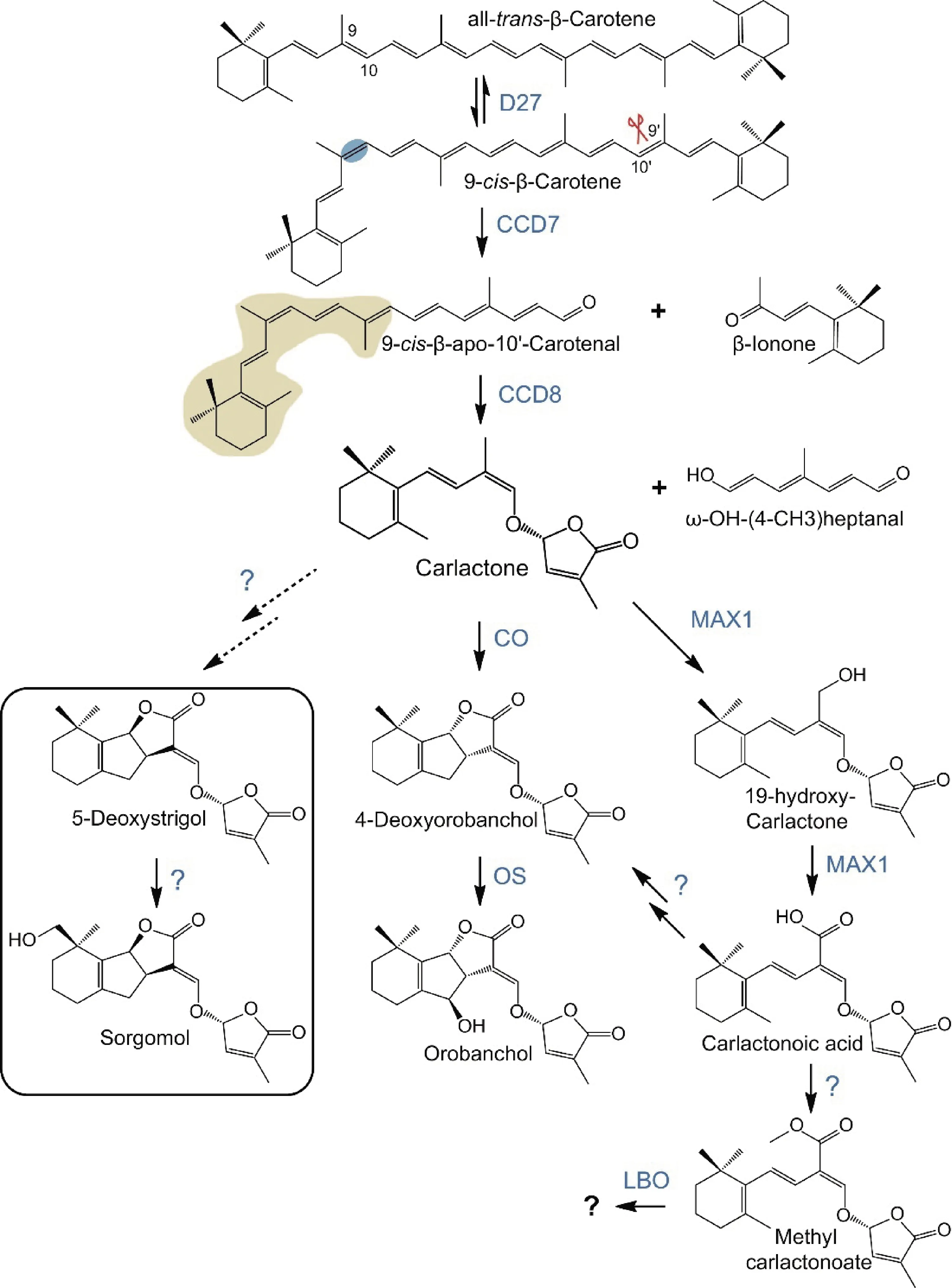
图2 独脚金内酯生物合成通路的部分示意图[21]Fig.2 Part of the biosynthesis pathway of strigolactones[21]
在拟南芥中,己内酯由MAX1通过19-hydroxy-carlactone转化为己内酯酸(carlactonoic acid,CLA)[22]。CLA随后被1 种未知的甲基转移酶转化为甲基化己内酯酸(methyl carlactonoate,MeCLA)。MeCLA在抑制芽分枝方面具有一定的活性,是1 种典型的SLs,但LBO可以进一步将MeCLA转化为1 种未知的SL类化合物,可能是SL生物合成的最终产物,在拟南芥中具有更高的SL活性[23]。在水稻中,己内酯通过MAX1同源分子Os900(CYP711A2)转化为己内酯酸,催化己内酯转化为4-deoxyorobanchol(4DO),随后,第二个水稻MAX1同系物Os1400(CYP711A3)将4DO转化为列当醇(具有SL活性)[24-25]。此外,CL被认为是5-deoxystrigol的前体,可转化为sorgomol[26]。编码D27、CCD7、CCD8、MAX1、LBO的基因已通过D27[27-28]、MAX3/HTD1/RMS5/DAD3/CCD7[27,29-31]、MAX4/D10/RMS1/DAD1/CCD8[32-37]、MAX1[38-40]、LBO[13]等基因的研究鉴定获得。这些基因的突变体表现出分蘖或分枝数量的增加和矮化的表型,并且都可以通过外源SL恢复表型[41-44]。然而,不同基因突变体之间还是存在分蘗表型差异,可能是基因在参与独脚金内酯生物合成的同时,也参与了其他通路,或者说并不能通过突变1 个基因而中断独脚金内酯的合成,因为独脚金内酯可能存在其他并行的合成通路,SL的生物合成途径仍有待进一步的确定。
2.1 全反式/9顺式β-胡萝卜素异构酶
水稻D27基因编码一个含铁蛋白质,其定位于叶绿体。d27突变体不能产生SL,植物分蘖数增加,并且株高降低,其表型可被外源SL恢复,表明D27是SL生物合成所必需[27]。D27蛋白是一种异构酶,在SL生物合成的第一步将全反式β-胡萝卜素转化为9顺式β-胡萝卜素[18]。在拟南芥中DWARF27基因编码一个全反式/9顺式β-胡萝卜素异构酶,受生长素、脱落酸和磷缺乏诱导表达[46],其在应对多种植物激素和磷酸盐缺乏方面发挥了重要作用。在缺磷条件下,水稻根系中大多数SL生物合成基因(D27、D17、D10和OsMAX1s)高表达,并提高了SL的水平。在缺氮条件下,D10和D17的表达水平升高,但D27不受影响[47]。相比之下,在缺硫的条件下,只有D27表达水平提高了,是缺磷时的10倍,导致SL生物合成增加。在SL生物合成基因中,仅D27转录增加[48]。丛枝菌根真菌能为宿主提供硫、氮和磷[49-50]。而水稻D27可能在丛枝菌根真菌对硫的有效吸收中起重要作用。在低硫条件下,AtD27在拟南芥根中的表达水平增加,但MAX1和MAX3的表达不增加[51-52],说明D27能够响应低硫并被诱导表达。
已有研究表明在缺硫条件下,水稻SL生物合成基因D27表达增强,硫供应降低了其表达。在硫充足和硫缺乏的条件下,D10、D17和OsMAX1的转录水平没有差异,说明硫缺乏时SL水平升高是由于D27的高表达;且d27突变体的分蘖芽数高于野生型,但低于其他d突变体;在缺硫条件下,d27的叶绿素含量低于其他d突变体[12,53]。上述结果表明d27在水稻对硫缺乏的适应中起着重要作用。在水稻中,内源SL水平在氮、磷或硫酸盐(-N、-P或-S)缺乏时增加,SL突变体表现出叶片关节角增大、矮化、叶片衰老延迟、分枝增强等特征[53]。SL水平响应-N和-P缺乏得到增加,增加的内源SLs可能负调控水稻叶片角度,使叶夹角降低[54]。
2.2 类胡萝卜素裂解双加氧酶7
在拟南芥中,类胡萝卜素裂解脱氧酶蛋白有9 个成员,有5 个属于NCEDs分支,在植物激素ABA的生物合成中起着至关重要的作用[55]。CCD7和CCD8的同源系谱属于系统发育上不同的分支,与非植物的同源系谱相似性大于与植物的同源系谱[37,56]。利用CRISPR/Cas9技术在水稻中定向敲除类胡萝卜素裂解双加氧酶7(CCD7),发现CCD7控制着SL生物合成的关键步骤。SLCCD7反义表达番茄植株的分枝明显增多,独脚金内酯的含量明显降低[31]。ccd7突变体分蘖期显著增加,且高度降低,应用合成SL模拟GR24可以恢复该突变体的表型。ccd7突变体的根分泌物中SL含量减少了。百脉根LjCCD7基因沉默植株SLs降低了80%,与对照相比,转基因ljccd7沉默植株由于节间较短而高度降低,分枝和根较多,总生物量增加,结节减少20%,因此认为CCD7与生殖和衰老以及植物根的结节有关[57]。
不同植物中CCD7的时空表达并不相一致。例如:拟南芥CCD7(MAX3)基因的转录在根中最高[27-28];而水稻和番茄CCD7在未成熟的地上部分组织、维管束和果实中表达最高[30-31]。虽然造成这种差异的原因尚不清楚,但可以推测,SL的生物合成酶也参与了其他途径,因此受到不同的调控。已有研究表明CCD7有助于菌根中积累的菌根素和环己酮色素的形成[31]。
生长素也是SL生物合成的主要调控因子,维持着CCD7和CCD8的基本转录水平。去除豌豆生长素来源,通过去顶或应用生长素运输抑制剂1-N-萘基酞氨酸(1-N-naphthylphthalamic acid,NPA)导致RMS5显著下降,尤其是RMS1在茎的上部转录水平,并可以通过为植物提供生长素而恢复[58-59]。同样地,当去除了茎顶端或直接在这些器官下方施用NPA时,拟南芥MAX3的转录水平显著下降[60]。与其调控作用相一致,在完整的豌豆植株茎周围施用外源生长素,增加了处理部位以下RMS1和RMS5的转录水平[59]。在干旱、涝渍和茉莉酸甲酯(MeJA)处理条件下,苹果CCD7的表达量和启动子活性下降。MdCCD7的RNAi株系在苹果中表现为基因表达减少和分枝增多;以MdCCD7RNAi和野生型‘Royal Gala’为砧木和接穗进行了互补嫁接试验;野生型根不能抑制MdCCD7RNAi接穗中的分枝;通过MdCCD7RNAi的表型分析认为控制苹果腋芽生长和芽生长速率的是定位在茎内的SL的生物合成,而不是根[61]。
2.3 类胡萝卜素裂解双加氧酶8
在MAX4酶的作用下产生了己内酯,是SLs生物合成途径中的第一个具有SLs活性的产物。已经发现的独脚金内酯都是己内酯的衍生物,己内酯是所有天然独脚金内酯的母体化合物,其所含的立体B/C环结构是决定其是否具有生物活性的必需基团[39,62]。CCD8的催化作用是一个连续双氧化作用,因此CCD8被认为在SLs生物合成过程中占着十分关键的位置[45]。CCD8基因是CCDs超基因家族中的一个成员,在水稻和甘蔗(Saccharumspp. hybrids)等植物中均有2 个同源基因。本研究团队的研究表明甘蔗也有2 个CCD8基因分别为ScCCD8-1和ScCCD8-2,而且这2 个基因的表达模式不同(未发表研究结果)。ScCCD8-1基因在不同组织部位的表达差异较大,主要在幼叶和根尖的表达量高,其他组织中也有表达;ScCCD8-2基因也在各个不同的组织部位表达,但不同组织中的表达差异不显著。生长素能够促进SLs的生物合成,通过分枝突变体嫁接试验的研究,发现豌豆的RMS1(CCD8)基因能够对生长素作出响应[37]。此外,在SL介导的茎分枝调控中,CCD8在菊花中发挥着重要作用[63]。
SL与生长素、细胞分裂素共同作用影响植物分蘖的产生[64]。在水稻、豌豆和拟南芥的ccd8突变体中均出现SLs的含量减少的情况,植株表现矮化和多分蘖,GR24处理后可恢复野生表型[1,33,65]。体外酶抑制试验研究表明植物分蘖表型的改变是通过抑制CCD8的酶活性进而抑制SLs生物合成途径而实现的,而非D27或CCD7[66]。生长素能通过调控植物SLs的生物合成过程来调控植物的分蘖,CCD8基因则可能在生长素调控SLs的过程中起关键作用[67]。d10和d3突变体的次生根数量减少,GR24消除了NAA对d10突变体中次生根发育的影响,但在d3突变体中不起作用[68]。CCD8基因不仅与SLs的生物合成有关,还参与了其他的生物学通路,影响植物的生殖发育。CCD8基因的沉默导致多种植物生长和生殖发育出现异常:拟南芥种子小且少,花和果变小[69];番茄的分枝、节点、不定根增多,矮化,花小,果实小,种子变细等[31];马铃薯表现匍匐茎减少和少花的表型[70];玉米CCD8基因突变后分枝增加,茎干变细,节间长度降低,不定根的节点发育推迟。小麦TaVRN1蛋白是APETALA1(AP1)亚族中的一类MADS-box转录因子,是调控植物营养生长和生殖生长之间转换的一种转录激活因子。当在拟南芥中过表达时,TaVRN1可以通过结合MAX4启动子近端1 700 bp处的CArG结构而激活MAX4基因的表达[70]。CCD8基因在植物的生长和生殖方面具有重要的作用[71]。根据以上证据可推测植物的分蘖调控作用可能是通过诱导CCD8基因的表达,进而调控SLs生物合成途径而实现的。本研究团队通过甘蔗去顶芽试验,也证实了甘蔗中的ScCCD8-1的表达水平能够受甘蔗去顶芽处理诱导显著下调,ScCCD8-1能响应生长素的诱导。因此,ScCCD8-1在SLs生物合成过程中具有重要的调控作用,但其分子调控机制并不清楚。
通过研究SL-缺乏突变体拟南芥max3和max4[60]、水稻d10[33]和矮牵牛dad1[32,34-36]发现,SL的生物合成受一个负面的反馈机制调控,控制生物合成基因的表达。此外,外源SL类似物GR24的应用抑制了拟南芥mas3和max4的表达[72]。除了发生在局部并可能由SL信号通路催化的直接抑制外,SL生物合成可能还受到PAT介导的长距离反馈回路的控制:较高的SL水平通过降低植物生长素电导率来抑制SL生物合成[58-60]。
2.4 细胞色素p450单加氧酶
嫁接研究表明MAX1基因的作用位于CCD7和CCD8生物合成通路的下游[1,16,38]。在SL通路中,MAX1基因[38,69]在单子叶植物中是多系统的,而在藻类基因组中不存在[73]。此外,通过对拟南芥max1-1突变体的分析,发现MAX1基因是SL通路的一个组成部分。MAX1基因是细胞色素P450单加氧酶家族(CYPs)的成员,被鉴定为At2g26170[38]。MAX1基因属于CYP11家族,编码细胞色素p450单加氧酶。与MAX1基因相关的突变表型只在拟南芥中被发现,该基因存在于所有的维管植物中[73],CYPs家族酶实际上在所有的生物体中都是普遍存在的,甚至在病毒中也存在,其成员可催化广泛的氧化还原反应[73]。由于CYPs可以催化不同种类的反应,因此MAX1尽管可以催化下游的CL的羟基化反应,在MAX通路中的重要作用难以识别。近期的研究表明,max1突变体中己内酯的含量比野生拟南芥高约700 倍,说明己内酯(CL)是MAX1的底物,是一种移动信号[62]。
2.5 侧枝化氧化还原酶基因
天然独脚金内酯的多样性研究表明,应有更多的酶参与其生物合成[13],有待进一步发现。通过转录组学方法修改独脚内酯生物合成基因表达并结合反向遗传学的方法,在拟南芥中发现了独脚金内酯代谢中缺失的一种酶,即侧分枝氧化还原酶基因LBO,其编码一个2-氧戊二酸(2-oxoglutarate)和铁(II)依赖的双加氧酶,该酶参与了MAX1下游独脚金内酯的合成[13]。MeCLA是侧枝化氧化还原酶LBO的底物,LBO可将MeCLA氧化成为MeCLA+16D[13]。
拟南芥lbo突变体的茎分枝增加,但lbo突变体的表型与max突变体相比没有显著差异,表明之前在拟南芥中鉴定出的独脚金类化合物并不是拟南芥中主要的独脚金内酯[13]。嫁接试验表明:LBO需要嫁接传递的信号,这反过来又需要MAX1的产物;突变体lbo显示出对己内酯、MAX1的底物、MAX1下游产物MeCLA的响应降低;LBO蛋白特异性地将MeCLA转化为一种未知的类独脚金内酯化合物[13]。因此推断,在拟南芥和其他种子植物中,LBO基因的功能可能是在独脚金内酯生物合成的后续步骤中发挥重要作用[13]。
在水稻中,CL转化为标准的四环独脚金内酯结构需要向C19添加2 个氧原子,并关闭B和C环以产生4-脱氧葡萄糖基(4DO,ent-2′-epi-5-deoxystrigol)[21]。这个反应是MAX1的家庭成员细胞色素P450蛋白质催化的[38-39]。第二个MAX1酶氧化4DO产生列当醇[39]。在拟南芥中的具体反应过程还不太清楚,因为只有唯一一个MAX1基因编码的蛋白质氧化CL的C19产生己内酯酸(CLA),并不明显促进形成B和C环[23,39,74]。内源的MeCLA的产生需要一个未知的甲基转移酶催化。由其与受体D14互作推测MeCLA具有相关生物活性,然而CL和CLA都不具有该生物活性[23]。拟南芥嫁接试验发现上游和下游产物MAX1是可以通过嫁接转移传送,也就是说,MAX1的底物和产物可以从根茎转运至芽处[38,60]。意味着拟南芥中可被转运的移动产物可能是CL-及CL-相关的产物。
拟南芥MAX3和MAX4基因的一个共同特征是:在独脚金内酯生物合成和感知突变体中的表达增加,其转录水平随着生长素水平和/或生长素处理的变化而变化[60]。因此,推测在特定条件下,这些新的独脚金内酯生物合成基因可能与这些新的独脚金内酯生物合成基因共同表达。综上,LBO在MAX基因和CL的下游产生类独脚金内酯化合物的过程中起着至关重要的作用。该研究结果对于识别其他具有生物活性的独脚金内酯具有重要意义,有助于进一步了解独脚金内酯生物合成途径的组成和调控,进而了解植物中独脚金内酯的功能及其作用机制。
3 SLs的功能
通过豌豆、矮牵牛、拟南芥等植物的突变体表型分析、嫁接试验、外源激素处理及基因表达模式等研究,明确抑制植物分枝是独脚金内酯的一个重要功能[65,75]。SLs在植物中起着调节植物的分枝和根系结构、不定根形成、次生长和叶片衰老等作用,同时还协助植物响应营养胁迫和其他非生物胁迫等[76-78]。
3.1 独脚金内酯在植物地上、地下部生长发育的作用
SLs通过刺激丛枝菌根真菌菌丝的分支,建立与丛枝菌根真菌有益共生关系[18]。大约80%的陆地植物与丛枝菌根真菌共生,植物中的碳通过菌丝被交换到真菌中,对于土壤中流动性较低的营养物质如磷酸盐的利用,尤为重要[79-80]。
多种植物的分蘖突变体表现出分枝增加的表型:拟南芥的腋芽生长较多(moreaxillarygrowth,max);豌豆的多分枝(ramosus,rms),;水稻的矮秆(dwarf)/高分蘖矮秆(hightilleringdwarf,htd);矮牵牛花的顶端优势(decreasedapicaldominance,dad)下降。上述研究结果表明存在根源性的向上移动的信号分子,其通过抑制腋芽的生长来决定分枝[56]。SLs生物合成基因的突变体缺乏SLs,具有多分蘖的表型,可通过添加外源SL类似物GR24恢复其表型,如豌豆中的rms1和rms5[1-2,81]。
SLs可正向调节拟南芥的主根长度。SLs通过调节拟南芥生长素的含量来控制初级根系伸长,施用外源GR24可以恢复根的表型,外源GR24的施用可以增加原根的长度[82]。GR24抑制了豌豆的不定根的形成[11]。在生长素信号突变体axr1中,不定根会减少,而max突变体则没有,说明抑制不定根形成需要生长素信号[83]。与拟南芥和豌豆不同,水稻SLs对根伸长有正向调节作用。拟南芥SLs和乙烯协同促进根毛的生长,通过1 个共同的调控途径,此外生长素和SLs通路在调控根毛伸长过程中可能存在相关性[84]。在磷充足的条件下,SLs负调控侧根的形成,SLs缺乏还会导致叶片衰老延迟、根系结构改变和次生长减少[85-86]。因此,SL对植物生长的影响始于根,并因此影响到整个植物的生长,这可能与独脚金内酯调控植物生长以适应环境变化密切相关[87-88]。SLs也可抑制致病真菌的生长,GR24通过调节激素防御途径间接抑制致病真菌的生长[82]。
3.2 对非生物胁迫应答调控
SL通过与细胞分裂素互相作用调控植物响应胁迫,植物通过整合多种激素响应途径来适应环境压力。SL通过基因的调控减少非生物胁迫对作物产量的负面影响。SL和ABA之间存在相互作用,拟南芥max2突变体比野生型植株水分蒸发多,对干旱胁迫敏感,这可能是由于气孔关闭效率低,对ABA敏感性降低所致[76]。与野生型相比,拟南芥max2和max4突变体SLs产量不足,叶片中大量ABA依赖基因和干旱诱导基因表达下调,叶片气孔密度增加,ABA诱导的气孔关闭延迟,突变体对干旱和盐胁迫敏感[4]。
SLs在非生物胁迫的应激反应中发挥着关键的调控作用,且以依赖于ABA和独立的方式发挥作用。GR24的应用可恢复SL缺失突变体的干旱敏感性,也可以提高野生型植物的抗旱性。然而,这与先前的数据存在矛盾,表明SLs在干旱胁迫响应中可能具有不同的调控机制[76]。
3.3 SLs在叶片衰老中的作用
多种植物激素的协同调控叶片的衰老。ABA、茉莉酸和乙烯都能诱导叶片的衰老,而细胞分裂素是抑制叶片衰老的强效因子。SLs也是一类调节叶片衰老的植物激素,在缺乏SL和SL不敏感的突变体中,观察到延迟叶片衰老的表型[89-90]。拟南芥突变体ore9枝条较多,叶片衰老延迟[91],与max2等位[86]。水稻d3突变体也存在叶片衰老延迟的现象。荷花ccd7/max3突变体分枝增加,叶片衰老延迟[92]。此外,在水稻和拟南芥中,应用GR24处理在黑暗中培养的叶片,可以观察到叶片变黄和膜离子泄漏的叶片衰老的迹象[93-94]。在叶片衰老过程中,随着转录水平的升高,SLs的生物合成相关基因MAX1、MAX3和MAX4表达增加,提示SLs在叶片衰老过程中起着重要作用。
3.4 SLs在植物结节形成中的作用
研究表明独脚金内酯在植物结瘤形成中发挥重要的推动作用(特别是在缺氮状态下)[12]。SLs在结瘤过程中主要作为激素发挥作用,而不是作为根际信号分子发挥作用[95-96]。因此,推断SLs是寄生植物的关键识别信号之一。低浓度GR24显著增加了紫花苜蓿根瘤数量[96]。此外,豌豆的独脚金内酯缺陷突变体的结节数减少,施用合成GR24可以增加结节数,GR24能增加紫花苜蓿(alfalfa)、百脉根(Lotusjaponicas)和野生豌豆(pea)的结瘤数量[57,96-97]。豌豆SL缺陷突变体rms1的结节数比野生型少约40%,通过应用外源GR24可获得结节表型的部分恢复。同样,当荷花的SL缺陷突变体减少了约80%的独脚金内酯表达水平,结节数也减少约20%[57]。综上所述,SLs对植物结节的发育具有正向推动作用。然而,与豌豆突变体rms1相比,rms4突变体具有比野生型更多的结节,推测SLs可能在结节形成早期起作用,而不是在结节的器官发生过程中起作用[12]。
4 SLs与其他植物激素的互作
SL的生物合成在转录水平上受反馈机制的负调控,也受其他植物激素的调节,并在植物体内保持激素平衡。与激素互作是SL生物合成的另一个重要决定因素。
4.1 与生长素的相互作用
SLs在生物应激反应中的作用被认为是通过与其他植物激素的相互作用来实现的[21,89,98]。因此,SLs也可以与其他植物激素一样,通过与其他植物激素和环境通路的关联、独立或依赖,调控植物生长发育。
生长素和独脚金内酯之间存在复杂的相互作用,生长素对SLs生物合成有积极的影响,SLs反过来也能影响生长素的生物合成和转运,并调节芽的生长[57,89,99]。外源生长素可以提高分蘖节中D10、D17和D27的表达水平[100],在SL生物合成突变体中显示编码SL生物合成酶的基因转录水平升高,在这种现象MAX1、CCD7、CCD8和LBO转录中都可以检测到[13,32-33,36,60]。反之,外源GR24在拟南芥植株上的应用导致了CCD7和CCD8转录水平的下降[72]。水稻去顶处理后添加IAA可恢复D10基因的表达,而仅去顶处理则降低了D10的表达,说明极性生长素运输流调控了水稻SL的生物合成[67]。
在拟南芥中,SLs通过2 条途径控制芽的生长[101]:一是SLs降低了主茎杆极性生长素运输流的容量;二是SLs通过木质部从根向外运输,通过调节TCP转录因子(BRC1)直接抑制芽的生长。同样,外源GR24处理也降低了水稻幼苗根部PIN家族基因的表达水平,改变了水稻IAA的分布[47]。
拟南芥中TCP转录因子BRC1/BRC2和生长素外运载体PIN1是植物芽的发育过程中可能的SLs信号靶点[14],玉米突变体Brc1的分枝数量比缺SL的突变体少[102],表明BRC1对SLs分枝的独立影响。生长素能通过调控植物SLs 的生物合成过程来调控植物的分蘖,而CCD8基因可能在生长素调控SLs 的过程中起关键作用[67]。
SLs通过调节生长素的转运进而抑制芽的分枝。通过外源GR24的施用抑制了max突变体和野生型木质部薄壁细胞中生长素的转运和PIN1的积累,从而抑制了极性生长素转运流[103]。不同浓度的GR24对生长素转运状态的影响不同,SLs对处理后植株的分枝有不同的作用,使用低浓度的GR24(10 nm)促进茎尖分枝,而高浓度的GR24(0.11 μmol)减少了分枝[99]。
4.2 与脱落酸的交互作用
植物激素可以通过协同调控响应非生物胁迫,如ABA、油菜素内酯(Brassinolide,BRs)和细胞分裂素等[4]。在植物干旱胁迫响应中,植物激素ABA起着基础性作用。ABA水平的升高主要是由于9-顺式环氧类胡萝卜素双加氧酶(NCED)家族活性的增加,该家族可催化ABA合成中的限速步骤。独脚金内酯和ABA都参与了类胡萝卜素裂解,且都来源于1 个共同的底物——类胡萝卜素,因此,独脚金内酯和ABA代谢之间的关联是必然。SL和ABA通路的相互连接可能是通过D27蛋白实现的[46,78]。此外,外源GR24的施用降低了拟南芥种子的ABA水平,从而减少了高温胁迫引起的休眠[104]。同样,SLs降低了ABA水平,促进了锦葵(Phelipancheramose)种子的萌发[42]。在正常或应激条件下,ABA水平不会因SL不敏感而改变[76]。与野生型相比,在干旱胁迫下拟南芥SL缺乏突变体中ABA转运蛋白下调表达[4],而在莲花和番茄的研究中,SL缺乏突变体的叶片在通过叶柄供给外源ABA时间足够长的情况下,与野生型相比,突变体仍有关闭气孔的能力[105-107]。在SLs和转录调控因子之间可能存在一些miRNAs,这些miRNAs被证明也与其他激素有关[108-109]。
SL和ABA之间的交互关系是非生物胁迫耐受的关键,在自然胁迫条件下,利用植物激素信号和代谢调节,可改善作物的生存能力。因此,有必要深入研究在不同胁迫作用下,SL对植物表型的影响,了解生理生化变化和解析调控植物生长的作用机理,验证其是否与ABA的合成通路有关,是否与ABA转运的调节有关,SL和ABA之间的联系存在哪些转录调控基因或蛋白的相互作用,这些都有待进一步解答。
5 展 望
独脚金内酯是作为诱导寄生杂草种子萌发的根分泌物信号而被发现,是一种具有高度结构多样性的植物激素和根际信号化合物,能抑制植物分枝,在调控植物生长发育中起重要作用。独脚金内酯还参与在植物响应逆境、调整自身生长,并得以在环境和群体的竞争中获得优势的过程。在高等植物中,独脚金内酯可能参与调控植物的生长和发育来实现资源分配的平衡。高等植物缺磷会增加独脚金内酯的生物合成,从而改变根系生长,增加磷酸盐的摄取量。
已有研究通过分枝突变体研究分离获得了SL生物合成的关键基因。进一步发现SLs与植物的非生物胁迫响应有关,可以通过SLs提高植物的抗性。然而SLs在植物内的运输机理,以及其在植物发育中的作用,有待深入研究。
研究植物干旱适应机制研究的结果发现CK和SL信号通路之间可能存在相互作用。CK延缓叶片衰老而SL促进叶片衰老,CK和SL途径在控制地上部分和地下部分存在的拮抗作用,表明CK和SL分别具有负调控作用和正调控的作用。未来研究方向可通过获得耐旱CK和耐旱SL信号突变体的抑制突变体,研究2种激素在干旱作用下的生物合成的影响,以及解释2 种激素在干旱条件下的相互作用机制。深入了解CK和SL在干旱胁迫响应中的作用,通过精确的基因组编辑来调节这些通路,有助于更合理、有效的方式设计改良的耐旱作物。
SL被证实与ABA、生长素、GA等都有相互作用,因此阐明其在基因和蛋白水平解析激素间的相互作用其作用机理也是尤为重要,是利用激素提高作物产量的重要依据。

