阿茹拉-7味散早期干预形成的瘤胃微生物环境对感染致病性大肠杆菌犊牛免疫力的影响
贾知锋 王纯洁* 敖日格乐 贺美玲 张 欣 徐 进 吕文亭 付 鹤 任书男 田艳萍 刘佳乐
(1.内蒙古农业大学 兽医学院,呼和浩特 010018;2.内蒙古农业大学 动物科学学院,呼和浩特 010018;3.内蒙古医科大学 基础医学院,呼和浩特 010110)
在现代养牛业中,多种病原菌可导致犊牛腹泻病的发生,其中致病性大肠杆菌(PathogenicEscherichiacoli)占比重较大[1]。大肠杆菌性动物腹泻主要是由肠道炎症引起,常导致犊牛生长发育停歇、免疫力低下、发病率和死亡率较高[2]。研究者发现腹泻多发生于幼龄动物均与瘤胃菌群紊乱有关[3]。瘤胃菌群主要由厚壁菌门、拟杆菌门、梭杆菌门、放线菌门和变形菌门等优势菌群形成生物学屏障,起到保护作用[4]。早期瘤胃菌群的形成是在各方面因素(如环境、母乳和益生菌等)的影响下,才使得犊牛瘤胃提前建立起适应外界环境的稳定状态[5]。目前临床治疗致病性大肠杆菌病首选抗生素,长期使用抗生素显著影响胃肠道菌群多样性,降低药物疗效,出现耐药性和药物残留等问题[6]。因此,研究者开始寻求天然绿色新产品,望其减少抗生素使用。
植物性药物在进入胃肠道后,促进胃肠道内有益菌的定植,从而形成一道天然屏障来抵御外来病原菌的入侵[7]。草药复方具有调节菌群结构和缓解肠道炎症的作用,有望替代抗生素治疗大肠杆菌性动物腹泻[8]。作为蒙医药学重要部分的蒙药,以其纯天然来源和保肝、保肾、抗菌、消炎、滋补、低残留、低毒副作用和耐药性小的作用特点,在当今依然发挥着不可替代的作用[9]。阿茹拉-7味散(又称为古方巴特尔-7)属于经典验方,被《中华人民共和国卫生部药品标准(蒙药分册)》收录,根据其药效学研究发现,该方具有清瘟解毒、镇痛、止痢和提高免疫力等功效[10],因在治疗人类腹泻[9]、消化性溃疡[10]和银霄病[11]等方面有很好的疗效,被广泛应用。然而,阿茹拉-7味散能否提前建立瘤胃菌群环境来抵御致病性E.coli的入侵,并且与抗炎、免疫形成互作尚未有相关研究。因此,本研究选择30头1日龄健康荷斯坦犊牛为试验动物,建立阿茹拉-7味散早期干预形成瘤胃微生物环境的动物模型,在牛奶中添加不同剂量的阿茹拉-7味散,通过16S rRNA测序技术对犊牛瘤胃微生物多样性以及菌落结构组成和丰度进行分析;通过RT-PCR法检测瘤胃中大肠杆菌的含量;通过ELISA法检查血清中IL-6、TNF-α、IL-4、IL-2和IFN-γ的含量,探讨阿茹拉-7味散在早期建立犊牛瘤胃共生益生微生物组和免疫力形成互动的作用机制,为阿茹拉-7味散生产实践应用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1试验动物
选择30头体重相近(30±2 kg)的1日龄健康荷斯坦犊牛,购自山西河滩奶牛育种有限公司。
1.1.2试验材料
牛源致病菌EscherichiacoliO1保存于内蒙古农业大学牛生产学实验室[12];盐酸环丙沙星购自成都新亨药业有限公司;阿茹拉-7味散由诃子、茜草、甘松、翻白草、瞿麦、乳香和草乌叶组成,购自内蒙古呼和浩特市天力药业有限公司;KAPA HiFi HotStart ReadyMIX,购自美国KAPA生物公司;琼脂糖,购自天津基准化学试剂公司;DNA Template Prep Kit 1.0,购自美国太平洋生物学公司;Agilent DNA 12000 Reagents,购自美国安捷伦科技有限公司;DNA Sequencing Bundle 4.0,购自太平洋生物科学公司;ELISA试剂盒购自内蒙古呼和浩特市宝信生物公司。
1.1.3试验仪器
酶标仪(Synergy HT,上海迭戈生物科技有限公司);PCR仪(Biosafer公司,德国)。
1.2 试验方法
1.2.1阿茹拉-7味散的制备
将诃子、茜草、甘松、翻白草、瞿麦、乳香和草乌叶粉碎,过200目筛,再按照3∶2∶2∶2∶1∶2∶2的比例配伍用药[9]。
1.2.2试验动物模型的建立及给药方案
荷斯坦犊牛实验方案均已获得内蒙古农业大学牲畜护理委员会的批准,并按照内蒙古农业大学兽医学院动物伦理委员会的指导方针进行。1周龄犊牛每日4 L牛奶,分别将试验药品混于牛奶中,并于6:30和18:30分别进行人工饲喂。犊牛饲养管理参见文献[13]。
选择30头体重相近1日龄的健康荷斯坦犊牛,随机分成6组,每组5头牛见表1。将各试验药物混于牛奶中给药,先给药4 d,2 次/d,于第5 d早上口服E.coliO1(2.50 × 1011CFU/mL, 100 mL/头)1 h 后再继续给药,未治疗组(Untreated control,UC)、环丙沙星组(Ciprofloxacin,CIP)、阿茹拉低剂量组(Low dose of Baatar seven powder,BSP.L)、阿茹拉中剂量组(Medium dose of Baatar seven powder,BSP.M)和阿茹拉高剂量组(High dose of Baatar seven powder,BSP.H)组犊牛经口服接种致病性E.coliO1建立腹泻模型,对照组(Normal control,NC)犊牛口服无菌生理盐水,其它给药组再继续给药至第7 d,2 次/d。于第7 d末次给药1 h后将犊牛在标准化屠宰场放血致死,同时,用采血管颈静脉采集血液,分离血清,用棉签采集瘤胃内容物装入冻存管放于液氮保存用于后续试验。

表1 试验动物模型的建立及给药方案Table 1 Establishment of experimental animal model and administration plan
1.2.3犊牛血清细胞因子的检测
第7 d末次给药1 h后,通过颈静脉采集犊牛血液,静止1 h后,离心(在4 ℃下3 000 g离心15 min)分离血清,并保存于-20 ℃冰箱。使用ELISA试剂盒测量IL-6、TNF-α、IL-4、IL-2和 IFN-γ 的含量[14]。
1.2.4细菌DNA的提取和16S rRNA基因序列扩增
给药7 d后,将犊牛放血致死,采用QIAamp Fast DNA Stool Mini-Kit试剂盒(根据说明书操作)对犊牛瘤胃内容物提取细菌DNA,经1.0%琼脂糖凝胶电泳和紫外分光光度计检验细菌DNA纯度(OD260/OD280=1.8~2.0)和质量浓度(100 μg/μL),将合格的DNA置于-80 ℃保存。利用PCR对每份样品的DNA进行16S rRNA基因V3+V4区扩增,使用Thermofisher的IonS5TMXL进行上机测序(测序模式为SE600)。正向通用引物为341F(5′-CCTAYGGGRBGCASCAG-3′),反向通用引物为805R(5′-GGACTACNNGGGTATCTAAT-3′)。这对引物被用于扩增细菌16S rRNA基因V3+V4区序列,PCR扩增反应50 μL体系参考[15]:包括10 ng/μL(5 μL)模板DNA、5 μL Taq聚合酶(5 U/μL;TaKaRa,Japan)以及上下游引物各1 μL(10 μmol/L)。使用GeneJET 胶回收试剂盒(Thermo Scientific 公司)回收PCR纯化产物。最后将纯化产物送往北京诺禾致源科技股份有限公司上机测序。利用Qiime软件(Version 1.9.1)分析Alpha多样性[16]。
大肠杆菌检测:将腹泻犊牛瘤胃内容物合格的DNA用荧光定量PCR法检测大肠杆菌O1:K88(引物设计:F:5′-AAGGGAAATGTGGTGAAA-3′;R:5′- CGGTTTCTTCTTGTTAATCG-3′)的含量。反应体系为25 μL:12.5 μL的PCR Master Mix,上下游引物各1.0 μL,DNA模板3.0 μL,7.5 μL ddH2O,PCR程序设置:预变性(92 ℃,45 s),变性(92 ℃,30 s),退火(60 ℃,45 s),延伸(72 ℃,1 min),共40个循环,终端延伸(72 ℃,45 s),终止(4 ℃)[8]。
1.3 数据统计
数据用平均数±标准误表示。采用SPSS 22.0进行方差分析。
2 结果与分析
2.1 犊牛瘤胃内容物细菌菌落Alpha多样性分析
香农指数(Shannon index)、辛普森指数(Simpson index)、Chao1指数和ACE丰富度指数是用于评估物种的多样性和丰富度见表2。给药 7 d 后,与NC组相比,UC组中Shannon 指数,(P=0.114)、(Simpson 指数(P=0.768)和Chao1指数(P=0.053)无显著差异,但ACE指数在UC组中显著降低(P=0.013);与UC组相比,BSP.M组中Chao1指数(P=0.001)、Shannon指数(P=0.023)和ACE指数(P=0.000 1)显著升高;BSP.L组中Shannon 指数、Simpson 指数和ACE指数较UC组显著降低(均为P=0.000 1),BSP.H组中多样性指数无显著性差异(P>0.05);说明BSP.M组的犊牛瘤胃微生物菌群多样性和丰富度较高。结果表明,BSP.M组样品表现出较高水平的细菌生物多样性。

表2 不同剂量的阿茹拉-7味散对犊牛瘤胃微生物Alpha多样性的影响Table 2 Effects of different doses of Baatar-7 powder on calf rumen microbial Alpha diversity
2.2 阿茹拉-7味散早期干预形成的瘤胃微生物对感染致病性大肠杆菌犊牛细菌门、属水平菌群丰度的影响
给药7 d后,为寻找6组之间优势物种的差异,通过Version 3.8.31比对发现,6组样本在门和属水平上平均丰度(存在显著差异)排名前10的物种见表3。在门水平,与NC组相比,UC组中梭杆菌门、变形菌门、放线菌门和梭杆菌属的丰度均极显著升高(P<0.05);在属水平,UC组中拟杆菌属(P=0.975)、柔嫩梭菌属(P=0.926)和毛螺菌球菌属(P=0.234)的丰度较NC组均无显著变化。
与UC组相比,BSP.L、BSP.M和BSP.H组中梭杆菌门和变形菌门的丰度极显著降低(P<0.05),并且BSP.L和BSP.H组中放线菌门的丰度极显著降低(P=0.000 1);BSP.L组中柔嫩梭菌属显著升高(P=0.045),BSP.L(P=0.001)和 BSP.M 组(P=0.001)中毛螺菌球菌属的丰度显著升高(P<0.05)。

表3 不同剂量的阿茹拉-7味散对犊牛瘤胃微生物丰度的影响Table 3 Effects of different doses of Baatar-7 powder on the rumen microbial structure of calves %
2.3 阿茹拉-7味散早期干预形成的瘤胃微生物对感染致病性大肠杆菌犊牛瘤胃中大肠杆菌含量的影响
通过RT-PCR定量分析犊牛瘤胃中大肠杆菌的含量见表4。给药7 d后,与NC组相比,UC组中大肠杆菌的含量显著升高(P=0.000 1);与UC组相比,BSP.L(P=0.004)、BSP.M(P=0.002)和BSP.H组(P=0.001)中大肠杆菌的含量显著下降(P<0.05);与CIP组相比,BSP.M(P=0.070)和BSP.H组(P=0.101)中大肠杆菌的含量无显著差异,说明BSP.M和BSP.H组可降低大肠杆菌的水平,并与CIP相当。

表4 不同剂量的阿茹拉-7味散对犊牛瘤胃中大肠杆菌含量的影响Table 4 Effects of different doses of Baatar-7 powder on the content ofE.coli in the rumen of calves lgCFU/g
2.4 阿茹拉-7味散早期干预形成的瘤胃微生物对感染致病性大肠杆菌犊牛腹泻率、体重以及平均日增重的影响
阿茹拉-7味散对腹泻犊牛腹泻率的影响见图1(a)。给药7 d后,NC组无腹泻;UC组犊牛腹泻率达80%;各用药组使犊牛腹泻率急剧下降;BSP.M和BSP.H组犊牛腹泻率与CIP相同,下降到20%,说明BSP可降低犊牛感染致病性E.coli引起腹泻发生的风险。
阿茹拉-7味散早期干预形成的瘤胃微生物对大肠杆菌性犊牛体重增加的影响见图1(b),给药第0 d,各试验组之间新生犊牛体重差异不显著(P>0.05);给药7 d后,与NC组相比,UC组犊牛体重(P=0.021,图1(c))和日增重(P=0.002,图1(d))显著降低(P<0.05);与UC组相比,BSP.M和BSP.H组犊牛体重和日增重显著升高(均为P=0.001,P<0.05),说明饲喂BSP.M和BSP.H可维持腹泻犊牛体重,有利于日增重增加。

在相同的直方图中,具有相同小字母上标的值均无显著性差异(P>0.05),而具有不同小写字母上标的值均具有显著性差异(P<0.05)。The values with the same letter superscripts mean no significant difference (P>0.05), while values with different letter superscripts mean significant difference (P<0.05).图1 不同组别的犊牛腹泻率、体重以及平均日增重Fig.1 The effect of different groups on diarrhea rate,weight gain and average daily gain of diarrhea calves
2.5 阿茹拉-7味散对感染致病性E.coli O1犊牛血清中免疫细胞因子的影响
阿茹拉-7味散对犊牛血清中抗炎、免疫细胞因子的影响见表5,给药7 d后,与NC组相比,UC组血清中IL-4(P=0.007)、IL-2(P=0.000 1)和IFN-γ(P=0.021)的含量显著下降,但TNF-α(P=0.010)的含量显著升高;与UC组相比,BSP.M组血清中IL-4的含量显著升高(P=0.006),并与NC(P=0.982)和CIP组(P=0.421)持平;BSP.L、BSP.M和BSP.H组血清中IL-2和IFN-γ的含量显著升高(均P<0.05);BSP.M和BSP.H组中IL-6和TNF-α的含量显著降低(均P<0.05),说明BSP可防止炎症的发生,调节抗炎、免疫因子的表达,增强机体免疫力。
3 讨 论
已有研究表明致病性大肠杆菌是引起犊牛腹泻最主要的致病菌[2]。植物性药物通过调节肠道微生物可减轻葡聚糖硫酸钠诱导的小鼠结肠炎[17],因此,植物性药物具有抑菌、杀菌、消炎、提高免疫力和改善胃肠道菌群等多种功能[4]。基于植物性药物是多靶点、多水平的作用药物,通过饲料中添加不同剂量的藤黄提取物(藤黄素)对腹泻仔猪研究发现,藤黄素中、高剂量组中Shannon指数、Simpson指数和Chao1指数显著高于对照组,并且中剂量组在调节肠道菌群多样性方面效果优于高剂量组[16]。因此,筛选出最佳剂量的植物性药物对临床用药具有指导意义。本研究中,与UC组和阿茹拉-7味散高剂量药物相比, BSP.M组多样性指数(Shannon指数和ACE指数)显著升高,说明阿茹拉-7味散中剂量药物瘤胃微生物丰富度和多样性高于UC组和中剂量药物,本研究与Wang等[16]试验结果一致。
出生3日龄的犊牛瘤胃中优势菌门主要为拟杆菌门,有利于降解非纤维物质,而成年反刍动物瘤胃中优势菌门主要为厚壁菌门,可降解纤维物质;随着犊牛的成长,犊牛瘤胃中拟杆菌门数量逐渐减少,厚壁菌门数量逐渐增加[18]。本研究中,与UC和CIP组相比,BSP.L和BSP.M组犊牛瘤胃内厚壁菌门细菌显著升高,拟杆菌门显著降低,这说明饲喂阿茹拉-7味散改变犊牛瘤胃微生物结构可能有利于提前建立适应日粮的转化。多数梭杆菌门内的细菌是条件致病菌,而变形菌门包含大肠杆菌,多数为致病菌,易造成动物机体损伤,炎症加重[19]。本研究中,不同剂量的BSP可显著降低犊牛瘤胃内梭杆菌门、变形菌门和大肠杆菌数量,并与抗生素组相当,这说明饲喂阿茹拉-7味散具有抑制致病菌生长的作用,有望减少抗生素的使用。
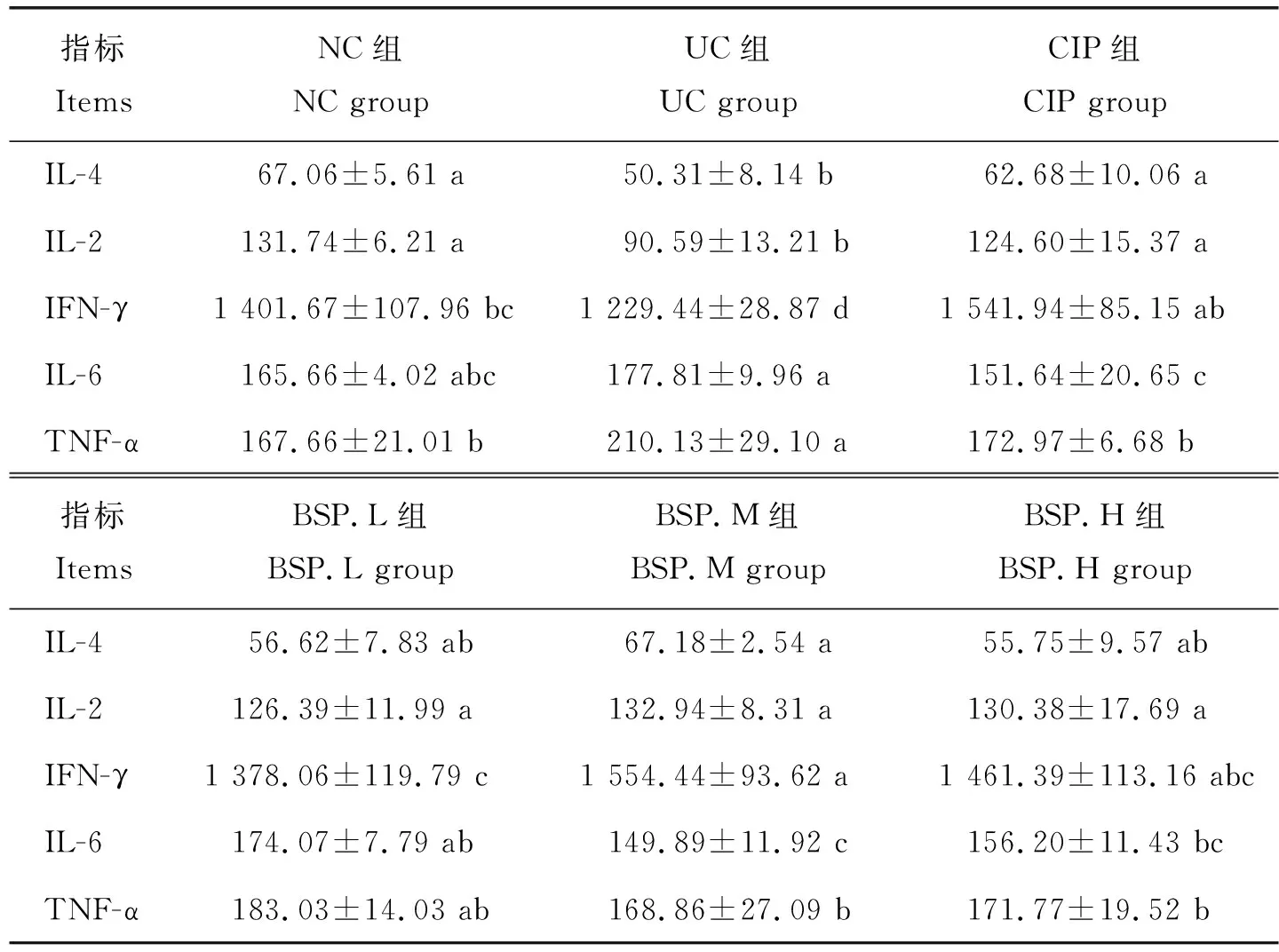
表5 不同剂量的阿茹拉-7味散对犊牛血清免疫细胞因子的影响Table 5 Effects of Baatar-7 powder on immune cytokines in calves pg/mL
在内热证中厚壁菌门丰度降低,拟杆菌门的丰度升高,一些清热证复方使拟杆菌门的丰度显著降低[20]。灵芝菌丝体水提物可通过降低变形菌门的丰度保护肠道损伤,逆转菌群结构紊乱,减少 TNF-α 和IL-6的产生,炎症减轻[21],因此可将变形菌门和大肠杆菌作为疾病微生物信号指标。梭杆菌门包含多种致病菌(如产气荚膜梭菌),产气荚膜梭菌对动物具有很大的毒性,可破坏肠黏膜结构[22]。本研究中,与UC组相比,BSP可显著增加犊牛血清中IL-2和IFN-γ的含量以及增加瘤胃微生物厚壁菌门的丰度;BSP.M和BSP.H组显著降低IL-6、TNF-α的含量和显著降低梭杆菌门和变形菌门的丰度,这说明饲喂BSP可通过增加厚壁菌门的细菌,抑制梭杆菌门和变形菌门细菌的生长有利于预防炎症的发生。
舒迎霜等[19]发现黄芪总皂苷使结肠炎模型动物肠道中柔嫩梭菌属和毛螺菌球菌属增加,降低梭杆菌属和大肠杆菌的含量,降低肠道炎症,从而起到保护肠道的作用。Yan等[23]研究发现,黄芪多糖通过降低梭杆菌属的丰度,从而增加了抗炎(如IL-2、IFN-γ和IL-4等)水平。在本研究中,UC随着BSP.L和BSP.M组犊牛瘤胃内毛螺菌球菌属和柔嫩梭菌属数量的升高,梭杆菌属和大肠杆菌数量的降低,TNF-α和IL-6的产生减少,从这些结果推测阿茹拉-7味散可提前建立有益菌来避免致病菌直接与肠壁接触,增强了IL-2、IFN-γ和IL-4的表达,减少炎症发生,提高了免疫力,促进了体重增加,最终达到降低腹泻的目的。
近年来,饲料安全问题备受关注,纯天然、无公害、无抗生素残留和功能全面的草药成为国内外研究的热点。在畜禽养殖业中,抗生素大量、广泛使用,迅速形成多种抗生素耐药的大量菌株,降低药物疗效。该方是一种以纯天然植物为原料,具有很强的保肝、保肾、抗菌、消炎、滋补、低残留、低毒副作用、耐药性小、调节胃肠道菌群和提高免疫力的作用特点。本研究表明,阿茹拉-7味散早期干预建立的瘤胃微生物环境在一定程度上可使感染致病性E.coliO1犊牛瘤胃内菌群数量增多,多样性升高,且阿茹拉-7味散可使瘤胃内菌群结构发生变化,益生菌所占比例增加,条件致病菌水平下降,提高其抗炎、免疫机能,增强动物机体免疫功能,从而降低腹泻发生率。本研究为进一步开发利用植物性药物来改善感染大肠杆菌犊牛腹泻,提高机体抗炎、免疫和胃肠道菌群的功能提供了基础,并为植物性药物的生物学效应及其作为功能性饲料添加剂的潜力提供了理论基础和实验数据。

