麻佛微素对小鼠微核和精子畸形的影响
袁曦 白雪
摘要:通过小鼠微核试验和精子畸形试验评价麻佛微素的致突变性。两个试验分别将小鼠分为4个处理组,实验组按1倍和2倍治疗量分别灌胃,阴性组生理盐水灌胃,阳性用环磷酰胺灌胃。微核试验每组7只小鼠,连续给药2天,时间间隔24 h,于第2 次染毒后6 h将小鼠脱颈椎处死,制骨髓涂片,观察。精子畸形试验每组8只小鼠连续给药5天,于第1次给药后的第35天,采用脱颈椎法处死小鼠,制精子涂片,观察。结果显示,小鼠微核试验实验组和阴性组比较微核率差异不显著(P>0.05),与阳性组比较差异极显著(P<0.01),精子畸形试验实验组和阴性组比较精子畸形率差异不显著(P>0.05),与阳性组比较差异极显著(P<0.01)。上述结果表明,麻佛微素在本实验剂量范围内用微核试验和精子畸形试验评价无致突变作用。
关键词:麻佛微素;微核试验;精子畸形试验;致突变性
麻佛微素是新一代氟喹诺酮类抗菌药,其主要成分为马波沙星(Marbofloxacin),由法国威隆公司生产,为人工合成,主要用于犬、猫等伴侣动物。该药对多种感染有很好的疗效,以抑制DNA螺旋酶方式产生作用,能有效杀死革兰氏阳性菌(特别是葡萄球菌和链球菌等)及革兰氏阴性菌(如大肠杆菌、霍乱杆菌和绿脓杆菌等)。内服和注射给药后吸收快且完全,体内分布廣,生物利用度高。但随着人们对伴侣动物的重视度越来越高,伴侣动物的药物安全性也越来越重要。据报道,培氟沙星可引起精子畸变率增高和睾丸萎缩,氧氟沙星能引起哺乳动物胎儿死亡率增加,这些都提示人们对氟喹诺酮类药物的安全性要引起重视。
为评定某药的安全性而进行的各种毒性试验,称为安全试验。安全试验主要分为两类:第一类为一般毒性试验,包括急性、亚慢性和慢性毒性试验等;第二类为特殊毒性试验,如繁殖试验、致突变试验、致畸试验、致癌试验和迟发性神经性试验等。在致突变试验中,小鼠骨髓嗜多染红细胞微核试验主要是对染色体结构完整性的改变进行评估,是检测外来化合物对染色体损伤作用的重要试验;小鼠精子畸形试验是对已知的生殖细胞致突变物具有高度的敏感性,它已被公认为检测受试物对生殖细胞致突变作用的一种标准的体内试验方法。
到目前为止,有关麻佛微素致突变性和致畸性方面的研究报道很少。本文选择微核试验和致畸试验,研究麻佛微素的致突变性,旨在确定是否存在致突变毒性,选择小鼠来进行微核试验和精子致畸实验,从致突变性方面进行相关的研究和分析,以确定麻佛微素是否具有致突变的作用,为临床上使用该药提供科学依据。
一、材料和方法
(1)药物 麻佛微素 (Marbocyl)规格:80mg/片,法国威隆公司生产。
(2)实验动物 小鼠60只,由四川农业大学隆鼠家园提供。小鼠饲料由雅安市雨城区华森饲料提供。
(3)试验器材 手术刀、手术剪、无齿镊、小型止血钳、干净纱布、带橡皮头吸管、晾片架、酒精灯、记号笔、玻璃染色缸、1 ml 注射器及针头、载玻片、定时钟、烧杯,试管等。
(4)其他用品 小牛血清(采集健康牛血液离心制成)、环磷酰胺(200mg/瓶,江苏恒瑞医药股份有限公司生产)、姬姆萨氏染色液,伊红染色液(四川农业大学兽医院提供)、生物显微镜(四川农业大学兽医院产科实验室提供)甲醇(分析纯)、甘油(分析纯)、生理盐水、蒸馏水等。
二、试验
(一)微核试验
(1)剂量及分组:选用体重20 - 25g的小鼠 28只雌雄各半,随机分为4组,每组7只,设阴性对照组、阳性对照组各一和两个剂量组,连续给药2天,间隔时间为24 h.其中阳性对照组采用环磷酰胺40mg/kg腹腔注射。2 个剂量组分别按临床治疗量的1、2 倍剂量进行。将药品用生理盐水分别稀释成1mg/ml,2mg/ml。两个剂量组按0.28ml/20g剂量将两种稀释药品经口灌胃给药(麻佛微素为犬猫宠物专用药,需要把用药量换算成小鼠的剂量。采用动物剂量换算公式Da = Db×Rab 符号Da ,Db 分别是犬和小鼠公斤体重剂量mg·kg- 1;Rab是由犬到小鼠的换算系数)。阴性对照组用生理盐水灌胃,操作方法与灌胃体积同试验组。
(2)骨髓细胞液的制备:于第2 次染毒后6 h 将小鼠脱颈处死,取小鼠两侧股骨,剔去肌肉,用滤纸或纱布擦去血污和肌肉碎片,剪去股骨两端,用注射器吸取小牛血0.05ml反复冲洗骨髓腔数次。
(3)涂片:将冲洗液滴在载玻片上推片。每个股骨推片2张,自然干燥。
(4)固定:在干燥的玻片上滴加1滴甲醇,自然干燥。
(5)染色:将固定好的涂片用姬姆萨氏染色25min,用蒸馏水冲洗干净,干燥备检。
(6)镜检:嗜多染红细胞(PCE)呈灰蓝色,成熟正染红细胞呈红色。每只小鼠计数1000个嗜多染红细胞中含微核的嗜多染红细胞数,计算微核率(‰)。测完后,取其平均值,在一个细胞中出现两个或多个微核,仍按一个微核细胞计算。微核率按下式计算,并以千分率表示:
(二)精子畸形试验
(1)剂量及分组:选用体重20 - 25g的雄性小鼠32只,随机分为4组,每组8只,设阴性对照组、阳性对照组各一和两个剂量组,连续给药5天。阳性对照组采用环磷酰胺40mg/kg腹腔注射。2个剂量组分别按临床治疗量的1、2 倍剂量进行。将药品用生理盐水分别稀释成1mg/ml,2mg/ml。两个剂量组按0.28ml/20g剂量将两种稀释药品经口灌胃给药(麻佛微素为犬猫宠物专用药,需要把用药量换算成小鼠的剂量。采用动物剂量换算公式Da = Db×Rab 符号Da ,Db 分别是犬和小鼠公斤体重剂量mg· kg- 1;Rab是由犬到小鼠的换算系数)。阴性对照组用生理盐水灌胃,操作方法与灌胃体积同试验组。
(2)试验方法:于第1次给药后的第35天,采用脱颈法处死小鼠,取出二侧副睾,放入盛有2ml生理盐水的平皿中。用眼科剪将副睾剪碎,静止3 - 5min后轻轻摇动。用四层擦镜纸滤去组织碎片。滤液以1000 - 1500 r/min离心5min,去除大部分上清液,剩约0.5ml液体与沉淀物摇匀后,用滴管吸取1滴将其滴于洁净的载玻片上,涂片,每只小鼠涂2张玻片,在空气中干燥后,用甲醇固定5min。干燥后用2%伊红染色1h,用蒸馏水轻冲,干燥备检。
计数1000个精子中的畸形精子数,主要观察以下畸形类型:无钩、香蕉型、无定型、胖头、尾折、双头、双尾取其平均值,精子畸形率按下式计算:
(三)统计学方法
每个剂量组之间,剂量组与相应的阴性,阳性对照组进行统计方法比较,用生物统计中的T检验处理数据。
三、结果与分析
(一)微核试验
由微核率统计可知,麻佛微素两个剂量组与阴性对照组比较差异不显著(P > 0. 05),两个剂量组之间比较差异不显著(P >0. 05);两个剂量组、阴性对照組与阳性对照组比较差异极显著(P < 0. 01)。结果见表1。
微核见图1-2:
(二)精子畸形试验
由精子畸形率统计可知,麻佛微素两个剂量组与阴性对照组比较差异不显著(P > 0. 05);两个剂量组之间比较差异不显著(P >0. 05);两个剂量组、阴性对照组与阳性对照组比较差异极显著(P < 0. 01)。结果见表2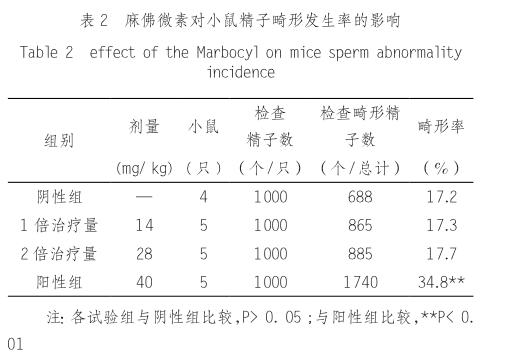
精子畸形包括尾折叠,无定形,无钩,香蕉形,胖头,双头,双尾等
见图3-10: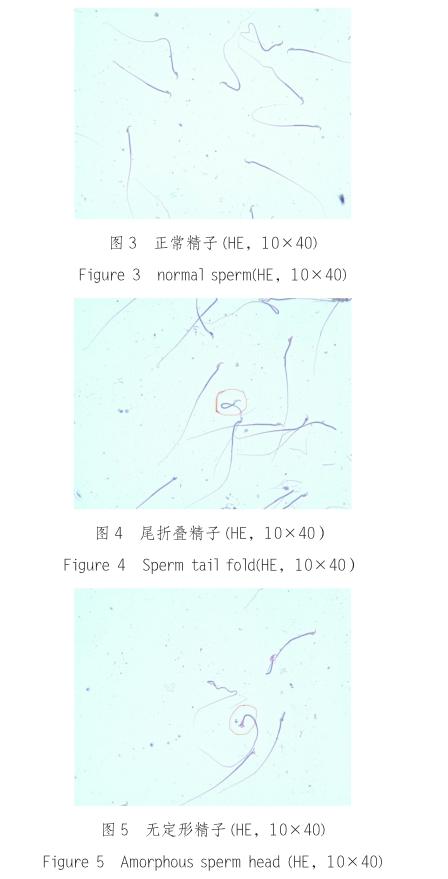

四、讨论与结论
新药的特殊毒性试验包括致突变试验和致畸试验,致突变试验包括体外Ames试验,哺乳动物培养细胞(CHO、CHL)染色体畸变和体内微核试验,精子畸形试验,小鼠睾丸精原细胞染色体畸变试验,显性致死试验。
在致突变试验中,小鼠骨髓嗜多染红细胞微核试验主要是对染色体结构完整性的改变进行评估,微核试验通过检测哺乳动物骨髓细胞中嗜多染红细胞的微核率,间接反映骨髓细胞染色体畸变发生率的高低,从而判断受试动物是否具有致突变作用。小鼠微核试验是目前检测化学物质导致染色体损伤的方便快速的方法。
微核试验具有经济、简便、快速的优点,是检测外来化合物对染色体损伤作用的重要试验,是检测染色体或有丝分裂器损伤的一种遗传毒性试验方法。无着丝粒的染色体片段或因纺锤体受损而丢失的整个染色体,在细胞分裂后期仍留在子细胞的胞质内成为微核。于显微镜下计数PCE中的微核。如果与对照组比较,处理组PCE微核率有统计学意义的增加,并有剂量-反应关系,则可认为该受试物是哺乳动物体细胞的致突变物。
精子畸形是决定精子形成的基因发生突变的结果。常染色体和Y-性连锁基因突变及某些染色体重排,如性-常染色体易位,也可使精子发生畸形。小鼠精子畸形试验能评价受试物对精子生成、发育的影响,可检测受试物在体内对生殖细胞的遗传毒性作用。小鼠精子畸形试验是对已知的生殖细胞致突变物具有高度的敏感性,它已被公认为检测受试物对生殖细胞致突变作用的一种标准的体内试验方法。此两种方法是对药物进行毒理学评价中很好的体内试验项目。
在微核试验中,麻佛微素剂量组中有微核出现,但各剂量组与阴性对照组比较差异不显著,各剂量组之间比较差异也不显著,且各剂量组、阴性组与阳性组比较差异显著。说明麻佛微素对小鼠骨髓细胞染色体无致畸变作用。
在精子畸形试验中,麻佛微素剂量组中有畸形精子出现,但各剂量组与阴性对照组比较差异不显著,各剂量组之间比较差异也不显著,且各剂量组、阴性组与阳性组比较差异显著。说明麻佛微素对雄性小鼠的精子无致畸变作用。
化学物质的致突变性与其致癌性密切相关。有些与麻佛微素同属氟喹诺酮类药物如培氟沙星可引起精子畸变率增高和睾丸萎缩,氧氟沙星能引起哺乳动物胎儿死亡率增加,已经显示出一定的致突变性。据沈建中等报道,马波沙星对哺乳动物体细胞和生殖细胞无致突变性。本文选择了微核试验和精子畸形试验观察麻佛微素对哺乳动物体细胞,生殖细胞的致突变性(染色体突变)。试验结果认为,麻佛微素对哺乳动物体细胞和生殖细胞无致突变性。与沈建中报道的结论相符合。
综上所述,麻佛微素不具有致突变性,不存在遗传毒性,是一种安全的新一代氟喹诺酮类抗菌药,可以在临床上安全使用该药。
参考文献:
[1] 王志强,陈杖榴.动物专用氟喹诺酮类抗菌新药—麻保沙星[J].中兽医药杂志,2001(04).
[2] Eyett Burton C. Marbofloxacln:an advanced fluoroquinolone for use in beef and dairy cattle[J].Cattleprac-tice ,1997(4).
[3] 邱银生,吴佳.动物专用氟喹诺酮类药物研究进展简介[J].中国兽药杂志,1998(03).
[4] 唐雪蓮,佟恒敏.喹诺酮类药物研究进展及在兽医临床的应用问题[J].黑龙江畜牧兽医,2001(03).
[5] 朱蓓蕾主编.动物性食品药物残留[M].上海科学技术出版社,1994.
[6] 王昱,朱宇熹.微核的研究及应用[J].重庆医学,2003(05).
[7] 沈建中主编.动物毒理学[M].北京:中国农业出版社,2002.
[8] 黄幸纾,陈星若.环境化学物致突变、致畸、致癌试验方法[M].浙江科学技术出版社,1985.
[9] 沈建忠,肖希龙,张素霞,等.马波沙星的致突变性和致畸性研究[J].畜牧兽医学报,2003(03).
[10]李洪龙,胡闯,王智航,等.中药肠宁Ⅱ对小鼠的精子畸形试验和微核试验[J].中国兽医杂志,2008(08).
[11] 关立增,鞠玉琳.中药“壮阳促孕散”对小白鼠微核和精子畸形试验的研究[J].延边大学农学学报,2005(04).
[12] 李湘鸣,陈秀云,周华珠,等.莱克多巴胺的微核与精子畸形试验评价[J].卫生毒理学杂志,2003.
[13] 黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004(09).
[14] 徐淑云,卞如潦,陈修.药理实验方法[M ].北京:人民卫生出版社,2001.
[15] Chapin E Robert. Method in Toxicology (Part A),Male Repro-ductive Toxicology[M].Academic Pr,1993.
[16] 明道绪主编.生物统计附实验设计[M].北京.中国农业出版社,2002.
[17] 李大军,权伍荣.过氧化氢对小鼠骨髓微核率和孕鼠胚胎着床及生长的影响[J].吉林农业大学学报,2007(06).
[18] 孙立魁,黄经春,朱雪涛.用小鼠精子畸形试验评价正海生物膜遗传毒性的研究[J].医学检验与临床,2006(02).
[19] 于增杰,聂芳红,陈进军.千里光提取物的小鼠精子畸形试验[J].中兽医医药杂志,2007(02).

