加速康复外科在内镜辅助腰椎融合术中的应用研究*
赵廷潇 张骏 周乾坤 邵海宇 金梦然 刘建文 陈锦平 黄亚增**
(1.蚌埠医学院研究生院,安徽蚌埠 233000;2.浙江省人民医院骨科,杭州 310014)
腰椎退行性疾病(lumbar degenerative diseases,LDD)是由于腰椎自然老化、退变等原因引起的临床常见病和多发病,通常会引起机械性下腰痛、下肢放射痛及间歇性跛行等症状[1]。随着人口老龄化加剧,LDD 的发病率逐年增加,成为影响老年人群生活质量的最常见原因之一[2]。腰椎椎体间融合术(lumbar interbody fusion,LIF)是治疗LDD的有效术式之一,具有减轻疼痛、恢复椎间隙高度、固定不稳定节段、恢复腰椎生理前凸、促进功能恢复和提高生活质量的作用[3,4]。近年来,随着经皮脊柱内镜技术及微创器械的不断完善和发展,国内外脊柱外科医师努力探索并逐步实现了经皮脊柱内镜辅助下腰椎减压融合术(percutaneous transforaminal endoscope-assisted lumbar interbody fusion,PT-Endo-LIF)[5,6]。虽然该术式在临床上被广泛应用并取得良好的治疗效果,但围手术期干预领域仍采用传统干预模式,因其缺乏循证医学依据而存在一系列问题,不利于患者术后康复。
加速康复外科(enhanced recovery after surgery,ERAS)最早由丹麦学者于20 世纪90 年代提出,随后不断优化和完善[7]。ERAS 是一系列基于循证医学证据支持的多学科、多模式的围手术期有效优化处理措施,减轻手术患者在治疗过程中的生理及心理创伤应激,以达到改善手术疗效、减少并发症、缩短住院时间、提高生活质量,加速患者康复的目的[8-10]。2017 年我国在脊柱外科领域成立ERAS 专家组并提出相关共识,体现了围手术期ERAS 干预模式在脊柱外科领域得到高度重视[11]。通过围手术期ERAS干预模式,规范脊柱手术患者的诊疗过程,提高临床疗效,改善远期预后,加速患者康复。
目前,ERAS 在PT-Endo-LIF 手术中的应用研究相对较少,在提高临床疗效、减少围手术期并发症、缩短住院时间及加速康复等方面尚无相关文献报道。本研究探讨ERAS 在PT-Endo-LIF 手术治疗LDD患者中的应用效果。
1 资料与方法
1.1 纳入与排除标准
纳入标准:①轻度腰椎滑脱(Meyerding Ⅰ、Ⅱ级),巨大椎间盘突出(极外侧型及游离脱垂型),腰椎退变伴有不稳定,腰椎间盘突出术后复发以及邻椎病;②经过系统保守治疗6 个月无效;③手术节段位于L2~L5;④单节段手术;⑤所有患者均进行≥12个月的随访。排除标准:①严重中央型椎管狭窄者;②重度腰椎滑脱(Meyerding Ⅲ~Ⅴ级)者;③严重退行性脊柱畸形(Berjano Ⅲ、Ⅳ型)者;③椎间隙过高(≥13 mm)或过窄(≤4 mm)者;④L5/S1 节段病变者;⑤合并严重骨质疏松症(T<3.5)、脊柱骨折、肿瘤、结核、感染等病变,不宜行PT-Endo-LIF治疗的患者。
根据上述纳入与排除标准,前瞻性纳入2017 年10 月至2019 年2 月采用PT-Endo-LIF 手术治 疗单节段LDD 患者90 例,按照随机数字表分为对照组45例,对患者围手术期采取传统干预模式;ERAS 组45例,对患者围手术期采取ERAS 干预模式。两组患者的性别、年龄、体重指数、术前诊断及手术节段等一般资料比较,差异无统计学意义(P<0.05,表1)。
本研究经医院伦理委员会批准通过,所有纳入患者均签署相关知情同意书。
1.2 手术方法
患者硬膜外感觉-运动分离麻醉满意后,留置硬膜外麻醉管。取俯卧位,腹部悬空,双上肢置于头侧舒适体位。常规消毒铺巾,透视定位,10 mg/ml 利多卡因行穿刺点皮肤及穿刺路径软组织局部浸润麻醉,应用杨氏椎间孔镜系统(Yeung endoscopic spine system,YESS)进行穿刺。置入导丝,拔除穿刺针,以导丝为中心横向切开皮肤(长度1 cm),置入导棒及四级导管,以各级骨钻磨除上关节突腹侧上部部分骨质,行椎间孔后下方扩大成形并进入椎管内减压。置入工作套筒,接内镜光源,连续适当压力冲洗液体(生理盐水3000 ml 加入肾上腺素1 mg),切除部分黄韧带、后纵韧带及椎间盘髓核组织,充分进行责任神经根减压。在可视化内镜监视下,将导棒置入椎间隙,确认位置良好,逐级导管扩张后置入工作套筒,透视确认工作套筒与椎间隙方向相同,且侧位透视示套筒在椎体后1/4,置入可旋转膨胀扩张的铰刀,再次腰椎正侧位透视确认铰刀位于椎间隙内合适安全位置(与椎体后缘约成45°),旋转并逐步扩张铰刀,横行微调工作套筒方向使之尽可能多地去除该轨迹上的软骨终板及髓核,以逐级扩张的刮匙再次处理软骨终板,并在椎间孔镜下确认拟植骨的骨性终板区域条件良好、面积足够。于一侧下位椎弓根拟行经皮螺钉内固定处,以10 mg/ml利多卡因行局部浸润麻醉,行1 cm 左右纵向切口,以10 mg/ml 利多卡因向髂后上棘方向行多点局部浸润麻醉,经皮下隧道以环锯取足量自体髂骨备用,用骨蜡及止血材料封闭取骨面进行止血,取骨过程中根据患者疼痛情况调整硬膜外麻醉剂量。将足量自体骨通过工作套筒植入椎间隙夯实,置入合适高度可膨胀椎间融合器(置入方向尽量避开植骨区域而居于植骨区域的腹侧),透视见椎间融合器尾端低于椎体后缘至少5 mm,予以扩张椎间融合器至膨胀满意,再次透视见椎间融合器位置良好,椎间支撑满意。于拟行经皮椎弓根螺钉固定的椎弓根体表投影处,以10 mg/ml利多卡因行软组织及关节突关节处多点局部浸润麻醉,置入椎弓根螺钉及连接棒,透视见钉棒系统位置良好,固定满意,再次置入椎间孔镜,探查椎管内神经根及硬膜囊,清理碎屑,确认减压充分及神经根和硬膜囊搏动良好,撤除内镜及工作套筒。冲洗手术切口,予以缝合手术切口。该微创融合手术对软组织及正常解剖结构损伤小,不需要留置引流。

表1 两组一般资料比较
1.3 围手术期干预措施
记录两组患者的手术时间、术中出血量、术后卧床时间、围手术期并发症、住院时间等指标。
对照组予以脊柱外科围手术期常规干预模式,ERAS组行ERAS干预模式(表2)。出院标准:①手术切口愈合良好,无明显红肿、渗出等感染迹象;②能够在坚固支具或腰围保护下下地行走。
1.4 评价指标
采用疼痛视觉模拟评分(visual analogue scale,VAS)、日本骨科协会评估治疗评分(Japanese Orthopaedic Association scores,JOA)和Oswestry 功能障碍指数(Oswestry disability index,ODI)评估术前、术后的疼痛程度及腰椎功能状态[12-14]。采用改良Bridwell 分级标准,评估患者影像学融合率。采用改良MacNab标准和Likert量表(5分为非常满意,0分为非常不满意)分别评估患者手术治疗效果及患者满意度[15-17]。
1.5 统计学方法
采用SPSS 21.0软件进行统计学分析,计量资料以均数±标准差表示,两组间比较采用独立样本t检验;计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 手术情况比较
两组手术时间及术中出血量比较,差异无统计学意义(P>0.05,表3)。ERAS 组术后卧床时间为(7.9±1.9)h,住院时间为(5.5±2.0)d,均低于对照组的(16.2±3.5)h 和(7.6±1.8)d,差异有统计学意义(P<0.05,表3)。
2.2 VAS、JOA和ODI评分比较
两组术前VAS、JOA 及ODI 评分比较,差异无统计学意义(P>0.05,表4)。ERAS 组术后3 d 及术后1个月的VAS、JOA 及ODI 评分均优于对照组,差异有统计学意义(P<0.05,表4)。
2.3 患者满意度及临床疗效优良率比较
按照Likert 量表评价两组患者对临床疗效的满意度,ERAS 组在术后3 d、术后1 个月及末次随访时的满意度均优于对照组,差异有统计学意义(P<0.05,表5)。末次随访时,按照改良MacNab 标准,ERAS 组中优40 例、良4 例、可1 例,优良率为97.8%;对照组中优37例、良3例、可5例,优良率为91.1%,差异无统计学意义(P>0.05)。
2.4 围手术期并发症及影像学融合率比较
所有患者术中均无手术节段定位错误、血管神经损伤、硬膜囊撕裂、神经根撕裂,术后无椎间隙感染、脑脊液漏等严重并发症。ERAS 组中2 例(4.4%)出现术后并发症,包括1例术后出现对侧神经根性症状,1 例术后出现经皮螺钉置入相关神经症状;对照组中8 例出现术后并发症,包括1 例术后手术切口感染,1例术后出现对侧神经根性症状,3例取髂骨区疼痛,3 例腰背肌无力。上述患者经对症治疗后症状均完全缓解。
按照改良Bridwell分级,末次随访时ERAS组Ⅰ级愈合43例,Ⅱ级愈合2例;对照组Ⅰ级愈合42例,Ⅱ级愈合3例。所有病例全部融合,融合率为100%。
3 讨论
目前开展的LIF 有多种类型,包括后路腰椎椎体间融合术(posterior lumbar interbody fusion,PLIF)、经椎间孔腰椎椎体间融合术(transforaminal lumbar interbody fusion,TLIF)、微创-TLIF(minimal invasive surgery-TLIF,MIS-TLIF)、前路腰椎椎体间融合术(ante-rior lumbar interbody Fusion,ALIF)、侧入路腰椎椎体间融合术(lateral lumbar interbody fusion,LLIF)等[18-21]。在这些术式中,尽管PLIF 和TLIF 可进行直接广泛的后路神经减压并为责任节段提供稳定性,但同时存在创伤大、术中失血量多、正常解剖结构破坏多的问题,导致术后腰背部疼痛及恢复时间延长等[22]。因此,脊柱外科医师尝试使用各种类型的微创手术方式治疗LDD,包括ALIF、LLIF、MIS-TILF 等,这些手术致力于将对正常解剖结构的破坏降至最低[23-25]。

表2 对照组和ERAS组围手术期干预措施
表3 两组手术情况比较()

表3 两组手术情况比较()
近年来,随着内镜技术及微创器械的不断完善和发展,PT-Endo-LIF技术使得LDD的治疗进入到可视化及微创化的治疗模式。Osman[26]最早报道60 例LDD 患者接受PT-Endo-LIF 治疗,并进行平均12 个月的随访,椎间融合率为59.6%,且4.2%的患者出现钉道松动,2%的患者残留下肢麻木,13%的患者残留腰背部活动受限。其融合率较低的原因可能与其未植入椎间融合器及自体骨有关。Lee 等[6]报道了接受PT-Endo-LIF治疗的18例LDD患者至少1年的随访,椎间融合率为88.8%,且5 例出现椎间融合器翼的断裂,1例出现椎间融合器移位。融合器断裂、移位以及融合率相对较低的原因可能与其未植入自体骨及未采用后路钉棒系统固定相关。本研究采用PT-Endo-LIF 治疗LDD 时,均采用可膨胀椎间融合器、自体骨植入及后路经皮钉棒系统固定,以提高融合节段的稳定性及椎间融合率。所有患者术中无重要神经、血管损伤等并发症发生,腰背部及下肢的VAS、JOA及ODI评分明显改善,至末次随访均未出现融合器及钉棒系统的移位和松动,融合率为100%(图1)。
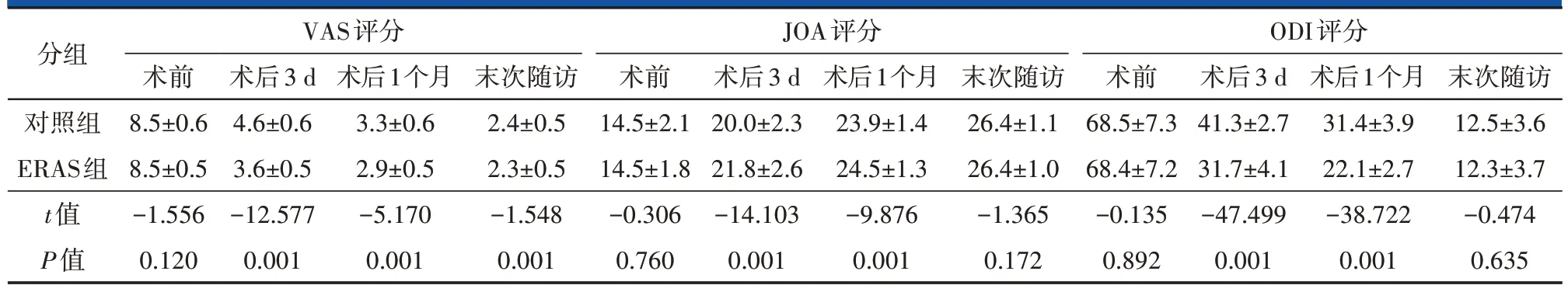
表4 两组术前及术后VAS、JOA及ODI评分对比
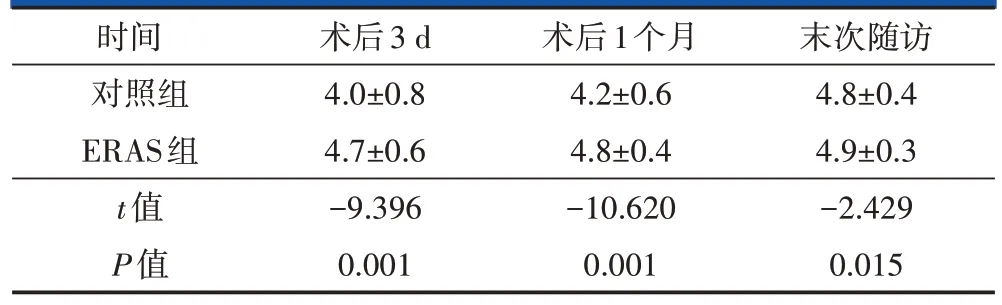
表5 两组患者满意度对比
PT-Endo-LIF 取得了良好的临床疗效,但仍沿用缺乏循证医学证据的传统围手术期干预模式不利于患者的术后康复。本研究将ERAS 应用到微创脊柱融合技术PT-Endo-LIF围手术期管理中,成效显著。
3.1 心理评估及术前宣教
LDD 患者因长期腰背部及双下肢疼痛,常产生压抑、焦虑甚至抑郁等心理问题,对手术的恐惧也会增加患者的心理负担[27]。患者术前焦虑、抑郁程度与术后的功能恢复和生活质量呈负相关[28]。因此,重视患者的心理状态,进行心理评估及心理干预极为重要。在ERAS 干预模式中,患者入院后采用PHQ-9、GAD-7、HAM-D 和HAM-A 进行抑郁和焦虑评估。必要时请精神卫生科会诊,进行细致的个性化、专业化心理辅导,必要时可用抗焦虑抑郁药物,以改善患者术前心理状态,加速患者康复[29,30]。
有研究发现,入院前对患有脊柱疾病的患者进行详细的住院及术前宣教,患者住院时间由10.9 d缩短至6.2 d,说明详细且良好的术前宣教可有效缓解患者的紧张、焦虑情绪,降低患者手术应激反应,缩短住院时间,提高患者满意度,帮助患者达到快速康复的目的[31,32]。本研究采用ERAS 细致化、精准化、个性化的入院及术前综合宣教模式,其主要内容主要包括:①常规住院相关注意事项;②疾病发生机制及发展过程,帮助患者正确认识疾病;③手术治疗的目的、手术方式、手术风险、可能出现的围手术期并发症,PT-Endo-LIF 较传统开放手术的优势;④围手术期可能出现的症状波动、并发症、预防及干预措施;⑤ERAS 干预模式的具体流程,让患者熟悉手术、麻醉、护理、康复等过程,调整患者期望值,提高患者依从性;⑥指导并监督患者术前戒烟,使其了解吸烟可增加术中出血、硬膜外血肿、脑脊液漏、切口感染、螺钉松动及手术并发症的发生率,且可导致术后植骨融合率下降等并发症的发生风险增加[33]。

图1 患者,男,53岁,腰痛伴右下肢疼痛麻木不适1年,诊断L4/5退变严重的巨大腰椎间盘突出,行PT-Endo-LIF治疗
3.2 围手术期疼痛管理
术后疼痛会增加患者卧床时间,增加心脑血管意外的发生风险,是延长骨科患者住院时间的首要原因[34]。PT-Endo-LIF 对骨膜及关节外软组织的损伤较小,但是疼痛阈值较低的患者仍会伴有腰背肌无力和疼痛。长时间的疼痛刺激易引起外周及中枢神经敏化,降低疼痛阈值,加重疼痛程度,延长住院及康复时间[35]。围手术期多模式镇痛管理一直是ERAS所提倡的重要措施,主要包括术前超前镇痛,术中伤口局部麻醉镇痛及术后合理镇痛。超前镇痛是为了防止或减轻术后疼痛而进行的术前镇痛干预,阻止中枢神经敏化形成,减少术后镇痛药用量,加速患者康复。Busch等[36]研究表明,术毕时在手术切口周围进行局部麻醉,明显降低患者术后早期的切口疼痛程度,术后镇痛药物的的应用剂量显著减少。阿片类药物可延迟胃肠功能恢复时间,引起术后恶心、呕吐等胃肠功能功能紊乱,延长住院时间[37],故在ERAS干预模式中采用非甾体抗炎药进行术后镇痛。
3.3 术后康复
术后对患者进行精准的液体管理可显著降低术后相关并发症的发生风险,缩短住院时间,加速患者康复[38]。传统开放LIF手术中,患者采用全身麻醉且失血量多,为了维持理想的血压水平,常予以大量补液以保证组织有效灌注,但忽略了术后应激,易出现机体水钠潴留、组织水肿,从而影响切口愈合甚至发生切口感染等并发症,尤其在老年患者心肺储备功能较低,大量体液灌注反而会增加心肺负担,影响预后[39]。
常规脊柱术后留置导尿管可缓解术后尿潴留、促进膀胱功能恢复,但长时间留置导尿管明显增加术后泌尿系统感染的风险。PT-Endo-LIF 的ERAS干预模式采用硬膜外感觉运动分离麻醉和局部麻醉,患者术后尿潴留现象极少见,且并不影响膀胱功能。术后即刻拔除导尿管,方便患者早期下地活动,减少膀胱刺激,降低泌尿系感染风险和下肢深静脉血栓风险,从而加速患者康复,提高患者满意度。
既往研究表明,骨质疏松症影响椎弓根螺钉植入的把持力和稳定性,延长椎体融合时间,降低植骨融合率,是腰椎融合器移位或脱出的的高危因素[40,41]。腰椎支具或腰围可增加腰椎术后稳定性,限制腰椎过度活动,PT-Endo-LIF 术后建议患者常规佩戴腰椎支具或腰围保护3个月,尤其对于合并骨质疏松症的患者,除了长期规范抗骨松治疗外,坚固腰椎支具保护3个月,改换腰围保护3个月。本研究中PT-Endo-LIF 末次随访未见任何椎间融合器移位、脱出及椎体间未融合现象。
综上,在PT-Endo-LIF 治疗LDD 时,通过多学科协作,优化实施围手术期ERAS 干预模式,可减少患者卧床时间和住院时间,提高手术临床疗效及患者满意度,达到快速康复的目的。

