基于核酸适体检测黄曲霉毒素B1的方法与高效液相色谱法的对比研究
付少伟,谢岩黎,班 珺
河南工业大学 粮油食品学院,河南省粮油食品安全检测与控制重点实验室,河南 郑州 450001
黄曲霉毒素(Aflatoxin,AFT)是由黄曲霉、特曲霉以及寄生曲霉等产生的一类含有二氢呋喃环结构的次生代谢产物[1],其中黄曲霉毒素B1(Aflatoxin B1,AFB1)因具有致癌性、致毒性和致突变性[2-4],被世界卫生组织(WHO)列为人类第一类致癌物[5-7]。黄曲霉毒素B1主要分布在大米、花生、玉米、小麦和大豆等农作物中,污染可发生在生长、收获、运输、储藏等多个环节[8]。我国规定人食用的玉米及其制品中AFB1含量不能超过20 μg/kg,小麦、大麦等其他谷物中AFB1含量不能超过5 μg/kg[9],欧盟规定谷物及其制品、花生、坚果及其加工制品中AFB1含量不能超过20 μg/kg[10]。
长期以来,科研工作者为AFB1的检测探索了许多方法,如薄层色谱法(Thin layer chromatography, TLC)、高效液相色谱法(High Performance Liquid Chromatography, HPLC)、胶体金免疫层析技术(Immune colloidal gold technique,GICT)、液质联用(Liquid Chromatography-Mass Spectrometry, LC-MS)和酶联免疫吸附法(Enzyme Linked Immunosorbent Assay, ELISA)[9,11-12]。高效液相色谱法是检测真菌毒素最常用的检测技术,以液体作为流动相,采用高压输液系统,将具有不同极性的单一溶剂或不同比例的混合溶剂、缓冲液等流动相泵入装有固定相的色谱柱,在柱内各成分被分离后,进入检测器,从而实现对试样的分析。Rodriguez-carrasco等[13]通过建立超高效液相色谱串联质谱法测定牛奶样品中黄曲霉毒素的含量,结果显示该方法检测限和定量限分别为0.001、0.002 μg/L,相对标准偏差为7%,在0.005、0.01、0.05 μg/L的加标水平下,回收率为75%~96%。王督等[14]利用高效液相色谱对不同激发波长、发射波长、流动相等条件进行优化,结果表明,当激发波长、发射波长分别为360、440 nm,流动相为水-甲醇(体积比为65∶35)时玉米中黄曲霉毒素检测分离效果最佳。高效液相色谱法检出限低、重现性好、灵敏度高,但净化后的样品需进一步衍生,样品预处理操作繁琐、仪器昂贵、成本较高,不适合大批量检测及现场检测[9]。
核酸适配体(核酸适体)1990年由Ellington等[15-16]提出,是采用指数富集的配体系统进化技术[17]从体外人工合成的单链核酸文库中筛选出与靶物质高特异性、高亲和力结合的寡核苷酸片段[18-19],与抗体相比,适配体具有生产方便、成本低、热稳定好、易化学合成、易与多种官能团修饰、高亲和合力和高特异性等优点[20-21],在诊断、治疗、检测等领域成为重要工具,同时为生物毒素的分析检测开辟了新道路。基于适配体的以上优点,作者将建立的酶联适体法、适体转换荧光法与目前检测AFB1最广泛使用的高效液相色谱法进行比较,对比检出限、线性范围、样品回收率,分析适用情况,为探索黄曲霉毒素B1的快速检测方法奠定了基础。
1 材料与方法
1.1 材料
黄曲霉毒素B1(AFB1):Sigma-Aldrich公司;乙腈、甲醇(色谱纯):天津市四友精细化学品有限公司;氯化钠:天津市天力化学试剂有限公司;高纯氮(含量≥99.999%):河南科益气体工程有限公司;纯净水:杭州娃哈哈集团有限公司;玉米、花生:市购。
1.2 仪器与设备
e2695高效液相色谱、2475 HPLC FLR多波长荧光检测器:美国Waters公司;光化学衍生器、黄曲霉毒素B1免疫亲和柱:月旭材料科技(上海)有限公司;玻璃纤维滤纸:上海优誉仪器仪表有限公司;AL204电子分析天平:梅特勒-托利多仪(上海)有限公司;FW-80高速万能粉碎机:北京市永光明医疗仪器厂;KQ100-E型超声波清洗器:昆山市超声仪器有限公司;DL-5-B低速离心机:上海安亭科学仪器厂;MTN-2800D氮吹浓缩装置:天津奥特赛恩斯仪器有限公司。
1.3 方法
1.3.1 酶联适体法检测AFB1
参考Xie等[22]建立的酶联适体法,用PBS结合缓冲液将AFB1母液稀释成0、0.1、1、10、20、40、60、80、100 ng/mL,在优化好的检测体系中建立标准曲线。向酶标板依次加入链霉亲和素、牛血清蛋白、核酸适体(5′-biotin-GTTGGGCACGTGTTGTCTGTCTCGTGCCCTTCGCTAGGCCCACA-3′)、核酸适体互补链(5′-biotin-TGTGGGCCTAGCG-3′)并充分反应后,加入一系列不同浓度的AFB1标准液,37 ℃温育1 h使AFB1与AFB1核酸适体发生特异性紧密结合,从而迫使互补链从核酸适体上脱落。随后甩干酶标板并用PBST将脱落的互补链及过剩的AFB1洗脱,加入HRP-SA,37 ℃温育1 h后分别加入TMB显色,加入1 mol/L H2SO4终止反应,用酶标仪双波长法测A450/620,观察不同浓度AFB1使检测体系发生的颜色变化及A450/620变化,建立酶联适体法检测AFB1的标准曲线,以20 mL乙腈-水(体积比为85∶15)为提取液,高速均质5 min,4 000 r/min离心5 min后取4 mL上清液,氮吹仪吹干提取液,加入1 mL PBS工作液复溶,使待测液中AFB1质量浓度分别为5、20、60 ng/mL。采用优化好的标准品检测方法对其进行检测,并计算回收率。
1.3.2 适体转换荧光法检测AFB1
参考班珺等[11]建立的适体转换荧光法,以PBS为工作液,选择最佳适体链,以Tris-HCl为工作液测定检测系统的荧光恢复率。通过(F-F0)/F0求荧光增长率,其中F0为猝灭状态时的荧光强度,F为加入毒素后的荧光强度。用PBS缓冲液将核酸适体(5′-GTTGGGCACGTGTTGTCTGTCTCGTGCCCTTCGCTAGGCCCACA-FAM -3′)、猝灭链(5′-BHQ1-TGTGGGCCTAGCG-3′)配置成200 nmol/L,将AFB1母液稀释成0、0.1、1、10、50、100、200、300 ng/L,在优化好的检测体系中建立标准曲线。400 μL 200 nmol/L核酸适体与400 μL 200 nmol/L猝灭链反应30 min后,将800 μL一系列不同浓度的AFB1标准液加入反应体系,反应1 h后测定荧光强度,以AFB1浓度为横坐标,荧光强度为纵坐标建立标准曲线。采用优化好的检测方法测定样品的初始浓度C0。回收试验中,向样品分别加入5、20、60 μg/kg的AFB1,加标后的检测浓度为C1,以(C1-C0)/加标浓度计算回收率。
1.3.3 高效液相色谱法检测AFB1
参照LS/T 6128—2017《粮油检验 粮食中黄曲霉毒素B1、B2、G1、G2的测定超高效液相色谱法》配制系列标准溶液,进行样品提取及加标,最后将样品净化后进行检测。
1.4 统计分析方法
采用统计学的分析方法将酶联适体法、适体转换荧光法与高效液相色谱法检测AFB1进行显著性分析(P<0.05),每个样品测定3个平行。
2 结果与分析
2.1 高效液相色谱法检测AFB1
采用高效液相色谱法检测AFB1并建立标准曲线,线性方程为y=1 135 950x-196 298.771 82(R2=0.999 6),线性范围为0.1~100 ng/mL,检出限为0.1 ng/mL。采用高效液相色谱法对花生、玉米进行AFB1的加标回收试验,结果见表1和表2,花生中AFB1回收率为80.00%~92.40%,玉米中AFB1回收率为74.97%~102.05%。表明该方法可行,能抵抗其他常见高浓度生物毒素的干扰,效果良好。

表1 高效液相色谱法对花生中AFB1的测定Table 1 Determination of AFB1 in peanuts by HPLC
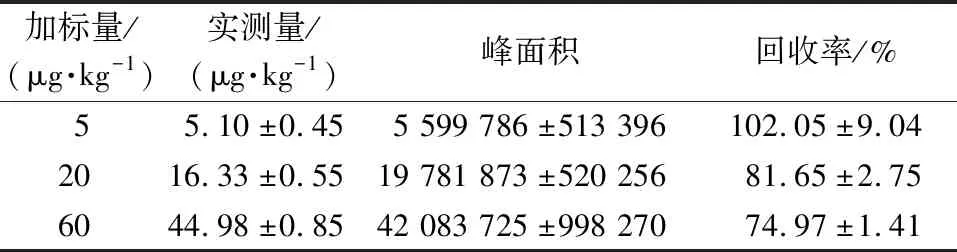
表2 高效液相色谱法对玉米中AFB1的测定Table 2 Determination of AFB1 in corns by HPLC
2.2 酶联适体法检测AFB1
采用酶联适体法检测AFB1并建立标准曲线,线性方程为y=-0.01x+0.957 05(R2=0.990 1),线性范围为1~80 ng/mL,检出限为0.7 ng/mL。采用酶联适体法对花生、玉米进行AFB1的加标回收试验,结果见表3和表4,花生中AFB1回收率为85.40%~94.40%,玉米中AFB1回收率为81.00%~86.70%。表明该方法可行,能抵抗其他常见高浓度生物毒素的干扰,且效果良好。

表3 酶联适体法对花生中AFB1的测定Table 3 Determination of AFB1 in peanuts by enzyme-linked aptamer method

表4 酶联适体法对玉米中AFB1的测定Table 4 Determination of AFB1 in corns by enzyme-linked aptamer method
2.3 适体转换荧光法检测AFB1
采用适体转换荧光法检测AFB1并建立标准曲线,线性方程为y=0.759 87x+148.928 30(R2=0.996 0),线性范围为1~300 ng/mL,检出限为0.8 ng/mL。采用适体转换荧光法对花生、玉米进行AFB1的加标回收试验,结果见表5和表6,花生中AFB1回收率为99.00%~108.33%,玉米中AFB1回收率为81.00%~85.56%。表明该方法可行,能抵抗其他常见高浓度生物毒素的干扰,效果良好。

表5 适体转换荧光法对花生中AFB1的测定Table 5 Determination of AFB1 in peanuts by aptamer conversion fluorescence method

表6 适体转换荧光法对玉米中AFB1的测定Table 6 Determination of AFB1 in corns by aptamer conversion fluorescence method
2.4 3种检测方法的对比研究
酶联适体法、适体转换荧光法与高效液相色谱法检测AFB1的对比结果如表7所示。3种检测方法均呈现较好的回收率。从检出限看,高效液相色谱法低于其他两种检测方法,说明作为精密仪器的高效液相色谱较其他两种检测方法灵敏度更好。从线性范围看,核酸适体结构转换荧光法较高效液相色谱法更广泛。对3种方法检测30个样品所需时长进行对比,高效液相色谱法检测1个样品需40 min,总时约20 h,而基于核酸适体所建立的两种检测方法对30个样品的检测可同时进行,时长不超过6 h。综上所述,基于核酸适体所建立的两种检测方法在灵敏度上稍弱于高效液相色谱法,但因为检测时间短,因此在大批量样品筛查检测中具有极大优势。
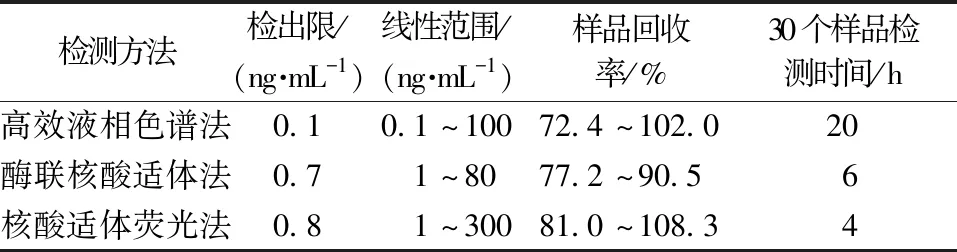
表7 基于核酸适体的检测方法与高效液相色谱法检测AFB1结果对比Table 7 Comparison of aptamer-based detection method and HPLC in the detection of AFB1
采用3种方法对不同加标浓度的花生和玉米样品进行检测,结果见表8和表9。当花生加标量为60 μg/kg时,酶联适体法与适体转换荧光法无显著性差异,适体转换荧光法与高效液相色谱法无显著性差异;当花生加标量为5、20 μg/kg时,3种方法之间均无显著性差异。当玉米加标量为5、20、60 μg/kg时,3种方法之间均无显著性差异。说明酶联适体法、适体转换荧光法用于检测AFB1是可行性。
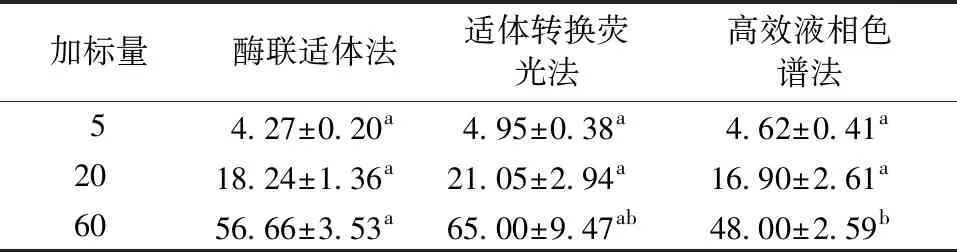
表8 3种方法对不同加标浓度的花生中AFB1的检测结果Table 8 Detection result of AFB1 in peanuts by three methods μg/kg
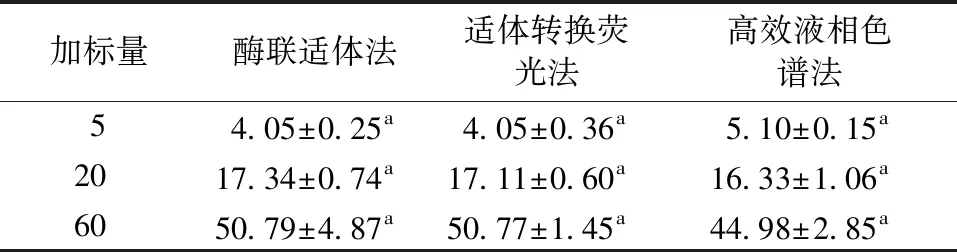
表9 3种方法对不同加标浓度的玉米中AFB1的检测结果Table 9 Detection result of AFB1 in corns by three methods μg/kg
3 结论
将酶联适体法、适体转换荧光法与高效液相色谱法检测AFB1进行了比较,建立标准曲线并通过统计学分析得知:3种检测方法均呈现较好的回收率,酶联适体法、适体转换荧光法与高效液相色谱法检测玉米中AFB1的结果相比无显著性差异(P>0.05),表明基于核酸适体酶联适体法和适体转换荧光法是可行的,且检测时间短,在大批量样品筛查检测中具有极大的优势。

