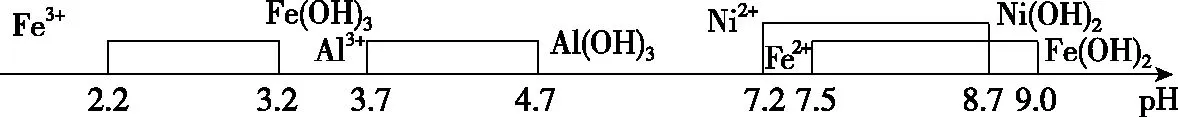巧用数轴理解化学平衡原理
江苏 郭高峰
近几年各地高考化学试题中对化学反应速率与化学平衡知识的考查主要是以表格或者二维图像形式呈现的,这样的呈现形式不仅能够有效锻炼学生接受、吸收、整合化学信息的能力,同时还能很好地考查学生的数据处理能力和演绎推理能力。利用数轴把表格数据或二维图像转化为一维信息,不仅可使复杂问题简单化、抽象问题具体化,而且对学生抽象思维能力和变换思维能力的培养具有特殊的意义。
1.借助数轴,化抽象为直观,帮助理解等效平衡
化学平衡是化学教学的重点和难点,内容比较抽象,特别是遇到等效平衡的问题,学生更是无从下手。本文借助数轴可以定性分析化学平衡中的等效问题,建立等效平衡模型使之更加直观简洁。


容器1容器2容器3反应温度T/K700700800反应物投入量2 mol SO2、1 mol O24 mol SO22 mol SO2、1 mol O2平衡时v正(SO2)/mol·L-1·s-1v1v2v3平衡时c(SO3)/mol·L-1c1c2c3平衡时体系总压强p/Pap1p2p3物质的平衡转化率αα1(SO2)α2(SO2)α3(SO2)平衡常数KK1K2K3
下列说法正确的是
( )
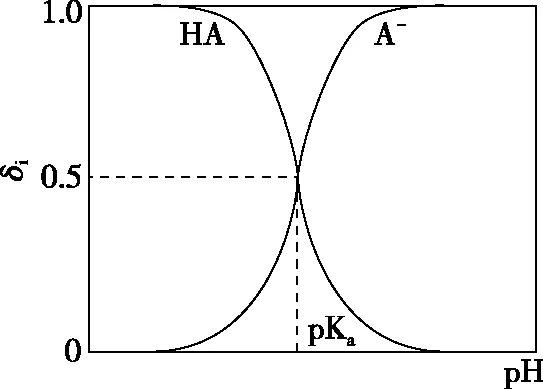
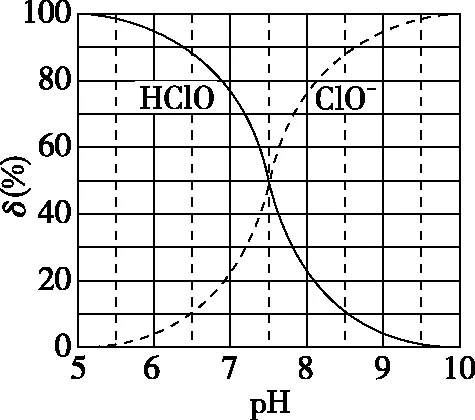
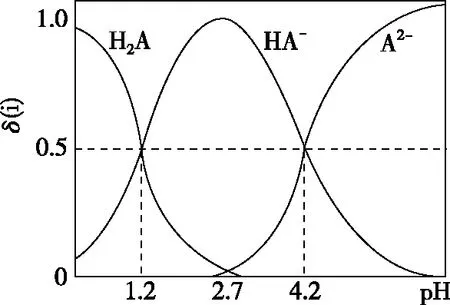
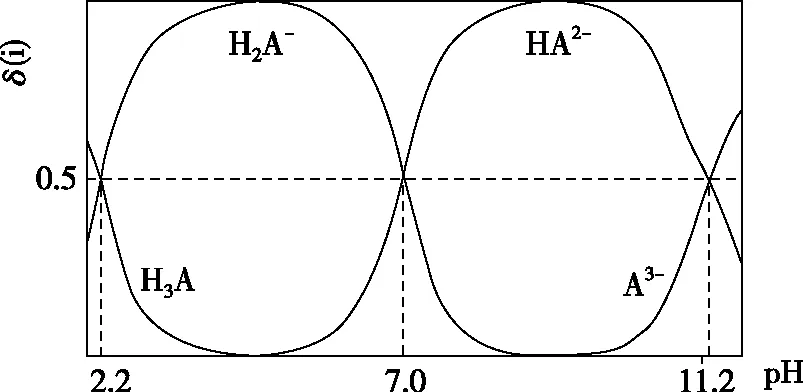
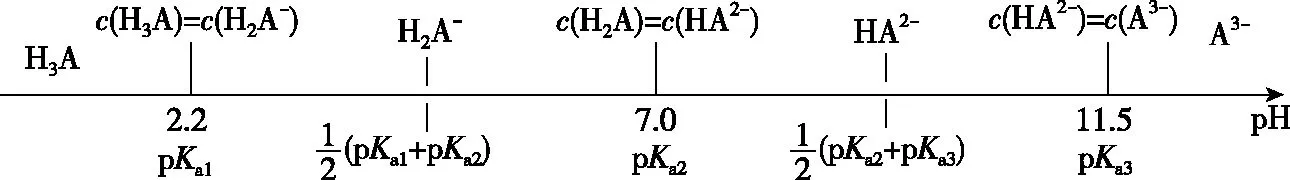
A.v1 B.K1>K3,p2>2p3 C.v1 D.c2>2c3,α2(SO3)+α3(SO2)<1 【答案】CD 【解析】在比较容器1和容器2中相关物理量的大小时需要虚拟一个中间状态,假设容器4在相同的条件下,于体积相同的容器中充入2 mol的SO3[假设2 mol SO2(g)和1 mol O2(g)生成2 mol SO3(g)放出的热量为QkJ]。即: 容器容器1容器4反应物的投入量2 mol SO2 1 mol O22 mol SO3SO3的浓度c1c4反应的能量变化放出a kJ吸收b kJ反应物的平衡转化率α1α4 由等效平衡的概念可知容器1和容器4在恒温恒容的条件下达到等效平衡(完全相同)状态,即:c1=c4,这两个过程可以看成容器1从起点投料到达平衡,容器4从终点投料到达平衡,两者于同一点相遇,应注意的是平衡点不一定在反应中点,只有在转化率为50%的时候才是反应中点,用数轴表示为图1所示,由数轴可知:a+b=Q、α1+α4=1。如果在容器2中充入4 mol SO3,同样可以利用数轴来解决。假设容器2达平衡时反应物的平衡转化率为α2,对于容器2,如果由两份的容器4压缩到容器1的体积时,平衡不移动,则α2=α4,但在压缩过程中平衡正向移动,说明α2<α4,即α1+α2<1。 图1 图2 HA各型体的δi-pH曲线 由图2可知,δ(HA)随pH的增大而减小,δ(A-)随pH增大而增大。但图2的绘制较为复杂,可将其简化成图3表示的数轴形式,即在一条表示溶液pH的数轴上,以弱酸HA的pKa(pKa=-lgKa)将数轴分为两部分,当pH=pKa时,δ(HA)=δ(A-)=0.5,c(HA)=c(A-);当pH>pKa时,即δ(A-)>δ(HA)时,c(HA)>c(A-);当pH 图3 HA各型体数轴图 图4 【答案】10-7.5 【解析】由上述分析可知,当c(HClO)=c(ClO-)时,pKa=pH,即pH=7.5时,c(HClO)=c(ClO-),即pKa=pH=7.5,Ka=10-7.5。同样对于某二元弱酸的各型体δi-pH 曲线图和数轴图如图5、图6所示: 图5 H2A各型体的δi-pH曲线 图6 H2A各型体数轴图 对于三元弱酸的型体分布则更为复杂。某三元弱酸的各型体δi-pH曲线图和数轴图分别如图7、图8所示: 图7 H3A各型体的δi-pH曲线 图8 H2A各型体数轴图 根据图8则可以更清晰地看到H3A水溶液中含A元素型体随pH的增大经历了由H3A→H2A-→HA2-→A3-的转变过程。通过数轴还可以作以下拓展: ①为获得尽可能纯的NaH2A,应控制最佳的pH为多少? ③欲用H3A和Na2HA配制pH=7.0的缓冲溶液,则H3A和Na2HA的物质的量之比为多少? 【例3】(2020·全国卷Ⅲ·27节选)某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O): 溶液中金属离子开始沉淀和完全沉淀的pH如表所示: 金属离子Ni2+Al3+Fe3+Fe2+开始沉淀时(c=0.01mol·L-1)的pH沉淀完全时(c=1.0×10-5 mol·L-1)的pH7.28.73.74.72.23.27.59.0 回答下列问题: (4)如果“转化”后的溶液中Ni2+浓度为1.0 mol·L-1,则“调pH”应控制的pH范围是________。 【答案】(3)Fe3+(4)3.2~6.2 图9 各金属离子的存在形式 【解析】将题给的表示溶液中金属离子开始沉淀和完全沉淀的pH表格用数轴表示如图9所示:滤液②中主要含有金属离子有Fe2+、Fe3+、Ni2+,若工艺流程改为先“调pH”后“转化”,即使Ni2+不沉淀,由数轴可知pH<7.2,此时溶液中还有Fe2+残留,再被H2O2氧化后“滤液③”中可能含有的杂质离子为Fe3+;(4)由数轴可知,当Ni2+沉淀完全时,浓度为1.0×10-5mol·L-1,由此可知Ni(OH)2的Ksp=1×10-5×(108.7-14)2,当Ni2+浓度为1.0 mol·L-1时,计算得pH为6.2,Fe3+沉淀完全时pH为3.2,因此,控制pH的范围为3.2~6.2。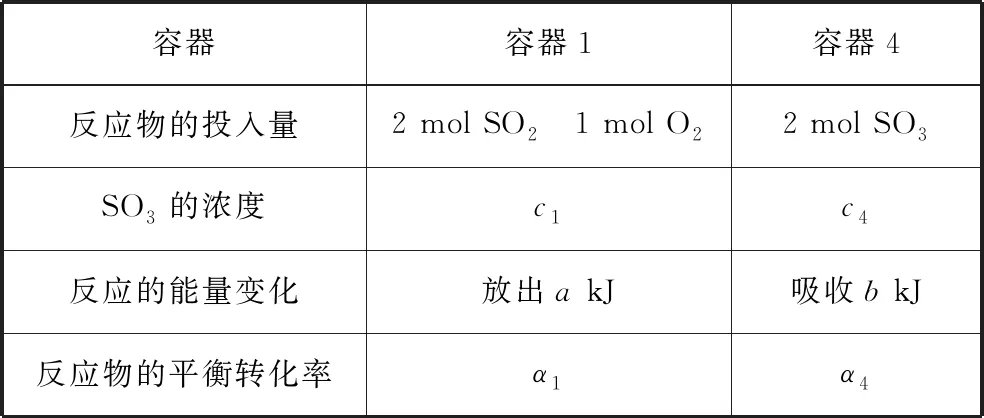

2.利用数轴,化二维为一维,帮助简化离子平衡
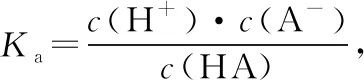

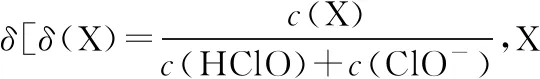
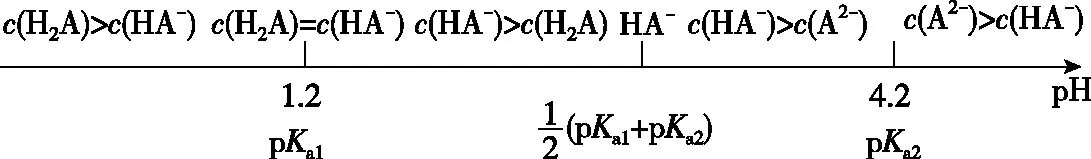

3.借助数轴,化复杂为简单,帮助分析沉淀平衡