淀粉颗粒外壳分离方法与其性质表征研究
杨 麒 黄峻榕 严 青 马 芸 方晨璐 纵 伟
(1.陕西科技大学食品与生物工程学院, 西安 710021; 2.郑州轻工业大学食品与生物工程学院, 郑州 450001)
0 引言
自然界淀粉主要由高等植物合成,可以被生物分解,从而提供生命过程中所需的能量[1],对人类饮食和工业可再生原料具有重要意义。淀粉具有复杂的空间结构,可分为分子、小体、壳层和颗粒4个结构层次,每个层次都影响淀粉的性质和应用[2]。自然界中的淀粉以颗粒形式存在,如球形、椭球形、多面体等[3-4];淀粉的壳层结构又称生长环结构,是围绕颗粒脐心交替排列的同心环状空间结构[5];淀粉的小体是壳层和颗粒结构的构筑单元,其直径分布在10~500 nm之间[2];淀粉分子包括直链和支链两种,前者通过α-1、4糖苷键连接,后者通过α-1、4糖苷键和α-1、6糖苷键连接[6]。
淀粉颗粒在水中受热会吸水膨胀,控制加热条件可实现颗粒的有限膨胀。淀粉的外壳结构与内部结构组成不同,颗粒外层较内部结构更加紧密,在受到外力作用时更易于保持原有形貌,外壳对淀粉溶液的黏度贡献更大[7]。直链淀粉主要集中在淀粉颗粒内部,随着淀粉的膨胀会游离而出进入溶液[8]。目前,对淀粉壳层结构的研究较少。本课题组前期研究已证实淀粉具有外壳结构,并探索了观察马铃薯原淀粉颗粒外壳的方法[9]。本文以薯类(红薯、木薯)、豆类(豌豆、绿豆)、谷类(玉米、小麦)三大类原淀粉作为研究对象,探索不同种类淀粉颗粒外壳的分离方法,研究淀粉的微观结构和宏观性质。
1 材料与方法
1.1 材料与仪器
木薯淀粉、玉米淀粉、小麦淀粉购自上海禾煜贸易有限公司第一分公司;红薯淀粉购自北京德众嘉鑫经贸有限公司;绿豆淀粉购自西安香再来调味品厂;豌豆淀粉购自成都杨天食品有限公司;无水乙醇、冰乙酸(色谱纯)购自天津市天力化学试剂有限公司;DMSO(二甲基亚砜)、NaNO3(色谱纯)购自德国Merck公司。
TecMaster型快速黏度分析仪(RVA),波通瑞华科学仪器(北京)有限公司;HITACHI S-4800型扫描电镜,日本日立集团;LSM 800型激光共聚焦荧光显微镜,德国ZEISS公司;D/max×2200 PC型X-射线衍射仪,日本理学公司;Q2000型差示扫描量热仪,美国TA公司;Mastersizer 2000型激光粒度仪,英国马尔文公司;Series 1500 GPC型色谱泵,DAWN HELEOS型多角度激光光散射仪,Optilab Trex型示差折光检测器,美国Wyatt科技公司。
1.2 实验方法
1.2.1淀粉热学特性测定
准确称量3 mg原淀粉(干基)置于差示扫描量热仪(DSC)专用样品盘,使用微量进样器加入蒸馏水,配制成30%的淀粉乳。压盘后对其进行DSC分析。测定温度范围设定为10~100℃,升温速率设定为10℃/min。得到淀粉样品的差示扫描量热仪曲线,分析得到淀粉发生相变糊化过程中的相关参数。
1.2.2淀粉糊化温度测定
在专用测量杯中加入1.4 g原淀粉样品(干基),加入蒸馏水配制成质量分数为5%的28 g淀粉乳。采用预先设定的13 min RVA标准程序处理淀粉乳:最初10 s转速为960 r/min,之后转速保持160 r/min至实验结束。初始温度设定为50℃保持1 min,经3.7 min升高至95℃并保持2.5 min,再经3.8 min降至50℃并保持2 min。通过TCW 3软件分析淀粉在糊化过程中的糊化温度。
1.2.3淀粉颗粒外壳分离方法
分别将红薯、木薯、绿豆、豌豆、玉米、小麦6种淀粉在乙酸溶液(pH值分别为1、1.5、2、2.5、3)配置成5%的淀粉乳,取28 g于RVA专用测量杯中,在设定RVA程序下进行处理。设定RVA程序:最初10 s转速为960 r/min,之后实验转速保持160 r/min。实验起始温度为50℃保持1 min,然后经3.7 min升高到设定的最高温度并保持2.5 min,然后经3.8 min降至30℃并保持2 min,整个过程历时13 min。反应结束后,立即取出测量杯,并将淀粉糊移入8倍体积无水乙醇充分洗涤,静置去上清液。再分别用50 mL无水乙醇清洗3次,将沉淀置于表面皿中,于40℃下鼓风干燥,得到处理后的淀粉样品。通过光学显微镜观察各个条件下淀粉颗粒的形貌,确定得到各淀粉相对完整外壳的条件。
1.2.4淀粉形貌观察
(1)场发射电子扫描显微镜观察
将双面导电胶固定于扫描电镜专用的载物台后,取少量原淀粉和处理过的淀粉(干燥)样品于导电胶,用吸耳球将样品吹散使其均匀黏附于导电胶上,并吹去多余部分。真空喷金(珀金)后,将载物台放入样品室进行观察并拍照。扫描电镜电压设置为3.0 kV,采用下探头观察。
(2)激光共聚焦显微镜观察
通过激光共聚焦显微镜(CLSM)观察处理前后淀粉的变化。淀粉的染色参照文献[10]的方法并适当修改。取原淀粉样品10 mg,外壳样品3 mg(处理后的淀粉外壳较原淀粉蓬松,密度小),加入15 μL 8-氨基芘基-1,3,6-三磺酸三钠盐(APTS,10 mmol/L)乙酸溶液和15 μL的氰基硼氢化钠(1 mol/L)水溶液混合,恒温水浴(30℃、15 h)。然后用1 mL溶剂反复清洗样品,离心去上层,再将染色后的样品悬浮于100 μL甘油/水混合溶液(体积比为1∶1)。取适量悬浮液样品置于载玻片,加盖玻片,试用激光共聚焦显微镜进行观察。观察条件:20×镜头,Ar/Kr气体激光器,488 nm激光发射波长,500~600 nm波长接收范围。
1.2.5直链淀粉含量测定
采用GB/T 15683—2008中的碘比色法,对处理前后原淀粉和淀粉外壳的直链淀粉含量进行测定[11]。
1.2.6粒径测定
使用Mastersizer 2000型激光粒度仪测定原淀粉和外壳的粒度分布。将0.5%(以干基计)质量分数的6种淀粉乳经RVA程序处理,静置后将下层外壳移入800 mL蒸馏水中,伴以2 250 r/min的搅拌;原淀粉中加入少许蒸馏水,分散后移入800 mL蒸馏水中。使用通用分析模式,其中颗粒折射率和吸收率分别为1.5和0.1,分散剂(水)的折射率为1.3,所有样品测量的遮光度需大于10%。
1.2.7糊化程度测定
各称取原淀粉样品0.2 g(以干基计)于离心管中,分别加入10 mL乙酸溶液(pH值为1.5,7.1 mol/L),于室温(25℃)下平衡30 min。在各淀粉对应处理温度下,加热搅拌30 min后冷却至室温并离心15 min(4 000 r/min)。缓缓倒出上清液于量筒,计算下层凝胶体积,从而得到淀粉的膨胀体积。以在10 mL蒸馏水中95℃下测定的淀粉膨胀体积为最大膨胀体积,测定处理后样品的膨胀体积与在蒸馏水条件下的比值来反映糊化程度。
1.2.8结晶性质测定
将处理前后的淀粉样品均匀平铺在X-射线衍射仪的样品槽中,玻片压平后放入样品台中进行测试。测定条件为:Cu-Kα射线,波长1.542 Å,石墨单色器,测定的管压40 kV,管流40 mA,连续扫描,扫描速度4(°)/min,扫描范围2θ为4°~60°,发散狭缝1°,防散射狭缝1°,接收狭缝0.3 mm,得出淀粉的X-射线衍射图谱。参照文献[12]计算相对结晶度的方法,得出淀粉样品的相对结晶度。
1.2.9分子量测定
采用高效分子筛色谱(HPSEC),联用多角度激光散射分析仪(MALLS)和示差折光检测器(RI),对原淀粉和外壳的分子量进行测定。
样品处理:在10 mg淀粉样品中加入1 mL 90%二甲基亚砜(DMSO),100℃溶解12 h,加3 mL无水乙醇,离心除上清液(12 000 r/min,10 min)。无水乙醇洗涤沉淀两次,风干后加3 mL 0.1 mol/L NaNO3(含0.02% NaN3),充分溶解样品(121℃,加热20 min),离心(12 000 r/min,10 min),取上清液100 μL上样。样品数据用ASTRA 6.1软件分析。
2 结果与讨论
2.1 淀粉的热学特性与糊化温度
图1为各原淀粉的差示扫描量热(DSC)测试图。可以看到,6种淀粉的DSC曲线都表现出单峰且出峰位置和峰的面积不同,即各淀粉结晶熔融温度及糊化吸收焓值不同。红薯、木薯淀粉的DSC曲线相近,结晶熔融温度均为64℃左右,但红薯淀粉的吸热峰更窄,表明其淀粉颗粒内部结晶程度的分布更集中;绿豆、豌豆淀粉的DSC曲线也相近,结晶熔融温度在60℃左右,略低于豆类淀粉。在6种淀粉中,谷类淀粉中玉米淀粉的DSC曲线峰强最大,吸热焓最大,且结晶熔融温度最高(65℃),表明其颗粒内部分子形成的双螺旋结构更加紧密。从小麦淀粉的DSC曲线可以看出,其结晶熔融温度最低(57℃),这与其支链淀粉的短链(聚合度小于12)比例较高有关[13]。但小麦淀粉中含有两种尺寸和结晶程度不同的颗粒[14],因此吸热峰较宽。

图1 不同淀粉的差示扫描量热曲线Fig.1 Differential scanning calorimeter curves of different starches
通过快速黏度分析仪(RVA)测得各个淀粉的糊化温度分别为:红薯74℃,木薯和绿豆72℃,豌豆71℃,玉米和小麦89℃。可以看出薯类和豆类的糊化温度接近,在温度超过70℃后这两类淀粉的膨胀颗粒在外力的挤压下开始出现大量破裂,淀粉分子充分分散到水中,表现为淀粉乳黏度的急剧上升。而谷类淀粉在接近90℃时,才达到承受极限开始破裂,远高于薯类和豆类淀粉的糊化温度。影响淀粉糊化温度的因素很多,例如淀粉的种类、淀粉颗粒大小、淀粉的膨胀特性、淀粉直链/支链比例、淀粉的结晶结构和淀粉分子链长分布等。有研究表明淀粉颗粒越小,水分子进入颗粒内部所需的能量越大,因此小颗粒的小麦淀粉需要在较高温度条件下才能开始糊化[14]。另外,淀粉的糊化温度与其膨胀特性直接相关,越容易膨胀的淀粉颗粒在搅拌作用下越容易发生糊化。以上原因可以解释玉米淀粉和小麦淀粉的RVA糊化温度较高。
可以看出不同淀粉的糊化温度高于结晶的熔融温度,这是因为淀粉颗粒内部结晶开始分解时,颗粒整体还比较完整,没有发生大范围的破裂,不会立即造成体系黏度的上升。比较各类淀粉的RVA糊化温度和DSC熔融温度规律,可以发现淀粉的结晶融化温度越高,颗粒内部结构的分子间结合力就越高,越有利于颗粒维持原有结构并抵抗外力,糊化温度也就越高[15-18]。
对淀粉样品的处理和淀粉外壳的分离需在充分的水条件下进行。相较于DSC,利用RVA可实现淀粉外壳的大量制备。基于此,后续实验通过调整RVA的最高处理温度,建立不同淀粉外壳的分离方法。
2.2 淀粉外壳分离方法
图2为原淀粉和经乙酸处理后(pH值1.5,7.1 mol/L)的淀粉外壳扫描电镜图。可以看到,原淀粉颗粒(图2a~2f)表现出椭球形和多面体形,表面光滑。绿豆、玉米淀粉表面存在微孔,其中绿豆淀粉表面的微孔数量较多。研究表明,大部分的A型谷物淀粉表面含有微孔结构,这些微孔会与颗粒内部的蛇形通道相连,直通颗粒内部[12]。这些淀粉颗粒的通道微观结构,可能有助于淀粉与酶和化学试剂的反应。而在B型淀粉中,如马铃薯和高直链淀粉则很少观察到这些结构。对于谷物淀粉来说,表面小孔的直径一般为0.1 μm左右,内部通道的直径为0.1~0.3 μm[19-20]。

图2 原淀粉和淀粉外壳的扫描电镜图像Fig.2 Scanning electron microscope images of native starch and starch outer shells
图2g~2l为在乙酸体系下,分别经最高温度处理后分离得到的6种淀粉外壳的扫描电镜图。最高处理温度分别为:红薯79℃、木薯77℃、绿豆87℃、豌豆81℃、玉米89℃、小麦73℃。所有温度均比自身原淀粉的结晶熔融温度高13~27℃(DSC测定结果,表1),表明淀粉颗粒内部的结构都已遭到分解和破坏。相比于糊化温度,薯类和豆类淀粉处理温度比自身在水体系下的糊化温度高5~15℃,这是由于低pH值会抑制淀粉颗粒的膨胀[21-22],此时需高于糊化温度才能提供足够能量使颗粒破裂。而小麦淀粉的处理温度比自身糊化温度低16℃,却比结晶熔融温度高16℃,可能与较高的直链淀粉含量、颗粒内部的分子链长分布以及较低的淀粉糊黏度有关。
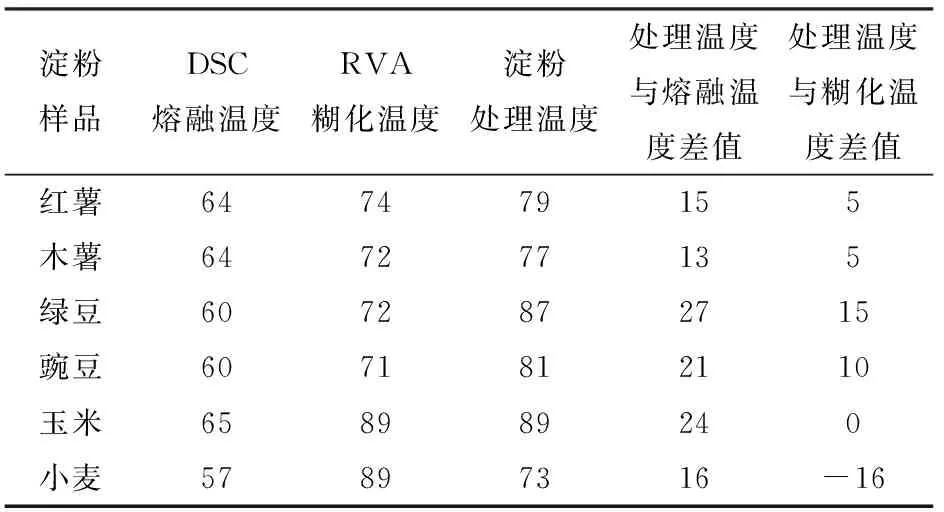
表1 不同淀粉的DSC熔融温度、RVA糊化温度和处理温度Tab.1 Melting temperature, gelatinization temperature and treatment temperature of different starches ℃
由图2可以看出,处理后的6种淀粉颗粒都已破裂,能清晰地观察到很薄的外壳结构,厚度都在1 μm以内,颗粒内部中空。这与之前报道的马铃薯淀粉外壳[9]相似(RVA不完全糊化处理,pH值1.5乙酸溶液)。同时,淀粉外壳的内部也很少有附着物,说明在处理过程中淀粉颗粒内部物质随着糊化过程的进行几乎全部游离到溶液中。乙酸会对淀粉的形貌造成影响,例如对小麦和玉米原淀粉的表面造成裂缝和斑点,使马铃薯淀粉和小麦淀粉颗粒表面变得不光滑[23-25]。

图3 原淀粉和淀粉外壳的激光共聚焦显微镜图像Fig.3 Confocallaser scanning microscope images of native starch and starch outer shells
所有淀粉的外壳结构还部分保留原淀粉的部分形貌,说明淀粉外壳在处理过程中可以更好地维持自身结构,与内部结构相比差异很大。外壳较内部具有更好的韧性,更加耐热、耐酸和耐剪切。研究发现淀粉外壳的变形程度与淀粉的黏度呈正相关,也说明颗粒的内外结构不同[22]。在绿豆淀粉外壳和玉米淀粉外壳上看不到原淀粉上的小孔结构,表明在糊化膨胀过程中外壳上的分子排布也发生了变化。玉米淀粉的外壳结构更接近于原淀粉,在处理过程中遭到破坏较小,而其他5种淀粉的外壳破坏严重,说明玉米淀粉更适合作为加工淀粉外壳的原材料。
图3为淀粉处理前后的激光共聚焦图,可以在原淀粉(图3a~3f)中明显观察到淀粉颗粒内部的中空结构、孔道结构和明暗交替的层状结构。由于APTS可与淀粉分子的还原末端结合并在激光照射下发出绿色荧光[26],所以在相同分子量的情况下,直链淀粉还原末端较支链淀粉还原末端更多,更易与APTS结合从而荧光强度更大。淀粉颗粒内部的层状荧光分布表明直链淀粉和支链淀粉有规律地周期分布排列。文献[27]对不同直链淀粉含量(质量分数3%、19%、42%)的玉米淀粉进行CLSM观察(沸水浴,0.5~4 min,尼罗蓝染色),发现直链淀粉含量与颗粒内部环状结构的分布无直接关系。
从淀粉外壳(图3g~3l)染色图中可以看到,处理后的淀粉外壳发生了有限膨胀,直径为原淀粉颗粒的2~3倍;内部无荧光,且外壳的荧光强度远低于原淀粉的荧光强度,表明在处理过程中淀粉颗粒内部分子溶出或被破坏,淀粉外壳的分子分布随着颗粒膨胀变得松散或部分溶出。文献[28]研究了高直链玉米淀粉在加热过程(70%直链淀粉,100~140℃,30 min,APTS染色)中的颗粒形态变化,发现高直链玉米淀粉在达到120℃时才开始出现明显膨胀,此时淀粉颗粒的中心结构开始破坏,在130℃加热30 min后,其荧光强度逐渐减弱,暗区向外扩展,说明直链淀粉组分已被破坏或移位。
总之,在乙酸体系(pH值1.5、浓度7.1 mol/L)中,通过快速黏度分析仪设置最高处理温度与糊化温度差值为-16~15℃对淀粉进行处理(表1),可以分别得到红薯、木薯、绿豆、豌豆、玉米、小麦6种淀粉的外壳。在其他条件下均不能得到较为完整的外壳。
2.3 淀粉外壳的表征
表2为各淀粉外壳厚度、直链淀粉质量分数、粒径、糊化程度、相对结晶度和分子量。可以发现不同淀粉的外壳厚度存在差异,6种淀粉的颗粒外壳厚度在50~470 nm之间,这些尺寸应比原淀粉的外壳尺寸偏大,因为在处理过程中淀粉外壳和淀粉颗粒都随着糊化作用发生了不同程度的吸水膨胀。薯类和豆类淀粉的外壳厚度比较接近,在95~470 nm之间;玉米淀粉部分区域的颗粒外壳厚度较薄,仅50 nm左右;小麦淀粉的最薄外壳大于130 nm,可能与这种淀粉的处理温度最低有关。淀粉颗粒不是均匀的大分子物质,对于同种淀粉来说,颗粒的粒径分布具有一定范围,因此处理后得到的淀粉外壳厚度具有差异。
淀粉外壳的直链淀粉含量低于原淀粉,推测支链淀粉的侧链形成大量双螺旋结构,相互紧密堆叠连接形成了能抵抗外力的外壳。适当控制糊化条件,可使淀粉颗粒逐渐膨胀,颗粒内部物质转移到溶液中。由于淀粉外壳中含有大量支链淀粉,结构相对紧实,有助于保持原有的壳层形貌。文献[29]对马铃薯原淀粉进行化学糊化处理(4 mol/L CaCl2,21℃)后测定残存颗粒的直链淀粉含量,发现淀粉外部的直链淀粉含量高于淀粉内部。这与本实验结果不同,可能是由于前者在高浓度的离子体系中处理淀粉时,颗粒内部的直链淀粉会随着搅拌游离到溶液中,导致残存颗粒中的直链淀粉含量偏低。
原淀粉的平均粒径范围为13.1~27.4 μm,其中豌豆淀粉平均粒径最大,为27.4 μm,木薯淀粉平均粒径最小,为13.1 μm,这与扫描电镜观察的结果相匹配。同时,也与文献[30-31]的测试结果一致。

表2 不同淀粉外壳厚度、直链淀粉质量分数、粒径、糊化程度、相对结晶度及分子量Tab.2 Shell thickness, amylose content, particle size, gelatinization degree, relative crystallinity and molecular weight of different starch and starch outer shells
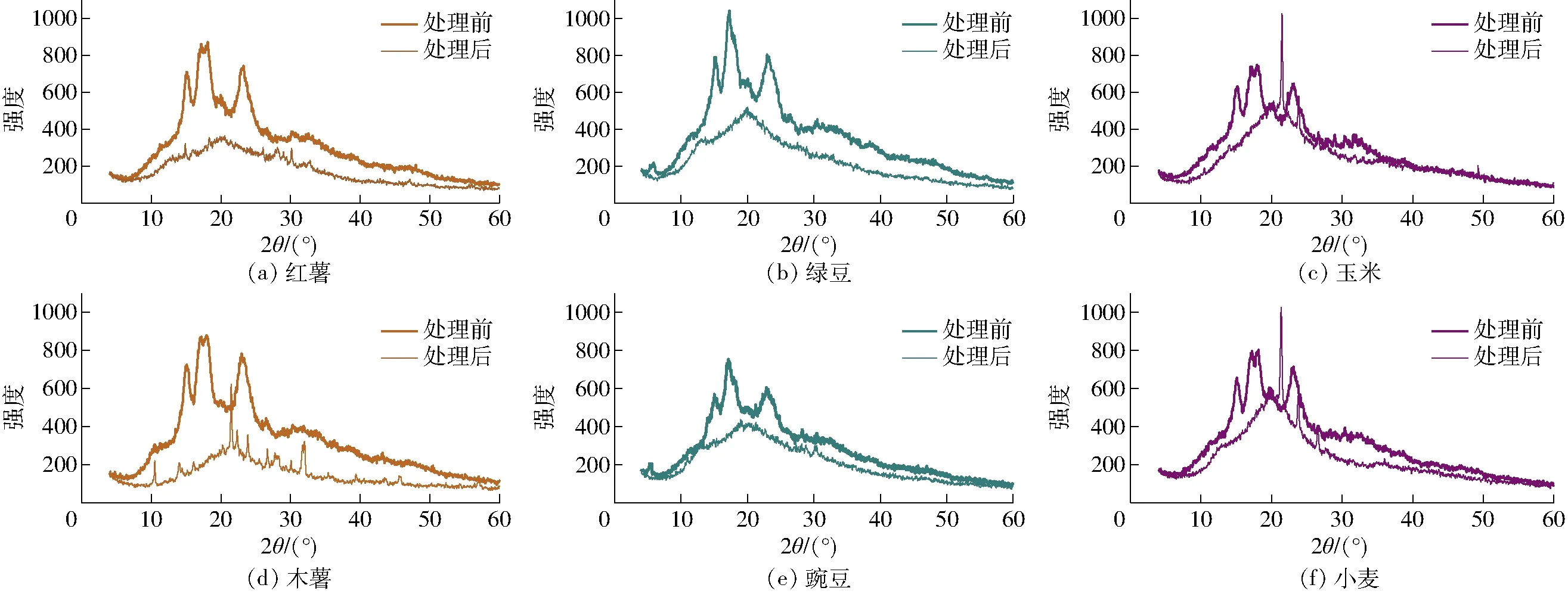
图4 淀粉处理前后的X-射线衍射图谱Fig.4 X-ray diffraction patterns of starch before and after treatment
分析各类淀粉的X-射线结果(图4)可以发现,薯类和谷类原淀粉在2θ为15.1°、17.2°、18.1°、23.1°附近出现明显吸收峰,属于明显的A型晶体结构。而豆类淀粉在2θ为5.5°、15.1°、17.2°、18.1°、23.1°附近出现明显吸收峰,属于C型晶体结构。一些研究中的绿豆[32]、豌豆[33]、玉米[34]、小麦[35]淀粉的结晶类型与本文一致,但其他研究中[36-37]的红薯、木薯淀粉为C型晶型,说明淀粉的晶型类别与淀粉种类,生长环境密切相关。薯类淀粉(红薯和木薯)与谷类淀粉(玉米、小麦)同为A型结晶,说明淀粉颗粒内部的双螺旋排列相似。
从表2看出,经乙酸处理后,淀粉的相对结晶度明显降低,说明结晶结构发生了较大程度的变化,这与淀粉的糊化程度有关。6种淀粉外壳的糊化程度分布在19%~56%,相对结晶度分布在5%~34%。其中,玉米淀粉外壳的糊化程度最低,绿豆淀粉外壳的糊化程度最高,而二者的相对结晶度变化均最大(处理后下降了83%),这可能是由于这两种淀粉颗粒表面特有的微孔使结晶结构更易与水分子结合而遭到破坏。
对比淀粉外壳和原淀粉的相关性质,发现6种淀粉颗粒的外壳厚度(50~470 nm)与其淀粉粒径(13.1~27.4 μm)、直链淀粉质量分数(23.3%~37.6%)以及相对结晶度(18%~49%)没有明显相关性。
6种原淀粉的淀粉分子量分布在3.8×107~2.4×108g/mol。其中绿豆淀粉的分子量最高。文献[38-39]分别测定了豆类淀粉、薯类淀粉和玉米淀粉的分子量,前者发现薯类淀粉的分子量较大,而后者发现玉米淀粉的分子量最大,说明淀粉分子量同样与种类和来源密切相关。
在淀粉外壳中,淀粉分子量分布在4.3×107~1.2×108g/mol之间。可以发现,除绿豆淀粉外,其他淀粉外壳的分子量明显高于原淀粉,说明参与形成外壳的淀粉分子更大,具有更强的分子间作用力、内作用力和空间效应,使淀粉外壳更耐剪切,具有黏弹性。以上结果说明,低pH值会抑制淀粉颗粒的膨胀,可以通过控制温度和pH值调节淀粉的糊化程度,实现淀粉颗粒外壳的分离。
2.4 讨论
目前微米级的包膜材料非常少见。淀粉外壳这种微米级的天然包囊结构,具有天然高分子材料的大部分优点,且非常容易被生物体消化利用。它还具有自身独特的生物特性:吸水易膨胀成网络口袋结构,可通过收缩改变内部容积,易与其他淀粉颗粒黏连等。因此,淀粉外壳不仅能被用作食品功能成分的稳定剂和缓释剂,而且仍有其他巨大的应用价值有待开发。可以通过改变淀粉外壳内外层的亲水性,使其具有自组装特性。另外,由于纯天然淀粉的热塑性比较差,可通过引入其他基团对外壳改性,以实现不同的包材硬度需求,将来可用于生物传感器、分子器件、高效催化材料和医用生物材料等。
3 结束语
通过控制淀粉的糊化条件、降低体系的pH值和处理温度,研究了6种原淀粉颗粒外壳的分离方法。结果显示,在pH值为1.5的乙酸体系中,通过对淀粉进行不完全糊化处理,可以得到较完整的不同淀粉外壳,厚度为50~470 nm,淀粉外壳的分子量高于原淀粉(除绿豆淀粉外)。淀粉外壳相对结晶度显著降低,但还保留原淀粉颗粒的部分形貌,淀粉表面的微孔可以加剧外壳结晶度的降低。淀粉外壳厚度与其淀粉粒径、直链淀粉质量分数以及相对结晶度没有明显相关性。玉米淀粉的外壳结构相对完整,更适合用于微米级包膜材料。

