TiO2/Cu-Cu2O复合粒子的可见光催化活性及“记忆”效应
杜 鑫, 高 慧, 胡亚微, 阮 妙
(陕西科技大学 化学与化工学院, 陕西 西安 710021)
0 引言
1972年,Fujishma和Honda在Nature杂志上发表了用TiO2作为光阳极进行紫外光照分解H2O为H2和O2的研究论文[1].1976年,Carey发现在紫外光照射下,纳米TiO2可使多氯联苯发生脱氯反应[2],之后半导体氧化物光催化材料得到了广泛研究[3-8].
然而,现有的光催化材料在光照下才显示出优良的光催化活性,而在失去外界光源供应后将不能产生电子-空穴对,也无法生成活性基团,难以继续对环境中的污染物进行有效处理,最终使得光催化材料在实际应用中的效率减小.因此,开发在黑暗条件下依然具有光催化活性的材料对于高效处理环境污染物及促进节约型社会建设具有重要意义.这种在黑暗条件下依然具有光催化活性的特性被称为光催化“记忆”效应[8,9].
然而,针对此类光催化“记忆”效应的研究却鲜有报道[10-12].文献[8,12]曾报道过PdO纳米颗粒修饰N掺杂TiO2材料,PdO作为储能单元光照下捕获额外的光生电子,光照关闭后PdO释放存储的光生电子而产生活性基团,实现在黑暗环境下对污染物的有效去除,显示优良的光催化“记忆”效应.同样的,TiO2光催化材料经I2[13]、Ag[14]和Mo[15]修饰后也可获得光催化“记忆”效应.
而Cu2O作为一种窄禁带半导体材料具有良好的可见光吸收特性,成为光催化材料领域的研究热点之一[16-25].同时,近几年报道的纳米Cu2O光催化材料修饰SnO2[26]后,显示优良的光催化“记忆”效应.光照下SnO2作为储能单元有效的存储额外的光生电子,黑暗条件下SnO2释放存储的电子产生活性基团,使纳米Cu2O光催化材料在黑暗条件下依然保持光催化活性.本文以Cu2O为光催化基质材料,首先通过溶剂热法制备Cu-Cu2O颗粒,再将获得的Cu-Cu2O颗粒与TiO2复合制备TiO2/Cu-Cu2O光催化剂,研究其光催化活性及“记忆”效应.
1 实验部分
1.1 实验材料
实验所用化学试剂为:三水硝酸铜(AR,天力化学试剂有限公司);正钛酸四丁酯(TBT,AR,科密欧化学试剂有限公司);尿素(AR,天力化学试剂有限公司);无水乙醇(AR,天津市河东区红岩试剂厂);丙三醇(AR,科密欧化学试剂有限公司);甲基橙(AR,湘中地质实验研究所).
1.2 实验仪器
采用日本Rigaku Ultima IV型X射线粉末衍射仪(XRD)分析样品物相;采用Thermos Fisher X2型电感耦合等离子体-质谱(ICP-MS)测定样品中Ti元素含量;采用美国FEI Verios 460型扫描电子显微镜(FE-SEM)和美国的FEI Tecnai G2 F20 S-TWIN型透射电子显微镜(TEM)对样品的微观形貌进行分析;采用美国安捷伦Lambda 950 PerkinElmer测定样品紫外-可见漫反射光谱;采用英国AXIS SUPPA型X光电子能谱(XPS)测定样品的元素及化合态;采用上海嘉鹏CHX光化学反应仪对MO进行光降解,其中以500 W Xe灯模拟太阳光,并安装滤光片获得λ>420 nm的可见光,并采用上海嘉鹏723型紫外-可见分光光度计测定462 nm 处MO溶液的吸光度.
1.3 实验方法
首先采用溶剂热法制备Cu-Cu2O粒子,具体实施步骤如下:将4.65 mmol Cu(NO3)2·3H2O完全溶于24 mL的丙三醇、乙醇和水的混合溶剂(体积比7∶7∶10)中后,再将9.30 mmol尿素溶于上述溶液中.最后,将混合溶液转移到30 mL聚四氟乙烯衬里的不锈钢高压釜中,置于170 ℃烘箱9 h.自然冷却至室温后,离心收集固体并洗涤,60 ℃真空干燥12 h获得到Cu-Cu2O粒子.
称量46.5 mg的Cu-Cu2O样品超声分散于10 mL乙醇后,在冰浴下将0.1 mol/L 正钛酸四丁酯(TBT)乙醇溶液缓慢滴入并搅拌,再将1 mL乙醇和水的混合液(体积比4∶1)滴加到上液中并剧烈搅拌1 h,最后加入10 mL乙醇稀释后转移至30 mL反应釜,并于180 ℃下反应12 h.待反应结束自然冷却后离心、洗涤、60 ℃真空干燥12 h得到TiO2/Cu-Cu2O复合粒子.其中TBT溶液的滴加体积分别为0μL、200μL、243μL、300μL、413μL、650μL、1 450μL,对应样品分别标记为a~g.同样方法不加Cu-Cu2O获得的TiO2样品标记为h.
以20 mg/L MO的光催化降解为模型,评价光催化活性及“记忆”效应.光催化活性测试过程为:将50 mg样品浸入到50 mL MO溶液中,在黑暗环境中搅拌30 min使之达到吸附/脱附平衡后,在安装截止波长420 nm滤光片的光催化反应仪下搅拌,每隔30 min取3 mL悬浮液离心,取上层澄清液测定462 nm处的吸光度.光催化“记忆”效应测试过程为:50 mg样品在模拟可见光照射5 h后,加入50 mL MO溶液并黑暗中搅拌,每隔15 min取3 mL悬浮液离心后,取上层澄清液测定462 nm处的吸光度.
2 结果与讨论
2.1 成分分析
所得样品的XRD结果如图1所示.由图1可知,样品a在29.6 °,36.4 °,42.3 °,61.3 °和73.5 °处均出现强而尖的衍射峰,分别对应赤铜矿Cu2O(结构索引卡片No.05-0667)的(110),(111),(200),(220)和(311)晶面,在43.3 °和50.5 °处出现了Cu(结构索引卡片No.65-9026)的衍射峰,说明样品a为Cu-Cu2O复合物.样品h为纯锐钛矿TiO2,其峰位与TiO2(结构索引卡片No.21-1272)峰位吻合.样品b~e也显示单质Cu和Cu2O的衍射峰,并未观察到TiO2的衍射峰,可能由于TiO2量较少未能被检测到,而TiO2含量较多的样品f和g出现了微弱的锐钛矿TiO2衍射峰.

图1 复合材料的XRD谱图
通过XPS分析样品的成分,在样品b的XPS谱图2中出现了元素Cu、O、Ti的峰,说明锐钛矿TiO2复合到Cu2O粒子表面.

图2 TiO2/Cu-Cu2O的XPS光谱(样品b)
通过ICP-MS测定的Ti元素的含量计算出TiO2/Cu-Cu2O复合粒子中TiO2的质量分数,如表1所示.结果表明,测试所得TiO2质量分数与理论值保持一致,且随着TBT加入量的增加,TiO2/Cu-Cu2O复合粒子中TiO2的含量也逐渐增加.

表1 TiO2/Cu-Cu2O样品中TiO2的质量百分比
2.2 形貌分析
从图3所示的SEM照片可以看出,制备的TiO2/Cu-Cu2O均为微米球状粒子,粒径约为10μm.未复合TiO2的Cu-Cu2O样品表面较平整,复合TiO2后样品表面变得粗糙,而且随着TiO2含量的增加,表面凸起的小颗粒逐渐增多,这可能是因为Cu-Cu2O表面负载越来越多TiO2粒子所致.图3(h)为纯TiO2电镜图,TiO2为粒径约250 nm的球形颗粒.


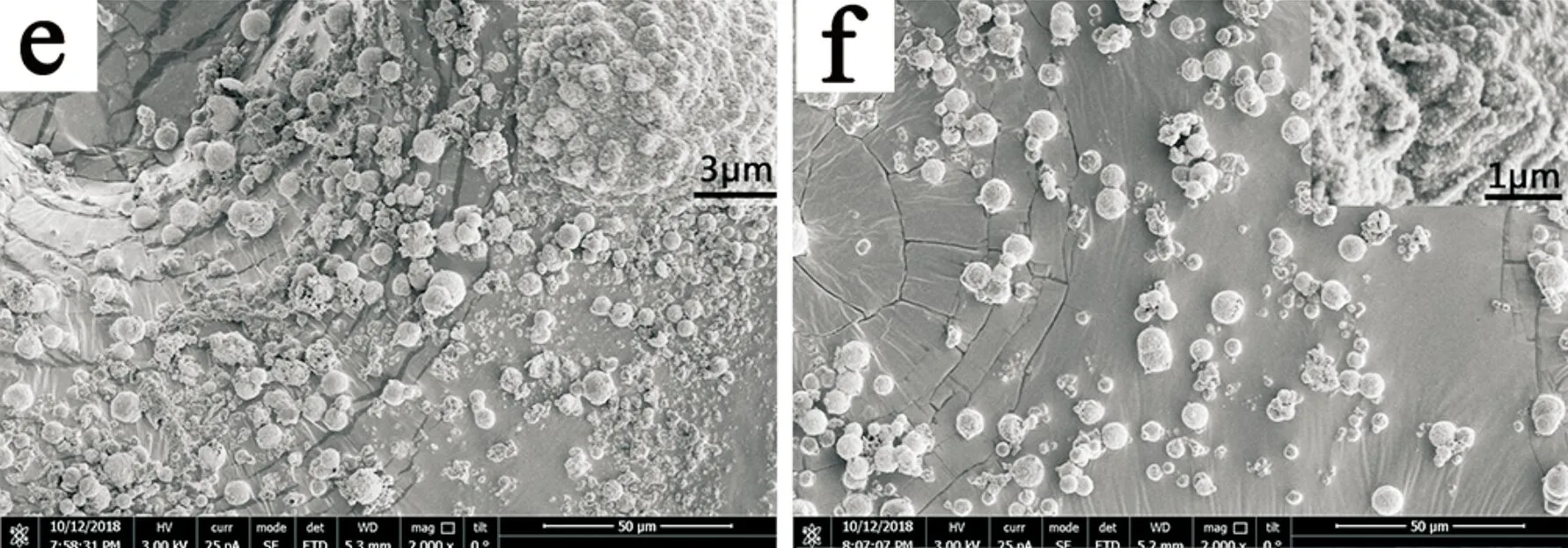

(a)、(b)、(c)、(d)、(e)、(f)、(g)、分别为加入 0 μL 、200 μL 、243 μL、300 μL、413 μL、650 μL、1 450 μL TBT的SEM图 (h)纯TiO2 的SEM图图3 样品a~h的SEM图像
从样品d的TEM照片(如图4(a)所示)可以看出,样品表面覆盖着一层薄的物质,从HRTEM照片(如图4(b)所示)测得0.20 nm和0.35 nm的晶面间距,分别对应Cu2O(111)晶面和TiO2(111)晶面.结合XRD结果,这进一步说明TiO2和Cu-Cu2O成功复合.

(a)TEM图 (b)HRTEM图图4 样品d的TEM图和HRTEM图
2.3 光催化活性及“记忆”效应
通过TiO2/Cu-Cu2O复合粒子对MO溶液的光降解评价其光催化活性,其结果如图5所示.纯MO溶液在光照下几乎不发生降解,在可见光照射下,随着TiO2含量增加,样品a~d对MO溶液的降解率依次增加,样品d对MO溶液的降解率最高.这是由于TiO2的导带低于Cu2O导带位置,光生电子可以直接转移到TiO2上,有效地分离光生电子和空穴,从而增强了光催化活性.继续增加TiO2含量,样品e~g对MO溶液的降解率逐渐降低,这是由于过多TiO2覆盖在Cu2O表面,阻碍了Cu2O的光吸收,降低了光生电子的产生,导致光催化活性降低[25].样品d在光照30 min后对MO溶液的降解率为93.7%,继续光照至120 min时对MO的降解效果高达98.9%,几乎使MO溶液完全降解,表现出优异的光催化活性.

图5 样品a~g对MO的降解曲线
为评估Cu2O纳米粒子的光催化稳定性,用样品d对MO溶液进行重复降解实验,结果如图6所示.结果表明,在降解实验循环4个周期后,样品对MO溶液的降解率依然维持在90%以上,说明样品d具有良好的光催化稳定性.

图6 样品d对MO进行4次光催化降解
样品d经光照5 h后在黑暗中对MO溶液的去除率如图7所示.在黑暗中放置90 min后,MO的去除率约为96%;而未经过预光照的样品d在黑暗中放置60 min后对MO的去除率约为68%,这是由样品d在黑暗中对MO的吸附导致;表明经过5 h预光照的样品d在黑暗中对MO的去除率提高了约28%,说明经过预光照的样品d在黑暗中依然具有催化活性,即样品d显示出良好的光催化“记忆”效应.而经过预光照的样品a在黑暗中对MO的去除率与未经预光照的样品a在黑暗中对MO去除率曲线几乎完全重合,说明Cu-Cu2O无光催化“记忆”效应.
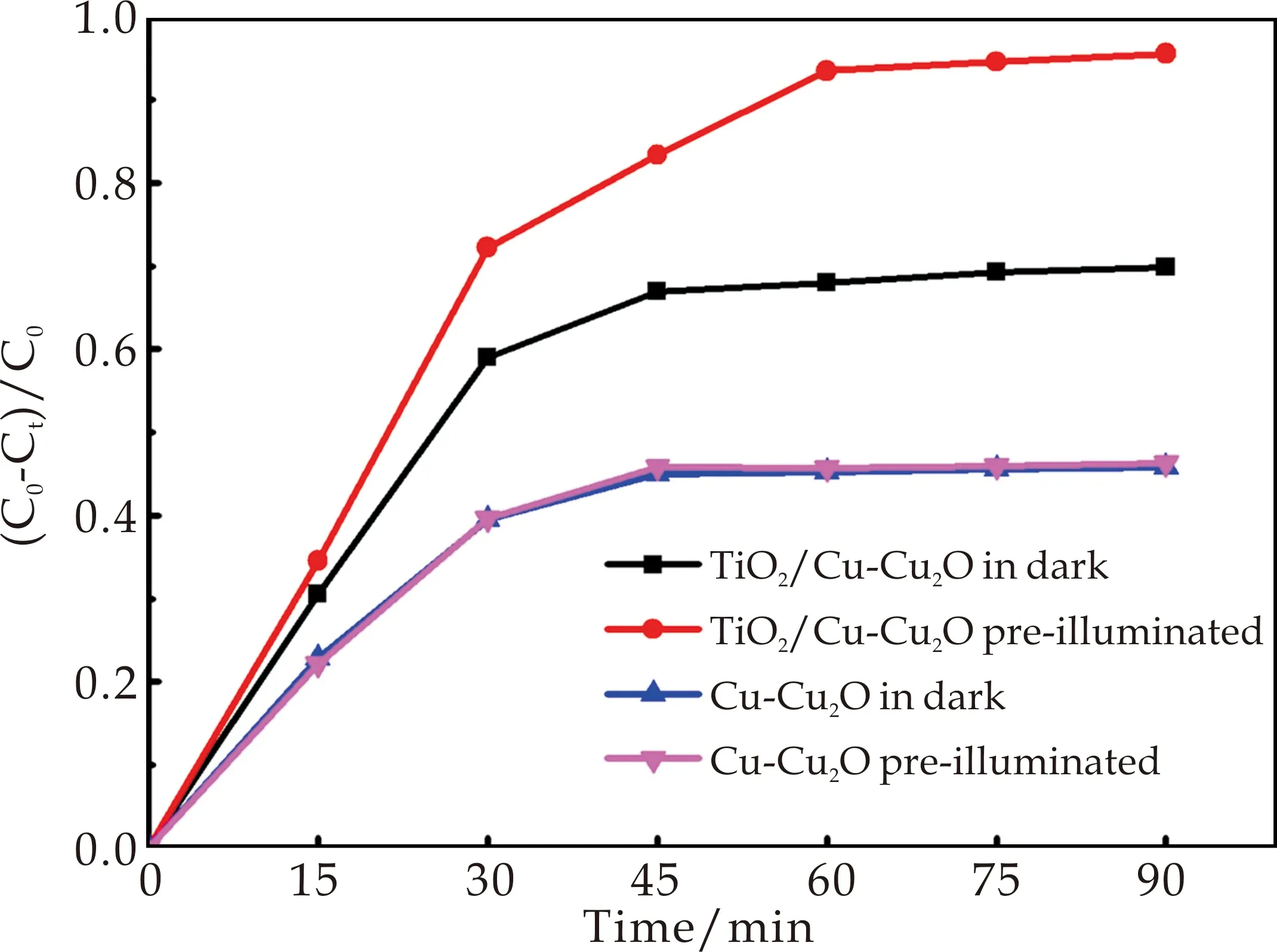
图7 与没有预光照的样品相比,预光照5 h的样品a和d在黑暗中对MO的去除率
光照后样品d的Ti2p高分辨XPS光谱如图8所示.结合能458.4 eV和464.2 eV对应Ti4+,而结合能457.3 eV和463.1 eV对应Ti3+,说明光照后部分Ti4+获得电子转变为Ti3+,将电子存储起来.熄灭光照,被存储的电子释放,从而使得材料获得光催化“记忆”效应[27].
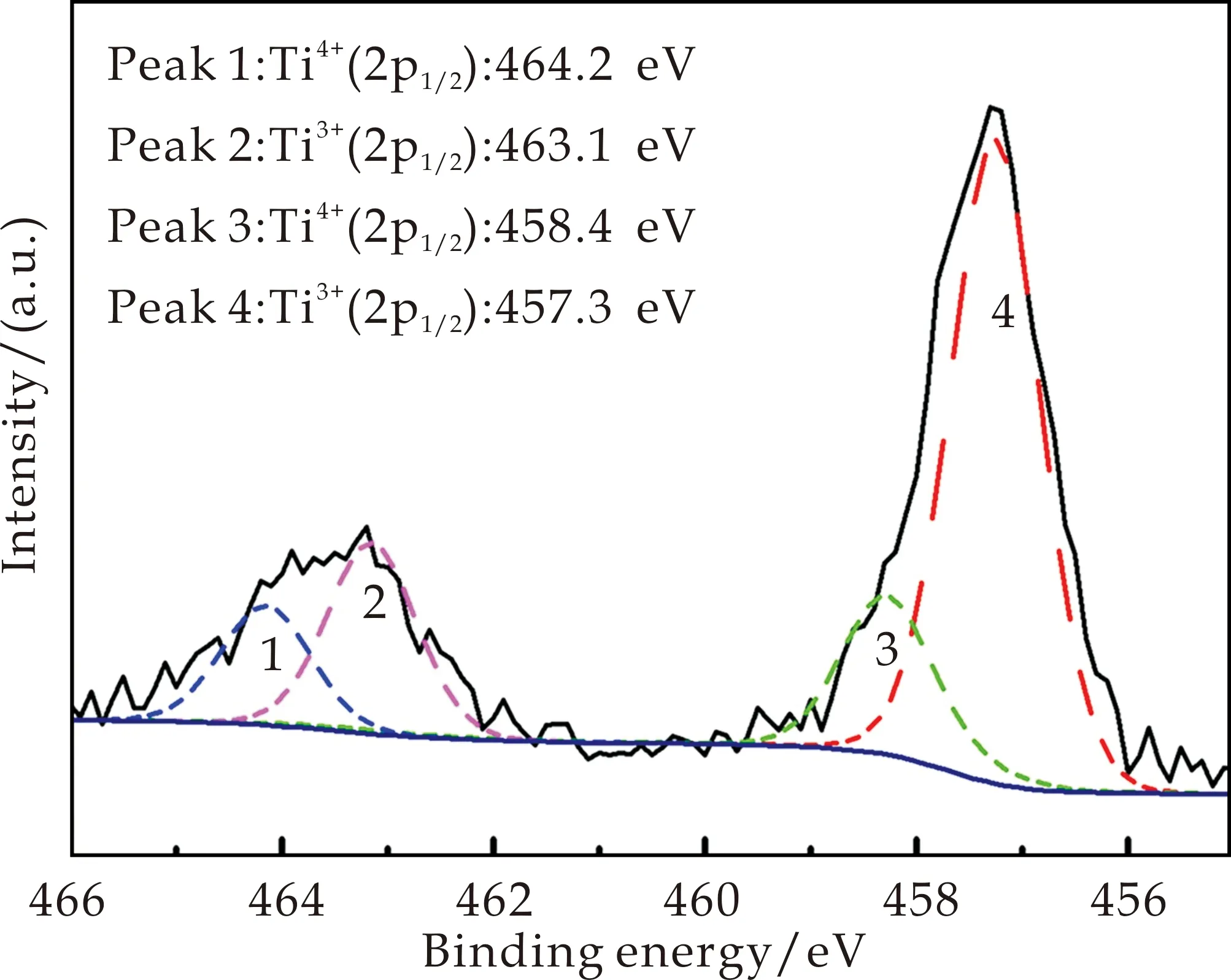
图8 样品d在可见光照明后,高分辨率XPS扫描Ti2p峰
3 结论
本文将Cu-Cu2O微米颗粒与TiO2溶胶混合后,通过溶剂热法制备出TiO2/Cu-Cu2O复合光催化剂,其具有良好的光催化活性及“记忆”效应.当TiO2/Cu-Cu2O复合粒子中TiO2的质量分数约为5%时,在可见光照射30 min后,20 mg TiO2/Cu-Cu2O复合粒子对20 mL MO溶液(20 mg/L)降解率达93.7%;在可见光预照射5 h后,在黑暗环境中其对MO溶液的去除率比Cu-Cu2O颗粒提高了约28%,使光催化剂在黑暗条件下保持催化活性,为全天候光催化材料的发展提供了实验基础.

