施氮对森林生态系统AM真菌群落组成及多样性的影响
赵爱花,刘 蕾,付 伟,武 慧,陈保冬
1 中国科学院生态环境研究中心城市与区域生态国家重点实验室, 北京 100085 2 中国科学院大学, 北京 100049 3 南京信息工程大学生态研究院,江苏省农业气象重点实验室, 南京 210044
自工业革命以来,大量化石燃料的燃烧,以及农业和工业生产活动中氮(N)素消耗大量增加,加速了全球大气N沉降并导致一系列生态环境问题。据估计,1995年全球平均N沉降速率大约是1860年的3倍,而2050全球平均N沉降速率将增加到1860年的6倍[1]。我国陆地生态系统N沉降速率已达21.1 kg hm-2a-1[2],其中,湿沉降速率已经由20纪90 年代的11.11 kg hm-2a-1增加到13.87 kg hm-2a-1[3],增长了近25%,在今后几十年中我国N沉降的形势将更加严峻[2]。N沉降增加一方面可以提高受N限制的生态系统的生产力[4],另一方面过多的N素供应也会给生态系统带来诸多负面影响,如土壤酸化[5]、植物物种多样性丧失[6]、水体富营养化[7]等。同时,N沉降还可以通过改变土壤环境(如N的有效性、土壤酸化等)直接影响土壤微生物多样性[8- 9],或通过地上植被的生理生态响应间接作用于土壤微生物[10]。
丛枝菌根(Arbuscular mycorrhiza,AM)真菌是一类在陆地生态系统中广泛存在的土壤真菌,能与绝大多数陆地植物形成互惠共生体系,具有许多重要的生态功能,如帮助植物获取N、P等矿质养分和水分,增强植物对生物和非生物胁迫的适应能力[11],改变植物群落的组成、多样性,还能影响生态系统的生产力和结构功能稳定性[12- 13]。在陆地生态系统N素循环过程中,AM真菌除了能够吸收、转运N素以外,在N素生物固定、硝化、反硝化以及N素淋洗过程中均具有潜在重要作用[14- 15]。AM真菌一方面通过改善植物磷(P)营养,提高豆科植物的固N能力[14],另一方面可能通过影响固N微生物功能基因的表达来调控N素的生物固定[16]。AM真菌还可能通过与氨氧化微生物竞争底物[17],改变氨氧化微生物的群落组成[18]及植物根系营养生理[19]调控硝化过程,通过调控反硝化细菌的数量[20]及相关功能基因的表达进而影响反硝化过程[16]。此外,AM真菌还能够通过改善土壤结构[21],促进宿主植物对无机N的吸收等多种途径减少因淋洗而造成的土壤N素损失。
鉴于N沉降形势的严峻性和AM真菌重要的生态功能,越来越多的土壤生态学家开始关注N沉降对AM真菌的影响并开展了试验研究。目前,已有相关研究多采用N素添加的方式模拟N沉降,受到具体试验条件的影响,研究结果不甚一致:N沉降对AM真菌多样性可能有积极作用[22],没有显著影响[23],或者具有消极作用[24];类似地,对于AM真菌群落组成而言,有的研究显示N沉降有显著影响[25- 28],而另外一些研究则显示无显著影响[29- 30]。影响N沉降生态效应的因素有很多,如施N速率[22]、N素形态[31]、试验方法[29]、试验周期[32]等。此外,还可能受到环境中N的背景值及生态系统类型的影响[33]。因此,客观认识和评价N沉降对AM真菌的影响,还需要开展更为系统的研究工作。
总体上,目前N沉降对AM真菌多样性和群落组成影响的研究多集中在草地生态系统,对森林生态系统的研究相对匮乏。在森林生态系统中开展的有限研究中,施N方式又多为林下施N[24- 25,29],这种方式忽略了冠层发生的一系列生态过程,如N的吸收、固定、挥发、转化等[34-38],而这些过程都会影响到达地面的N的形态和数量[39],因此林下施N可能无法准确反映自然条件下N沉降对AM真菌多样性和群落组成的影响。Huang等[40]研究发现,林冠施N对土壤微生物生物量和群落组成的影响小于林下施N,那么对AM真菌来说是否也是类似的情况,目前尚无相关报道。基于此,我们依托鸡公山林冠模拟氮沉降野外试验平台,通过连续4 a的样品采集和分析,尝试回答这个问题。我们提出的研究假设是:林下施N模拟N沉降会高估自然N沉降对森林土壤AM真菌多样性和群落组成的影响。
1 材料与方法
1.1 研究区概况
鸡公山林冠模拟N沉降野外试验平台于2013年建于河南省信阳市以南 38 km的鸡公山国家级自然保护区(31°46′—31°52′N, 114°01′—114°06′E)的原生林中。研究区由于地处北亚热带边缘秦岭山系西端的浅山区,受东亚季风气候的影响,具有典型的北亚热带向暖温带过渡的季风气候和山地气候特征,四季分明。研究区内土壤以黄棕壤、黄褐土为主,pH 值在 5.0到6.0 之间。植被类型为落叶阔叶混交林,林龄约45 a。优势乔木树种为麻栎(QuercusacutissimaCarruth.)、栓皮栎(QuercusvariabilisBl.)和枫香(LiquidambarformosanaHance),林下树种和草本丰富。
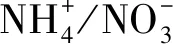
1.2 实验设计
实验采用完全随机区组设计,包括4个区组(相当于4个试验重复),每个区组随机设置5个半径为17 m的样方,对应5个试验处理:对照(CK)、林冠施N 25 kg hm-2a-1(CN25)或50 kg hm-2a-1(CN50)、林下施N 25 kg hm-2a-1(UN25)或50 kg hm-2a-1(UN50)。为防止处理间的干扰,各样方之间留有至少20 m的缓冲带,每个缓冲带中间都加装深度为 1 m 的PVC隔离板。
N添加在每年4到10月份进行,每月一次,一年7次。添加的N素形态为NH4NO3溶液。每次施N时,添加的NH4NO3溶液相当于3 mm的降水量,一年的添加量相当于21 mm的降水量,小于该地区年均降雨量的2%,因此水分的影响可以忽略不计[41]。林冠施N和林下施N都是由位于相应样方中心的自动喷洒装置来实现的。林冠喷洒装置高35 m(冠层以上约5 m),林下喷洒装置距离地面的高度为1.5 m。该装置顶端安装有一套摇臂喷头,有供水管道与样地外的蓄水池连接,利用变频调速恒压喷灌设备提供压力,驱动摇臂喷头360° 旋转,以保证喷洒的均匀性和精确性。塔基处供水管道安装有水量计,可精准控制每次处理的用水量。关于装置的细节、工作方式和效率参考Zhang等[41]。
1.3 样品采集与分析
从2013年到2016年,每年最后一次N添加处理完成之后,进行土壤样品采集。采样时间为11月中下旬到12月初,具体时间视当地天气情况而定。土壤样品的采集和分析,以及生物信息学分析均参考Zhao等[32]。为了尽可能减少采样位置的影响,在各样方核心区20 m×20 m范围内选取5棵树作为目标树。在距每棵目标树1—2 m范围内,取2钻土(直径3 cm,深度10 cm),每个样方共10钻土,制备成一个混合土样,用冰袋运送到实验室。混合土样过2 mm筛之后分成两部分,一部分冷冻干燥后储存于-80℃冰箱,用于土壤微生物总DNA的提取;另一部分自然风干,用于测定土壤pH、有效磷(available phosphorus,AP)等基本理化性质。
土壤有效磷用0.5 mol/L的NaHCO3提取,钼蓝比色法测定[42];土壤pH值采用水土比2.5∶1,PB- 10 pH计(Sartorius, Göttingen, Germany)测定;铵态N、硝态N首先用2 mol/L 的KCl浸提(水土比为5∶1),然后用连续流动分析仪进行测定(SAN++, Skakar, Breda, Holland);铵态氮、硝态氮含量之和作为有效N含量(available nitrogen, AN);有效N与有效P之比即为N/P比。
采用Power-Soil RDNA提取试剂盒 (MO BIO Laboratories, San Diego, CA, United States),按照说明书提取土壤DNA。DNA样品用灭菌超纯水稀释5倍,然后进行巢式PCR扩增。扩增的引物分别为AML1/AML2[43]和AMV4.5NF/AMDGR[44],扩增体系及程序设置与Zhao等[32]相同:第一次PCR反应总体积为25 μL,其中含有2.5 μL 10 × Ex-Taq缓冲液(Mg2+Plus)、2.0 μL dNTP混合物、0.25 μL Ex-Taq(5u/mL)(Takara,大连,中国)、1.0 μL(10 mg/mL)BSA(TaKaRa,大连,中国),双端引物各0.5 μL(10 μmol/L),17.25 μL 无菌水和1.0 μL DNA模板。PCR扩增条件如下:94℃预变性3 min;94℃ 45 s,51℃ 40 s,72℃ 1 min,扩增35个循环;然后72℃延伸10 min,16℃冷却2分钟。第一轮的PCR产物进行10倍稀释,作为第二轮的模板。第二轮扩增体系与第一轮相同,扩增条件如下:94℃预变性3 min;94℃ 40 s,58℃ 1 min,72℃ 1 min,扩增35个循环;然后72℃延伸10 min,4℃冷却2 min。扩增产物用1%琼脂糖凝胶电泳检测后,送上海瀚宇科技有限公司切胶回收、纯化、建库及测序(Illumina Miseq PE300测序平台)。
最初的数据质量控制和序列拼接由上海瀚宇生物科技有限公司完成。原始测序数据用 Trimmomatic v 0.32[45]进行质控,主要步骤如下:(1)删除带有N碱基的reads;(2)删除低质量的reads Q value<20);(3)删除过短的reads(<50 bp)及其配对reads。用Mothur v.1.32.1[46]进行序列拼接,允许引物有1个碱基的错配。删除拼接同聚物长度>8,序列总长<200 bp的序列。嵌合体的过滤由Chimera.uchime v.4.2[47]完成。使用Usearch v.9.0.2132_i86linux32[48]在97%的相似性水平划分OTU (operational taxonomic unit,操作分类单元)。删除序列数<5条的OTUs。其余OTUs的代表序列和NCBI GenBank数据库及MaarjAM数据库进行比对,满足下列条件的OTUs用于后续分析:Identifications >97% similarity,>90% coverage 及>200 BLAST score value,不满足条件者被舍去。为了进一步确认分类信息的可靠性,我们把OTUs的代表序列和在GenBank数据库中比对到的序列放在一起,采用MEGA v5[49],依据Kimura 2-parameter模型构建了Neighbor-Joining 系统发育树。除了bootstrap数目设为1000以外,其余参数均采用默认值。
1.4 统计分析
所有的统计分析均采用R 3.3.2 (R Core Team, 2016) 完成。采用中位数稀释法对每年的样品测序数据进行标准化[50]。标准化后的OTU表格进行Hellinger转化,作为分析 AM真菌群落组成的数据,也用来计算AM真菌群落的alpha多样性指数(丰富度S、香侬指数 H、Pielou′s 均匀度指数J和辛普森指数)。用“vegan”包[51]“specnumber”函数计算丰富度。香侬指数和辛普森指数的计算采用“vegan”包“diversity”函数完成。Pielou′s 均匀度指数J=H/log(S)。采用“aov”函数进行双因素方差分析,评估施N方式和施N速率对土壤因子和AM真菌alpha多样性指数的影响,分析之前用“stats”包“shapiro.test”函数进行正态性检验,不符合要求的数据进行1次或2次乘方、开方、log或 Box-Cox转化,若转化后仍不满足正态分布,则采用“friedman.test” 函数进行Friedman检验。
施N方式和施N速率对AM真菌群落组成的影响及不同处理间的两两比较,均采用 “vegan” 包“adonis2” 函数进行PERMANOVA分析,距离矩阵为“Bray-Curtis”距离,置换次数设为9999 次。为了实现数据的可视化,使用“vegan”包“metaMDS”函数进行NMDS分析并作图。
2 结果
2.1 施氮对土壤理化性质的影响
在2013年,施N速率对土壤pH值有显著影响(P=0.024)。两个施N速率与对照相比,pH值均显著降低,但是两个施N速率之间没有显著差异。施N方式对土壤pH没有显著影响(P=0.826),而且施N方式和施N速率之间也没有显著交互作用(P=0.929)(表1)。对于其他土壤性质而言,施N方式、施N速率的影响及二者交互作用均不显著(表1)。在2014年,施N方式和施N速率对所有土壤性质参数均无显著影响(表1)。在2015年,施N方式显著影响了土壤pH值(P=0.021)(表1),林下施N土壤pH值(4.21)显著低于林冠施N处理(4.35)。对于其他土壤性质而言,施N方式、施N速率的影响以及二者交互作用均不显著(表1)。2016年和2013年结果基本相同。
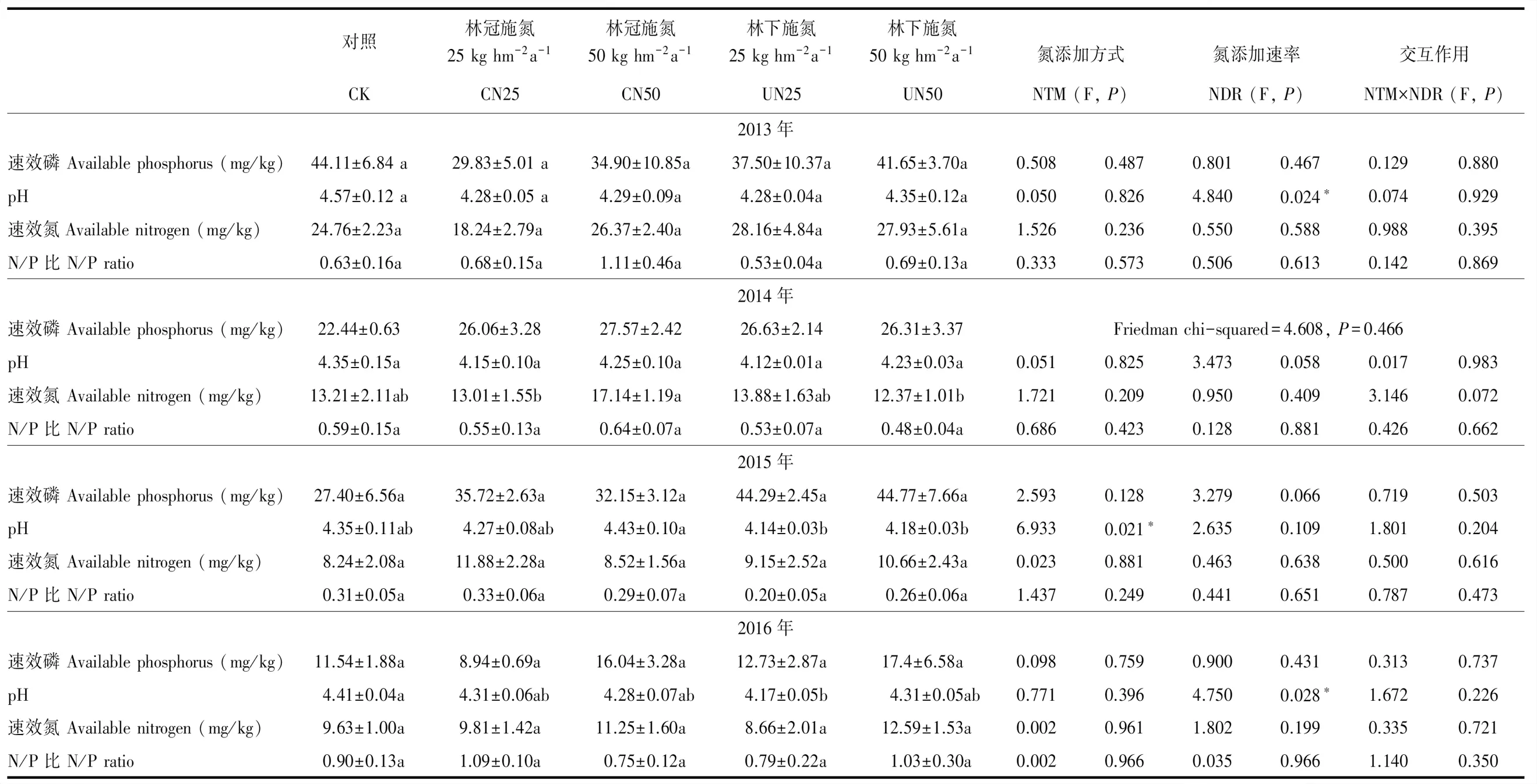
表1 施N方式和施N速率对土壤性质的影响
2.2 高通量测序基本信息及AM真菌OTUs分类情况
对连续4 a共80个土壤DNA样品进行高通量测序,初步得到761939条序列,划分为661个OTUs。经过严格筛选以后,最终确认AM真菌的OTUs为181个,共604890条序列,隶属于1门,1纲,4目,8科,9属,50VT(virtual taxa)。其中,绝大多数的OTUs和序列属于Glomus属,其次为Acaulospora属(图1)。OTUs的代表序列已上传到Genbank数据库(MN559107-MN559287)。序列数过少的3个样品(2014年区组3的CN50处理 33条;2015年区组1的UN50处理 194条; 2016 年区组4的UN25处理 60条),在后续的分析中没有被包括进来,其余样品的序列数均多于1957条。
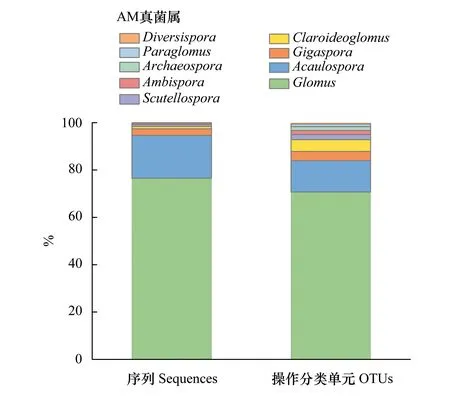
图1 所有土壤样品AM真菌序列和操作分类单元的分布情况 Fig.1 The proportional distributions of AM fungal sequences and derived AM fungal OTUs detected in all soil samples
2.3 施氮对AM真菌alpha多样性指数和群落组成的影响
从2013年到2016年,施N方式、施N速率及二者之间的交互作用对AM真菌alpha多样性指数都没有显著影响(表2)。随着处理时间的延长,不同处理下AM真菌的alpha多样性指数有趋同的趋势(表2)。
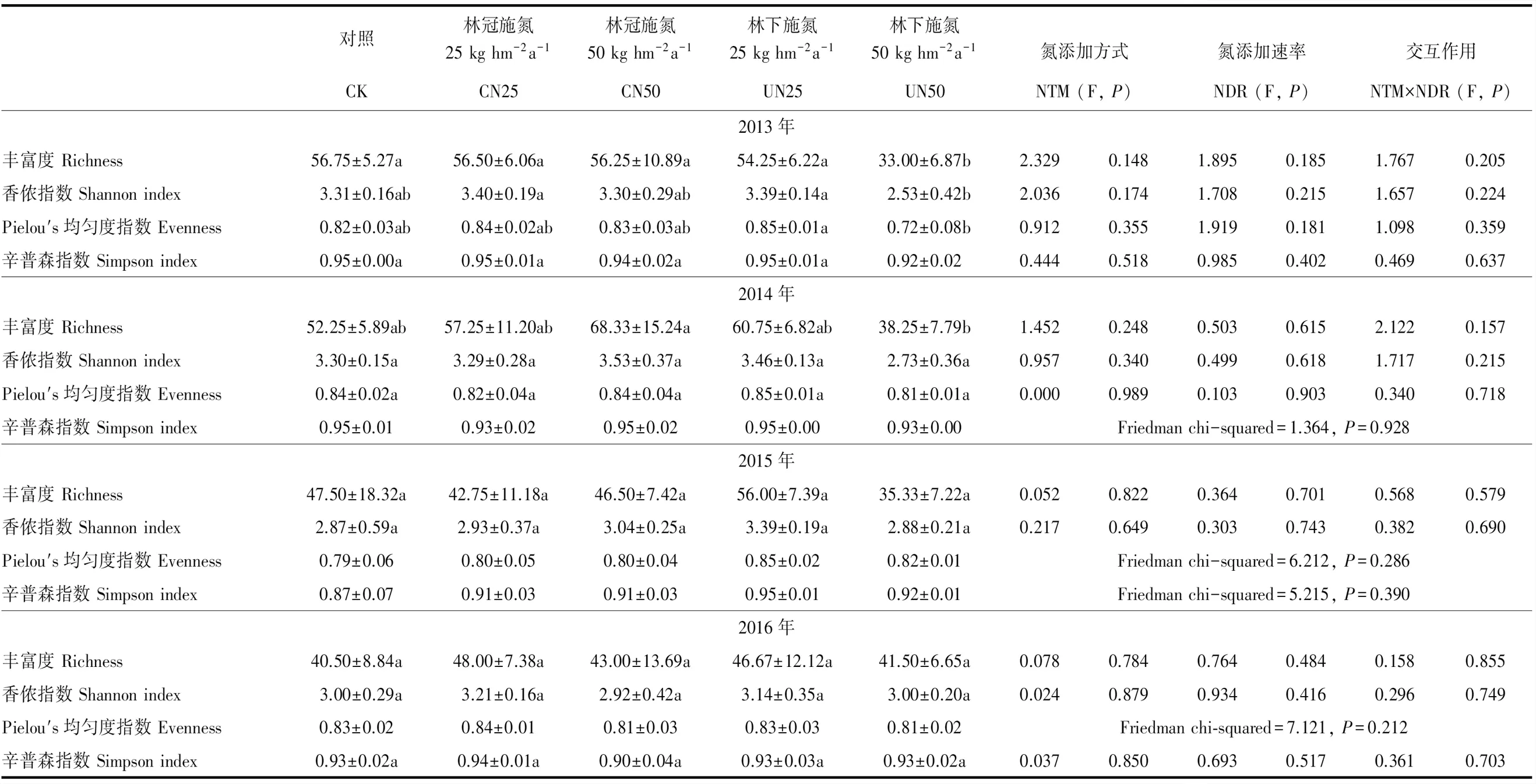
表2 不同年份下施N方式和施N速率对AM真菌alpha多样性指数的影响
在2013年,施N方式对AM真菌群落组成有轻微影响(P=0.052),而施N速率有极显著的影响(P=0.004),且二者之间有显著交互作用(P=0.045)(表3):施N速率为25 kg hm-2a-1时,林冠施N(CN25)与对照差异不显著(P=0.115),林下施N(UN25)与对照差异极显著(P=0.005),且林冠施N(CN25)和林下施N(UN25)相比,群落组成差异极显著(P=0.002)(表4,图2);当施N速率为50 kg hm-2a-1时,林冠施N(CN50)、林下施N(UN50)及对照三者之间均无显著差异(表4,图2)。从2014年到2016年,施N方式和施N速率对AM真菌群落组成都没有显著影响,双因素交互作用也不显著(表3,图2)。
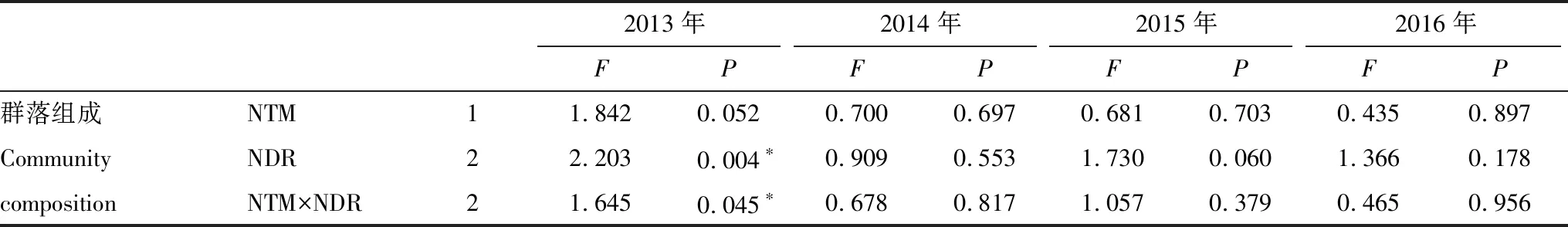
表3 不同年份施N方式和施N速率对AM真菌群落组成的影响
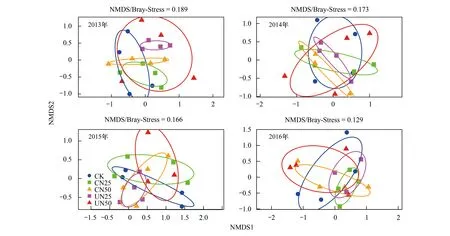
图2 不同处理下AM真菌群落组成Fig.2 The variation of AM fungal community composition among different treatments不同颜色的椭圆代表不同处理下95%的置信区间;CK: 对照;CN25: 林冠施N 25 kg hm-2 a-1;CN50: 林冠施N 50 kg hm-2 a-1;UN25: 林下施N 25 kg hm-2 a-1;UN50: 林下施N 50 kg hm-2 a-1
2.4 AM真菌alpha多样性指数和群落组成的变化与土壤因子变化之间的关系
在目前的时间尺度下,AM真菌alpha多样性指数与土壤因子之间没有显著的相关性(表5)。在2013年,AM真菌群落组成的变化与土壤pH呈显著正相关关系(表6),与其他土壤因子之间无显著相关关系,而从2014年到2016年,所有土壤因子与AM真菌群落组成之间的相关性均未达到显著水平(表6)。
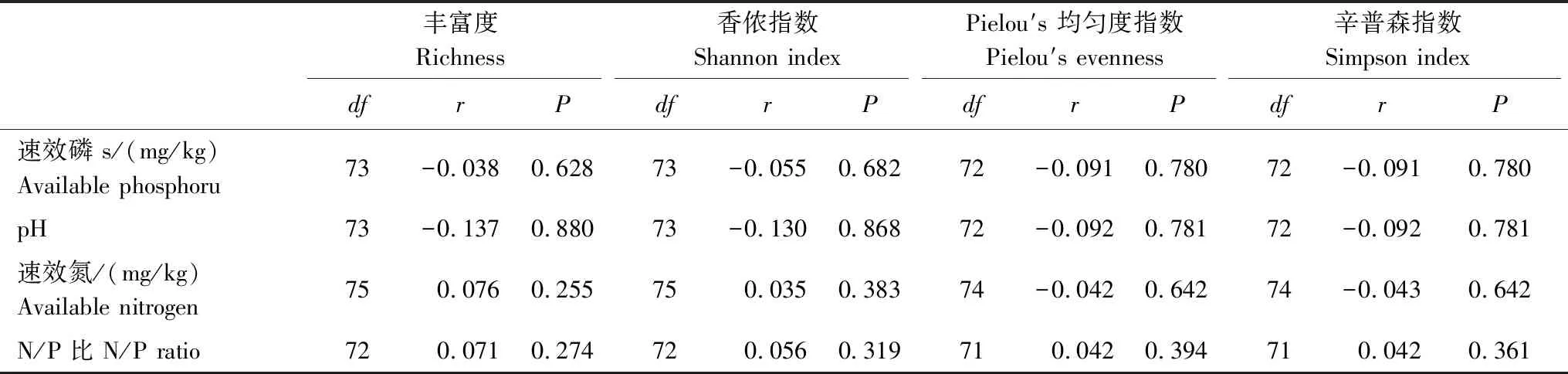
表5 所有样品AM真菌alpha多样性指数与土壤因子之间的Pearson 相关性分析
3 讨论
3.1 氮沉降对土壤理化性质的影响

之前的meta分析表明,不论是在区域尺度上[52],还是在全球范围内[53],温带森林生态系统土壤pH值对N沉降的响应都十分敏感。对于我国森林生态系统来说,N沉降速率<30 kg hm-2a-1也会显著降低土壤pH值[52]。我们的研究也支持此观点,因为在2013年和2016年,低N处理(25 kg hm-2a-1)与对照处理相比,pH值有显著下降。同时,高N(50 kg hm-2a-1)处理与对照相比,pH值也有显著下降,但与低N处理(25 kg hm-2a-1)相比,并无显著差异,这可能是由于本研究区域土壤pH背景值较低造成的。因为Tian 等[53]meta分析表明,土壤pH值的背景值越低,对N沉降的响应越不敏感。而本研究区域的初始pH值为弱酸性(5.0—6.0),所以尽管施N速率增加一倍,土壤pH值并没有很大的改变。
在2015年,林下施N土壤pH值与林冠施N处理相比显著降低,这与Huang等[40]研究结果一致。这一现象说明在特定条件下,林下施N会高估自然N沉降对土壤环境的影响。
3.2 氮沉降对AM真菌alpha多样性的影响
在目前的时间尺度下(4 a),施N方式、施N速率对AM真菌物种alpha多样性指数都没有显著影响,且二者也没有显著交互作用,说明在目前的N素添加水平和时间尺度下,林下施N并没有高估自然N沉降对AM真菌alpha多样性的影响。尽管施N以后土壤pH值有显著下降,但是pH值的变化并没有对AM真菌alpha多样性造成影响。土壤pH值与AM真菌的alpha指数没有明显关系(表5),这与之前该试验平台的研究结果相符[32]。此外,之前的研究还发现,土壤N/P比与AM真菌的丰富度和香侬指数关系密切[32],而在目前的时间尺度下,施N方式和施N速率都没有明显改变土壤N/P比(表1)。我们推测这可能是AM真菌alpha多样性对N沉降没有响应的原因之一。随着处理时间的延长,几种试验处理下AM真菌alpha多样性有趋同的趋势(表2),这可能是森林生态系统土壤AM真菌对持续N素输入产生了适应,也可能和N素添加浓度有关。例如,刘永俊等[54]研究发现,低量施肥(30 g/m2(NH4)2HPO4)对垂穗披碱草(Elymusnutans)根系中AM 真菌物种丰富度没有显著影响,而当施肥量达到为120 g/m2时,施肥表现出极其显著的负面作用。对于土壤真菌来说,N素添加带来的影响还受到试验持续时间的影响[33],如Van Diepen等[25]研究发现,在美国北部森林中,经过连续12年的N素添加,区域A的AM真菌香侬指数有轻微的增加,而区域C有轻微的下降。本研究时间跨度为4 a,那么在更大的时间尺度上,N沉降是否会对 AM真菌alpha多样性产生显著影响还值得进一步研究。
3.3 氮沉降对AM真菌群落组成的影响
在试验早期(2013年),施N方式对AM真菌的群落组成有轻微影响,而且受到施N速率的制约:当施N速率较低(25 kg hm-2a-1)时,林下施N对AM真菌群落组成的影响大于林冠施N,支持了我们的假设;而当施N速率较高(50 kg hm-2a-1)时,两种施N方式都没有显著改变AM真菌群落组成,与我们的假设不一致。这些结果说明在特定试验条件下,林冠施N比林下施N能更好地反应自然N 沉降对AM真菌群落组成的影响,与Huang等[40]的研究结论相似。冠层对N的截留会影响到达地面的N的数量[39],截留的百分比和生态系统类型、N沉降量及研究区域土壤特征有关,少则10%以下,多则70%—80%[41]。在本试验样地内,林冠喷洒的N被冠层截留大概占到一半左右[55],在短时间内,林冠喷洒的N只有一半左右直接到达林下。所以林冠施N 25 kg hm-2a-1(CN25),大致相当于林下施N 12.5 kg hm-2a-1,林冠施N速率为50 kg hm-2a-1(CN50),则大概相当于林下施N 25 kg hm-2a-1(UN25),如此施N方式的问题就基本简化为林下不同施N速率的问题。在Jiang等[56]的研究中,随着施N速率的增加,N添加对AM真菌群落组成的影响也越大。在本研究中,CN25、CN50、UN25与对照相比,P值依次为0.115,0.080,0.005,基本上与Jiang等[56]的研究结果相一致,但是UN50与对照相比差异却不显著(P=0.480),这有可能是因为试验处理重复次数较少,组内的差异可能掩盖了组间差异(图2),所以在空间异质性较大的环境条件下进行控制试验时,需要尽可能地增加重复次数。
从2014年到2016年,不同试验处理之间AM真菌群落组成差异不显著,可能有两方面的原因:(1)AM真菌对N素添加产生了一定程度的适应;(2)试验处理时间还不够长。Van Diepen等[25]研究还发现,经过连续12年的慢性N沉降,枫木 (Acerspp.)根中AM真菌的群落组成发生了显著的改变,因此在更长的时间尺度上,施N是否会对土壤AM真菌群落组成产生影响还需要后续研究。
4 结论
本试验条件下,施氮对落叶阔叶混交林土壤AM真菌alpha多样性没有显著影响,但在试验早期施氮对AM真菌的群落组成产生一定的影响,林下施氮高估了自然氮沉降对AM真菌群落组成的影响。随着处理时间的延长,不同试验处理下AM真菌群落有趋同趋势,这可能是因为AM真菌群落对N沉降产生了适应。本研究评估了不同施N方式对森林生态系统土壤AM真菌的影响,考虑到实验条件的局限性,在未来的研究中需要考虑更多的N素添加梯度和更长的时间跨度,才能够更全面的认识氮沉降的生态效应。

