Wnt/β-catenin、BMP-2/Runx2/Osterix、OPG/RANKL、LGR4/RANKL通路的相关因子在绝经后骨质疏松性骨折中的表达
王斌 麦彩园 谢胜德 曹燕明 汪志中 李新旭 徐茂森
1.佛山市三水区人民医院创伤骨科,广东 佛山 528100 2.广东省妇幼保健院产科,广东 广州 510010 3.广州医科大学附属第二医院骨科,广东 广州 510260
目前我国骨质疏松症(osteoporosis,OP)患者已超过7 000万,50岁以上女性患病率为20.7%[1]。绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)的发病率为未绝经女性的2~3倍[2]。绝经后骨质疏松性骨折(postmenopausal osteoporotic fracture,PMOPF)是PMOP的严重后果,可显著增加患者的致残率、病死率,并带来较大的家庭、社会经济负担[3]。因此,研究骨质疏松性骨折(osteoporotic fracture,OPF)的发病、愈合因素,有效的解决研究OP及OPF的发病机制及影响因素及治疗成为科研及临床的重点[4]。成骨、破骨是研究、防治OP的热点,Wnt/β-catenin通路中LRP5、β-catenin、Runx2、C-myc是关键的成骨因子[5-6]。BMP-2/Runx2/Osterix通路中Runx2、Osterix也是关键的成骨因子[7-8]。OPG/RANKL通路中OPG、RANKL是关键的破骨因子[9]。LGR4/RANKL通路中LGR4、RANKL是关键的破骨因子[10]。本研究采用RT-qPCR方法分析检测PMOPF骨组织LRP5、β-catenin、Runx2、C-myc、Osterix、OPG、RANKL、LGR4水平。ELISA技术检测PMOPF血清LRP5、β-catenin、Runx2、C-myc、Osterix、OPG、RANKL、LGR4水平,并用ELISA进一步检测PMOPF组分时段各因子的水平,探讨PMOPF及PMOP的发病机制和影响因素。
1 材料与方法
1.1 研究对象、受试基本条件
本试验挑选2018年1月至2019年12月佛山市三水区人民医院创伤骨科就诊的闭合胫骨骨折女性患者68例(对照组31例和PMOPF组37例),伤后1 d内行骨折内固定手术。患者伤前完全民事行为能力及活动能力正常,无精神、认知障碍,需切开或者有限切开复位内固定术,同意为本实验研究受试,签署知情同意书等相关事项。入院后登记姓名、年龄(岁)、身高(cm)、体重(kg)等各项资料,所有患者入院后术前检测骨密度及T值;骨转换标志物β-CTX、PINP、N-MID-OT、25(OH)D;雌二醇。
1.2 入组标准
1.2.1PMOPF组入组的标准:满足前述的基本条件及不满足后述的排除标准;DXA测骨密度T值≤-2.5,诊断为PMOP。
1.2.2对照组入组的标准:满足前述的基本条件及不满足后述的排除标准;DXA测T≥-1.0。
1.2.3排除标准:伴有严重慢性疾病;导致继发性PMOP的内分泌性等代谢异常的疾病;1年内接受药物或激素治疗;手术不需要显露骨折端或者很难取骨;骨折断端硬度大、松质骨少。
1.3 标本收集
所有患者伤后1 d内(术前)行骨折内固定术,术中于骨折端刮取骨组织≥100 mg,保存于液氮中,再转深低温冰箱(-80 ℃)内保存。对照组患者伤后1 d内(术前)采集空腹外周静脉血,离心后血清放入深低温冰箱内保存。PMOPF组患者根据受伤后血液标本采集时间分为A组(1 d内、术前)、B组(2~3 d)、C组(4~7 d),D组(8~14 d),E组(15~28 d),F组(29~42 d),保存同对照组。
1.4 实验主要仪器和试剂
1.4.1仪器:双能X线骨密度仪(DXA):Discovery-Wi型数字化型,美国Hologic公司;紫外分光光度计:美国Nano Drop Technologies公司;PCR 仪、荧光定量PCR仪:美国伯乐公司;血液分析仪:罗氏COPAS6000型(日本东京)。
1.4.2试剂: PrimeScript RT Master Mix、SYBR Premix Ex Taq Ⅱ、RNAiso Plus: Takara公司;引物:Takara公司;ELISA试剂盒:德国Immundiagnostik公司。
1.5 RT-qPCR过程
1.5.1RNAiso Plus方法提取骨组织总RNA及定量:取骨标本100 mg,用液氮研磨匀浆,移至1 mL RNAiso Plus液的EP管,加入氯仿0.2 mL,将水相上层移至无RNA酶离心管中。加等体积异丙醇,离心后移去上清,加1 mL的75%乙醇。混匀,离心5 min后弃去上清,室温干燥10 min。加入无RNA酶水40 μL,得到RNA溶液。读取OD比值介于1.9~2.0。
1.5.2RT-PCR和实时荧光定量分析:1×Total RNA 1 μg,5×PrimeScript RT Master Mix 2 μL,RNase Free ddH2O up to 10 μL,混均匀后行反转录反应,用Primer Premier5.0设计、Takara公司合成的引物(序列见表1),SYBR Premix Ex Taq Ⅱ(Tli RNaseH Plus)(2×)7.5 μL, PCR Forward Primer(10 μmol/L)0.5 μL,PCR Reverse Primer(10 μmol/L)0.5 μL, RT反应液(cDNA溶液)2 μL,灭菌蒸馏水4.5 μL, Total 15 μL。预变性Repeat:98 ℃,1 min,PCR反应Repeat 40 cycles:98 ℃,15 s;60 ℃,10 s;72 ℃,30 s。选用GAPDH为内参基因,使用qPCR仪自带软件计算所有样品的Ct值,用2-ΔΔCT表示PMOPF组因子对比对照组表达变化的倍数。
1.6 ELISA检测过程
按照试剂盒使用说明书配制标准品和对照品,绘标准曲线,酶标板加样并按要求孵育,再测量450 nm处的OD值,按标准曲线计算样品中检测物的浓度。
1.7 统计学分析
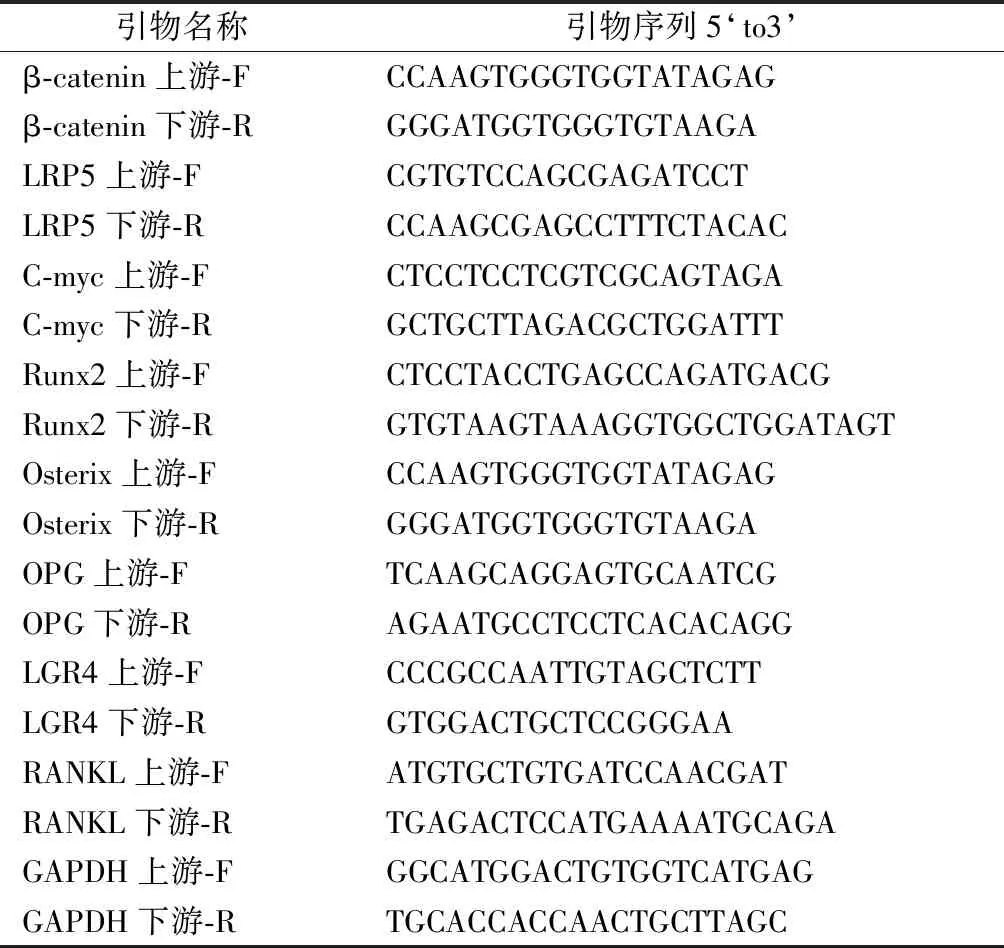
表1 引物序列Table 1 Primer sequences
2 结果
2.1 患者的一般资料、骨转换标志物比较
从表2可以看出,两组年龄、身高、体重无差异性(P>0.05)。PMOPF组BMD较正常组降低(P<0.05),对照组T值正常,PMOPF组T值<-2.5,符合分组的规律。

表2 对照组与PMOPF组一般资料比较Table 2 Comparison of general data between control group and PMOPF group
两组间比较β-CTX、PINP有统计学意义(P<0.05);N-MID-OT、25(OH)D、雌二醇比较差异没有统计学意义(P>0.05)。符合骨转换标志物等指标在两组的水平变化,见表3。

表3 对照组和PMOPF组骨转换标志物等的比较Table 3 Comparison of bone turnover markers between control group and PMOPF group
2.2 各组患者血清、骨组织各因子检测表达比较
ELISA法检测PMOPF组中A、B、C、D、E、F 6组与对照组各因子血清水平(表4、图1)

表4 对照组和PMOPF组各因子表达水平的比较Table 4 Comparison of factor expression levels between control group and PMOPF group
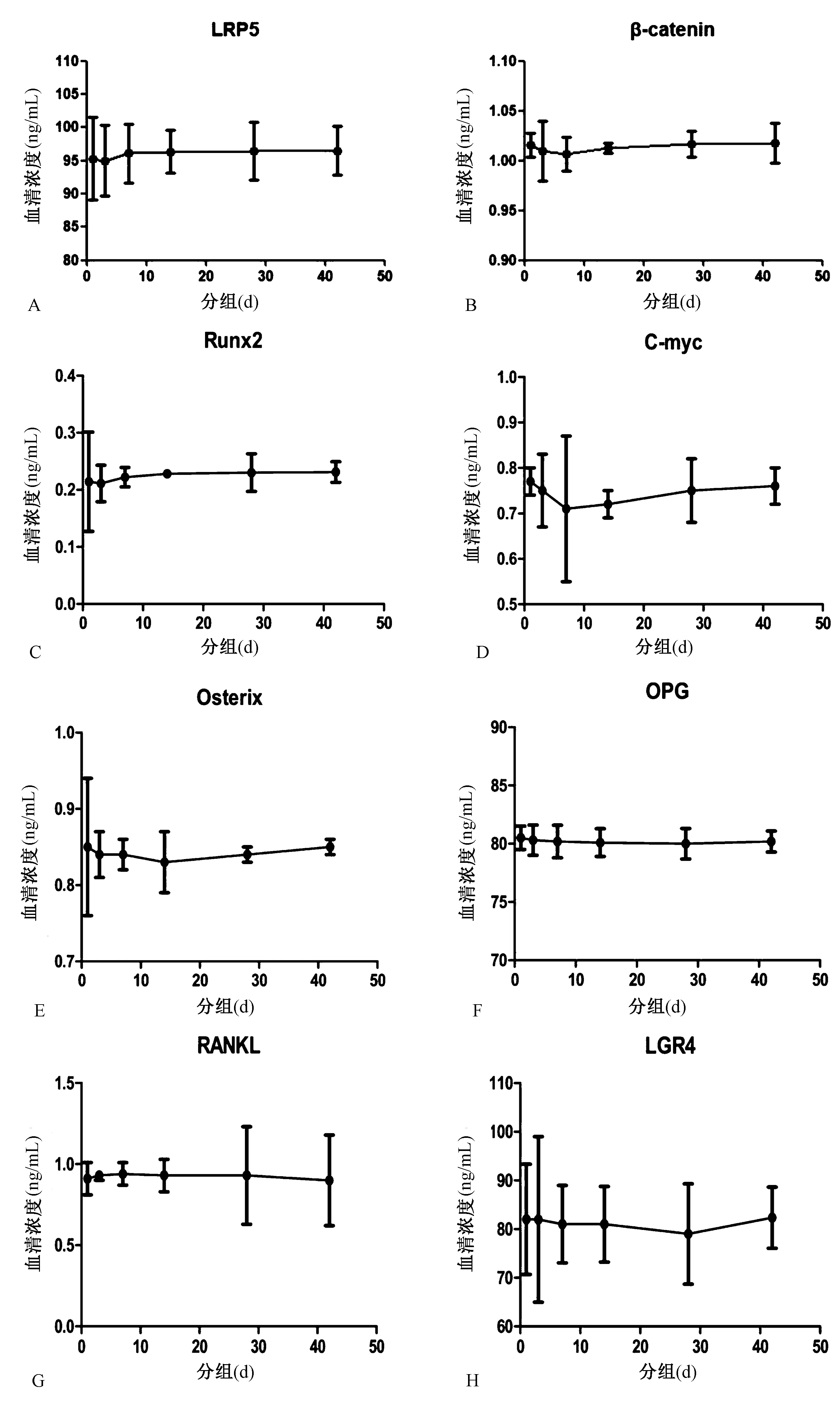
图1 PMOPF组各个因子在A、B、C、D、E、F组血清水平的折线图Fig.1 Line diagram of serum levels of each factor in PMOPF group in group A, B, C, D, E, and F
ELISA法检测PMOPF组(A、B、C、D、E、F 6组的因子)相比对照组血清中LRP5、β-catenin、Runx2、C-myc、Osterix、OPG、LGR4水平明显下降(P<0.05),RANKL水平明显上升(P<0.05)。各因子在分时间段中的表达水平显示:LRP5、Runx2在B组(3 d内)最低,β-catenin、C-myc在C组(4~7 d内)最低,RANKL在C组(8~14 d内)最高,Osterix在D组(8~14 d)最低,OPG、LGR4在E组(15~28 d)最低,见折线图所示。各因子与A、B、C、D、E、F六组中的其它时段的因子比较上升、下降幅度较小(P>0.05),差异无统计学意义。
RT-qPCR法检测PMOPF组较对照组骨组织中LRP5、β-catenin、Runx2、C-myc、Osterix、OPG、LGR4水平明显下降(P<0.05),RANKL水平明显上升(P<0.05)。见图2。
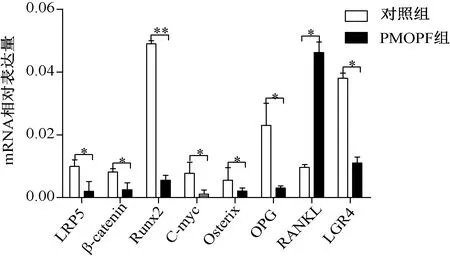
图2 对照组和PMOPF组各个因子的mRNA相对表达值Fig.2 mRNA expression of factors in control group and PMOPF group
3 讨论
绝经后骨质疏松症是由于女性绝经后体内雌激素水平迅速下降破骨细胞(OC)导致的骨吸收大大增加,而成骨细胞(OB)却未相应增加,导致骨吸收大于骨形成引起的代谢性疾病[11]。在调控成骨和破骨中主要包括Wnt/β-catenin[5-6]、BMP-2/Runx2/Osterix[7-8]、OPG/RANKL[9]、LGR4/RANKL等通路[10]。基于骨折愈合的组织学观察和分子学研究,骨折愈合早期又分为早期炎症反应期、非特定合成代谢期(骨折后3 d内)、非特定分解代谢期(骨折后3 d至1周)和更多骨组织的特定合成代谢期(骨折1周以后);而骨折全部愈合分为三阶段:血肿机化期、原始骨痂形成期、骨痂改造塑形期,其中血肿机化期约在骨折后2~3周内完成[12-13]。故本研究将PMOPF组血清检测时再分为A组(1 d内)、B组(2~3 d)、C组(4~7 d),D组(8~14 d),E组(15~28 d),F组(29~42 d)。
典型的Wnt/β-cateinin信号通路中当Wnt信号关闭时,游离的β-catenin和GSK-3β结合出现磷酸化,之后降解,胞质中β-catenin浓度较低,当Wnt通路被激活,Wnt和LRP5/6、Frizzled结合成复合体,从而招募Dvl及降解复合物,抑制GSK-3β对于β-catenin的磷酸化。未磷酸化的β-catenin积累到一定的量就会进入细胞核与TCF/LEF结合,从而激活下游靶因子Runx2、C-myc等转录表达[5,14]。
LRP5存在于多种细胞膜表面[15]。有研究发现LRP5缺失后OB功能和增殖受阻,使骨形成受影响[16]。Andrei等[17]研究认为LGR5可通过Wnt/β-catenin介导激动剂R-海绵体信号调节胚胎模式和干细胞增殖。本实验发现PMOPF组LRP5的表达明显减少,考虑PMOP患者LRP5水平下降,与OP成骨受限相关,也可能存在很多因子比如骨硬化蛋白会与LRP5/6结合,使Wnt/β-catenin通路抑制,引起骨形成受阻[18]。β-catenin是Wnt/β-catenin信号通路最关键的因子,它本身或者通过激活下游的种种因子可以影响OB及其相关的表达。Hill等[19]发现在小鼠的BMSCs中敲除β-catenin基因后其生成软骨增加而OB减少,揭示了β-catenin对早期MSCs向OB定向分化的必需性。β-catenin在PMOPF组内表达降低,表明Wnt通路处于抑制的状态,可能是OP的原因之一,这种状态反映了PMOPF后成骨不足。Runx2是成骨过程中最早、特异性极强的标志因子,是决定骨脆性的关键因素,在骨形成和骨发育中是一个必须的基因,Runx2能上调OB中存在的各种矿化相关蛋白基因的转录[20-21]。有研究证实激活Wnt/β-catenin通路可直接调节骨关键因子Runx2,加强成骨的分化,加快骨折的愈合[22]。本实验PMOPF组Runx2明显降低,说明Runx2的表达低可能是影响PMOPF的重要因素。C-myc是Wnt/β-catenin通路下游的重要因子。有实验用Wnt-3a蛋白感染iSCAP细胞后发现C-myc基因表达会上调[23]。C-myc促进细胞周期由G1进入S期,促进OB分化增殖[24]。本实验检测发现C-myc在PMOPF组中表达下降,说明C-myc作为Wnt下游靶因子,进一步从核内转录水平表明OP内的Wnt通路的成骨不足或处于抑制状态。
本实验中LRP5、β-catenin、Runx2、C-myc在PMOPF组中表达均降低,说明4个因子在Wnt/β-catenin信号通路中的成骨作用一致,符合它们在通路中正相关和互相促进的密切相互作用。有研究显示LRP5通过激活Runx2的表达进而调节成骨细胞发育和骨质形成[22]。LRP5、Runx2均在骨折3 d内水平降至最低,之后出现上升,说明它们在成骨阶段中的变化一致。Yan等[25]研究表明β-catenin在骨折修复不同的阶段具有不同功能。β-catenin可通过抑制糖酵解及谷氨酰胺抑制其下游目标C-myc,可使其表达下调[26]。胞浆β-catenin的浓度决定了与核内C-myc的表达能否被激活[24]。β-catenin、C-myc均在骨折7 d内降至最低然后升高,两因子的同步性与相关的研究成一致。同一个通路4个因子升高幅度太小(差异无统计学意义),可能与PMOPF较难短期内愈合有关。
BMP-2/Runx2/Osterix通路包括BMP-2/p38MAPK/Runx2/Osterix和BMP-2/Smads/ Runx2/Osterix两条通路。经Smads通路中,Smads蛋白家族可将TGF-β信号从细胞膜传递至细胞核,BMP-2结合某种受体后,细胞表面受体-II可以立刻被激活并使细胞表面受体-I某些区域磷酸化,从而使下游因子Smad1/Smad5/Smad8激活后与Co-Smads形成复合体,共同转移至胞核内调节靶基因转录,诱导Runx-2下游基因Osterix的表达,调控OB分化[27]。经p38MAPK通路中BMP-2因子与细胞表面受体-I结合为复合体,再结合细胞表面受体-II一起形成异聚体,进一步激活p38MAPK从而转导增加Osterix的表达使OB增值[28]。Runx2在Wnt/β-catenin、BMP-2/Runx2/Osterix两个通路里均为核心因子并影响成骨,故Runx2的表达量明显增多。Phimphila等[29]研究发现,BMP-2可增强Runx2转录,Runx2可以提供激活BMP-2的必需因子,OB分化可由BMP-2/Runx2轴调控。本实验PMOPF组表达Runx2降低,说明Runx2也可能通过调控BMP-2/Runx2轴对OB分化从而影响OP形成。Osterix为Runx2下游的重要的调控OB的因子,依赖Runx2水平的高低而变化,而且Osterix只在成骨性质细胞中特异性表达[30],MScs在沉积后其中部分分化成为OB的前体,于Runx2的作用之下分化为OB,Osterix在OB的成熟和再分化中具有较大作用;部分沉积的MSc则分化成软骨细胞,在Sox9的作用下分化为软骨[8]。本实验PMOPF组表达Osterix降低,进一步说明Osterix作为Runx2下游的成骨因子,其表达下调影响成骨,可能是导致PMOPF的因素。Kaback等[31]研究表明,在小鼠的骨折模型建立后,它们7 d后有软骨及组织形成,持续第10天并出现Sox9的mRNA水平增加,骨折后14 d Osterix主要在伤处附近的OB中表达,sox9表达减少,此时伤处组织处软骨重塑成为硬骨。大量的研究及临床表现证实BMP具有独特的诱导成骨作用,在骨折后2周完成纤维连接[7-8]。本实验BMP-2/Runx2/Osterix通路中Osterix在D组(8~14 d)最低,与此研究一致。
OPG/RANKL/RANK系统是OC分化中相当重要的信号通路,包括RANKL及其位于OC细胞膜上的RANK和假性受体OPG。OPG与RANKL之间有着很高的亲和力,进而竞争抑制RANKL和RANK间的互相作用,抑制OC分化[9]。OPG可以抑制成熟OC骨吸收、诱导其凋亡,可引起BMD升高[9]。PMOPF内OPG表达下降,说明其竞争抑制OC减弱,促进了OP进一步发生。RANKL是研究发现唯一具有刺激OC分化及成熟,并阻止OC凋亡的因子[32]。本实验发现,PMOPF内RANKL表达上升,说明RANKL促进OC分化引起OP。RANKL在其表达的多种组织中以骨组织中表达最强[33],故本实验中检测PMOPF内RANKL表达上升在骨组织中较血清中更为明显。OPG在骨折28 d内水平降至最低,RANKL在骨折7 d内水平升至最高,之后出现小幅度上升或下降,反映了其在破骨中的变化趋势,也可能存在PMOPF后成骨有所增加抑制了RANKL有关。
在LGR4/RANKL/RANK传导信号通路中,LGR4为RANKL的一个重要的受体。在OC分化过程中LGR4和RANK竞争结合RANKL,抑制典型的RANKL/RANK作用,抑制体内OC分化[10]。Luo等[10]体外研究表明,LGR4缺乏促进OC形成,抑制OC凋亡。实验发现LGR4在PMOPF组中表达下降,推论表明LGR4抑制OC作用减弱,同时RANKL在PMOPF组内表达升高,这符合LGR4和RANK竞争结合RANKL,并抑制RANKL/RANK破骨的作用。LGR4在骨折28 d内水平降至最低,反映了LGR4缓慢持久的变化趋势。LGR4负向调控OC分化可用于治疗OP等疾病[34]。人的全基因组测序也发现LGR4对OPF的作用很大[35]。地诺单抗作为特异性靶向RANK配体的抗体阻断RANKL与RANK的结合导致OC灭活,其作为治疗OP的一线选择的副作用有钙稳态失衡等[36]。而相关研究LGR4-ECD蛋白在小鼠中比OPG与RANKL结合亲和力低,对小鼠的生理负影响小,以上研究说明LGR4拮抗RANKL副作用的优势对治疗OP有很大的价值[10]。
本研究发现PMOPF与Wnt/β-catenin、BMP-2/Runx2/Osterix、OPG/RANKL、LGR4/RANKL通路的相关因子影响成骨、破骨有关,各因子在PMOPF各组中出现分时段变化。因此,可通过干预这些因子水平的变化促进PMOPF愈合,降低其并发症的发生。

