老年2型糖尿病患者单核细胞/高密度脂蛋白胆固醇比值与骨质疏松相关性研究
朱光 陆雨纯 沃眉宏 周晓燕 应长江
1.徐州医科大学,江苏 徐州 221004> 2.徐州医科大学附属医院内分泌科,江苏 徐州 221000
近年来,糖尿病(diabetes mellitus,DM)在世界范围内的发病率不断提高,特别是老年患者,而骨质疏松症(osteoporosis,OP)亦常见于老年人,OP是一类因骨组织微结构受损与骨量下降,使得骨骼脆性提高,易出现多部位骨折的全身性疾病。骨质疏松症日益普遍,但其发作缺乏明显的临床症状,因此很难早期诊断。糖尿病和骨质疏松都属于较常见的慢性疾病,目前尚不完全清楚两者之间的共同作用机制,但许多研究发现糖尿病患者脆性骨折风险明显高于非糖尿病患者[1-2]。国内2型糖尿病(type 2 diabetes mellitus,T2DM)并发OP的患者数量不断升高,此类患者数量达1亿以上,因此对糖尿病病人进行早期骨质疏松的筛查显得尤为重要。目前其诊断主要依靠影像学检查,但该检查大多是由大型医疗中心配置,且价格昂贵,急需一项简便的、早期监测的预测指标,慢性炎症是引发OP的关键病理生理反应,同时也是引起DM以及胰岛素抵抗的关键机制[3]。单核细胞/高密度脂蛋白胆固醇比值(monocyte/HDL-C ratio,MHR)是刚提出时间不久的一类炎性指标[4],它可以反映免疫反应的平衡,有可能是骨质疏松症的可靠,廉价且新颖的标志物。本文回顾性分析临床资料,对老年T2DM病人血清MHR与OP的关联性展开探究,阐释MHR在老年T2DM伴骨质疏松症患者的临床价值。
1 资料与方法
1.1 一般资料
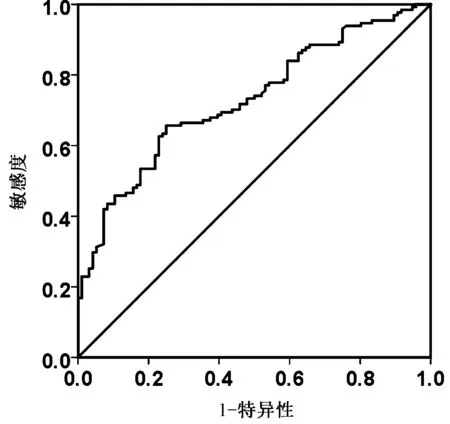
选取2014年1月至2019年12月在徐州医科大学附属医院内分泌科住院的2型糖尿病患者227例。本研究得到患者与患者家属的知情同意,并通过本院伦理委员会审查。所有病人2型糖尿病的诊断符合世界卫生组织糖尿病诊断分型标准。采用双能X线法测定患者BMD,根据BMD值对227例患者进行分组,其中正常组40人,骨量减少组56人,骨质疏松组131人。骨质疏松症的诊断依据WHO1994年推荐的标准进行划分,由软件计算T值,若T值≥-1.0,则判定“正常”;-2.5 排除标准:DM急性并发症、1型糖尿病、感染、长期服用激素或影响骨代谢的药物、甲状腺疾病、甲状旁腺疾病、自身免疫性疾病、恶性肿瘤和严重的心脏、肝脏、肾脏疾病等。 记录各组的性别、年龄、体重、身高、病程、体质指数(BMI),并计算体质指数[BMI=体重(kg)/身高(m)2],禁食8 h后,清晨空腹时抽取患者肘静脉血,检测糖化血红蛋白(HbAlc)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、血钙(Ca)、磷(P)、镁(Mg)、空腹血糖(FBG)、尿酸(UA)、空腹C肽、空腹胰岛素、血清游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、血清促甲状腺激素(TSH)、白细胞数、中性粒细胞数、单核细胞数、淋巴细胞数以及MHR。 本研究共纳入227例研究对象,其中正常组40例,骨量减少组56例,骨质疏松组131例。与正常组比较,骨量减少组的年龄、女性占比、FBG明显升高(P<0.05),骨质疏松组的年龄、女性占比、病程、单核细胞、TC、FBG、MHR、Mg明显升高(P<0.05);与骨量减少组比较,骨质疏松组的年龄、单核细胞、HDL-C、MHR明显升高(P<0.05)。与正常组比较,骨量减少组的体重、身高、白细胞、淋巴细胞、BMI明显下降(P<0.05),骨质疏松组的体重、身高、白细胞、淋巴细胞、LDL-C、BMI、UA明显下降(P<0.05);与骨量减少组比较,骨质疏松组的身高、LDL-C、UA明显下降(P<0.05)。详见表1。 表1 三组之间各指标比较Table 1 Comparison of indicators among the three groups 通过骨密度与MHR的相关性分析发现,MHR与腰椎1、2、3、4及L1-L2、L1-L3、L1-L4、L2-L3、L2-L4、L3-L4、股骨颈、Ward’s三角、大粗隆BMD之间的相关系数依次为-0.217、-0.300、-0.254、-0.228、-0.279、-0.278、-0.269、-0.290、-0.273、-0.251、-0.236、-0.254、-0.257,相关系数均小于检验水准0.05,差异有统计学意义,即MHR与骨密度呈负相关。详见表2。 表2 MHR和不同部位BMD之间的相关性分析 以老年2型糖尿病患者骨质疏松为因变量,拟纳入一般资料、生化指标和炎症标记物为自变量,排除重复计算指标后,进行非条件Logistic回归分析,同时运用向后逐步法筛选变量,最终回归模型纳入年龄、性别、病程、白细胞、TC、LDL-C、FBG、MHR、BMI、UA、Mg等指标。结果表明,在老年2型糖尿病患者中,年龄、性别(女)、MHR、TC是骨质疏松症的独立危险因素。见表3。 表3 老年2型糖尿病骨质疏松症的多因素Logistic回归分析结果 通过ROC曲线检测,MHR的ROC生存曲线下面积为0.728,cut-off值为0.338,灵敏度为0.656,特异性为0.750(95%CI:0.664~0.793)具有较高的诊断价值。详见图1。 图1 MHR诊断糖尿病合并骨质疏松症ROC生存曲线Fig.1 ROC detects the diagnose value of MHR 糖尿病合并骨质疏松症(diabetic osteoporosis,DOP)是指在糖尿病并发骨量减少、骨骼微结构破坏和骨骼脆性增加,具有极高的致骨折及致残率,被认定为糖尿病的慢性并发症之一。糖尿病病人发生骨质疏松的机制可能与低胰岛素水平、血糖控制不良、糖基化终末产物、骨微血管损伤、氧化应激、慢性炎症等有关[5-6]。骨质疏松症是与年龄密切相关的疾病,人口老龄化程度越高,骨量流失和骨脆性增加,骨质疏松发生率升高。本研究也发现年龄越大骨质疏松越严重。另外,本研究发现三组患者女性占比中,骨质疏松组的女性占比明显大于正常组,老年女性容易发生骨质疏松原因可能与雌激素缺乏、慢性炎症有关,既往研究发现,女性更年期后雌激素不足使得骨保护素(OPG)水平降低,会促发骨骼局部炎症,雌激素不足对于炎性细胞因子表达具备促进作用。反之,炎性因子表达增加又可增强破骨细胞活力,由此使得骨量流失加剧,进一步导致骨质疏松的发生[7]。有研究表明破骨细胞的形成、存活和细胞融合取决于胆固醇,高胆固醇水平会损害骨骼健康[8]。本研究发现2型糖尿病患者发生骨质疏松的独立危险因素有年龄、女性患者、总胆固醇水平。此外,本研究还表明骨质疏松组和骨量减少组的FBG明显高于正常组,考虑与长期高血糖导致糖基化终末产物(AGEs)过量生成,抑制成骨细胞的分化,促进破骨细胞的生成[9],而且AGEs可刺激白细胞介素6(IL-6)和血管内皮生长因子A(VEGF-A)的生成,IL-6和VEGF-A与骨细胞的凋亡相关,进而导致OP的出现[10]。尿酸具有一定的抗氧化作用,袁琴等[11]研究发现高尿酸水平对骨密度降低有保护作用,可进一步减少骨质疏松风险,这与本研究结果相一致。 T2DM病人由于血糖升高可引起机体内出现炎性细胞因子增加,而DM并发OP病人的炎性细胞因子表达强度更高[12-13]。本研究结果显示,相较于正常组、骨量减少组,OP病人MHR水平明显增加。MHR被简单地假设为炎性指标(如单核细胞)与抗炎和氧化应激指标(如HDL-C)之比。随着近年来对MHR认识的深入,MHR在糖尿病、冠心病等疾病中的作用也逐渐得到重视。对于MHR与2型糖尿病微血管病变之间的关系国内外已有相关研究[14-15]。有研究发现[16]单核细胞可分泌单核细胞趋化蛋白1(MCP-1),MCP-1可趋化炎症细胞也可诱导阳性端粒酶,导致在巨噬细胞集落刺激因子(M-CSF)刺激下单核细胞产生破骨细胞,增加骨吸收,进一步导致骨质疏松。另一方面,发现 HDL-C能抑制单核细胞活化并抑制单核细胞祖细胞的增殖和分化。HDL-C还通过抑制LDL-C的氧化和巨噬细胞的迁移而表现出抗炎作用[17-18]。MHR具有简便易测的临床优势,但其与骨质疏松关系的研究至今尚未见报道。本组研究通过评估老年2型糖尿病患者MHR水平变化,发现与正常组及骨量减少组相比,骨质疏松症组MHR水平较高(P<0.05),相关性分析提示MHR水平与BMD值存在负相关,多因素Logistic回归分析提示MHR是老年2型糖尿病伴骨质疏松的独立变量之一。通过ROC曲线检测,MHR的ROC生存曲线下面积为0.728,在糖尿病合并骨质疏松症具有较高的诊断价值。 本研究存在一些局限性,首先纳入的患者人数较少,其次缺乏大规模的前瞻性研究给予更为充分的证实,期望能够提高所纳入的医疗中心以及病例数量,对于基础研究增大研究力度,基于分子机制层面剖析MHR水平上调的原因。本研究报道了MHR与2型糖尿病伴骨质疏松症患者的显著相关性,认为MHR由于其低成本,高可用性且易于实施,因此有可能在临床上成为糖尿病合并骨质疏松的诊断常见的生物标志物。1.2 方法
1.3 统计学方法
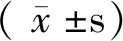
2 结果
2.1 3组临床资料比较

2.2 不同部位骨密度和MHR的相关性
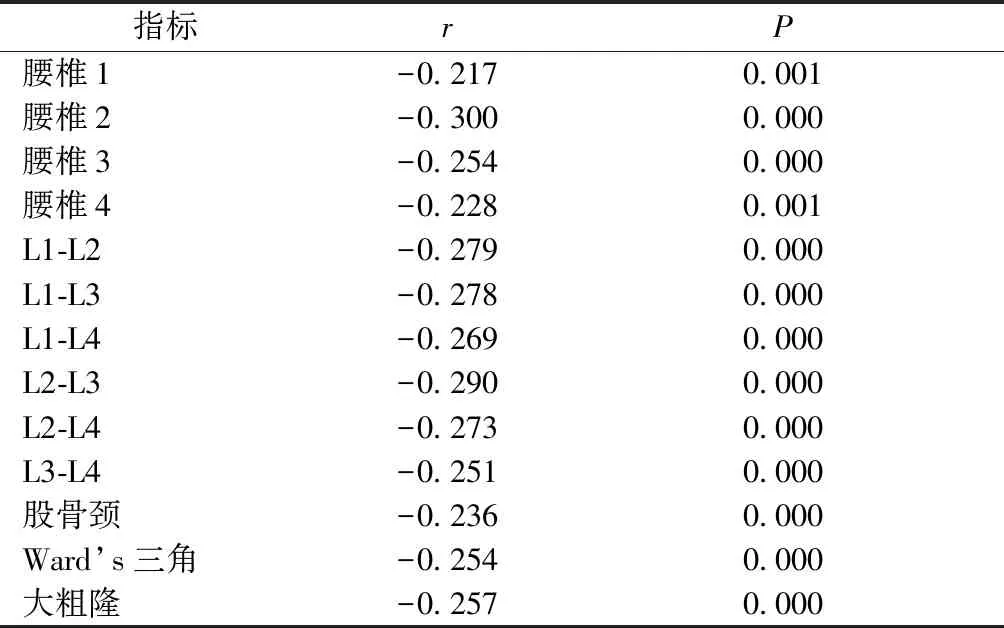
2.3 T2DM合并OP的Logistic回归分析
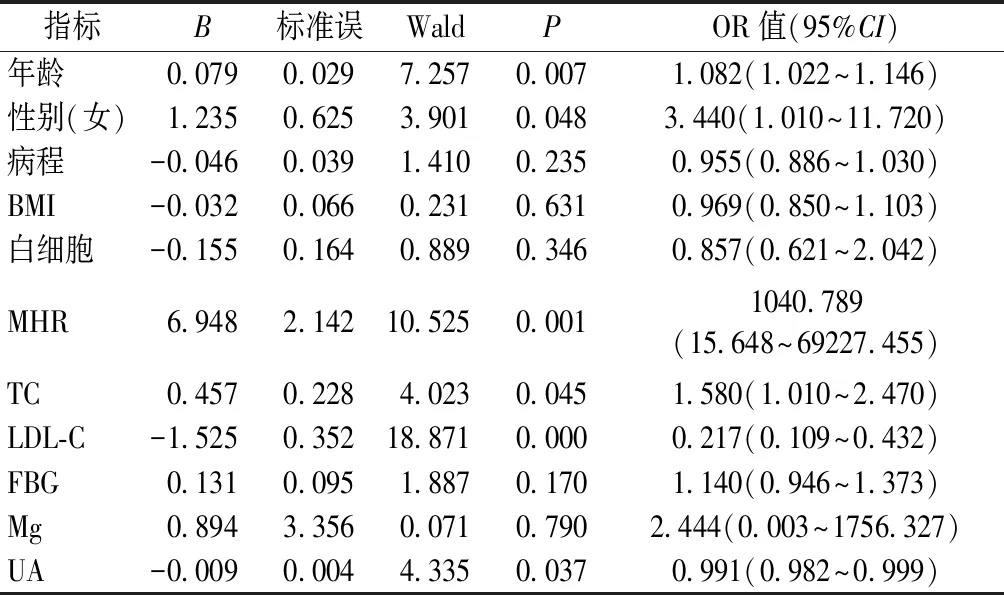
2.4 MHR的诊断价值
3 讨论

