不同种植年限老芒麦根际土壤营养与细菌群落多样性
刘艳君,刘文辉,祁 娟,姚 拓,李建宏,李昌宁
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃 兰州 730070;2.青海省畜牧兽医科学院,青海省青藏高原优良牧草种质资源利用重点实验室,青海 西宁 810016)
老芒麦(ElymussibiricusL.)是多年生疏丛型中旱生草本植物,具有很高的营养价值,产草量高,营养丰富,适口性好、消化率较高,为各类牲畜所喜食[1]。而且老芒麦适应性强,易栽培,具有抗寒、抗旱和耐盐等特性[2]。近年来,该品种在青藏高原东缘生态恢复重建、退化沙化草地治理、三江源保护、退牧还草、种草养畜及人、草、畜三配套等工程建设中发挥着骨干草种的作用[3-4]。
研究表明,植物根际含有大量的营养元素和丰富的微生物群落结构,微生物群落中细菌是最主要的组成成分,生物学特性各异,繁殖速度较快[5],且土壤和细菌之间存在复杂的互作关系,细菌可促进土壤中有机残体的分解和潜在养分的转化,提高土壤供肥能力,释放出的CO2可供植物进行光合作用。同一作物种植年限越长,受自身和过多施肥等外界条件影响越大,土壤理化性质会发生劣变、质量下降;且种植年限过长会引起植物消耗过多养分,不利于保持养分供给平衡,同时引起土壤微生物群落结构失衡,有害真菌的种类和数量增加,细菌的种类和数量减少[6]。目前,国内关于不同种植年限果树、蔬菜、药材土壤养分的报道较多[7-8],关于老芒麦的研究则主要集中在种植行距、播种量、施肥方式、杂草防治等方面[9-10],对于不同种植年限老芒麦根际土壤营养特性和微生物群落多样性方面的报道极少,零星报道表明随着种植年限的延长,出现老芒麦根系分泌物和盐分积累、养分失衡、土传病害加重等一系列问题,形成对老芒麦生长不良的逆环境[4,11]。因此本研究以高通量测序技术研究不同种植年限对老芒麦根际土壤细菌群落多样性和营养指标的影响,采用相关性分析揭示老芒麦根际土壤细菌群落(属水平)和营养指标间的相互关系,以期为老芒麦人工草地科学管理、根际土壤养分改善和根际微生态调控提供理论依据。
1 材料与方法
1.1 研究区概况
试验地位于祁连山系大通山脉西南麓,青海省海晏县国家牧草繁育基地,地处36°54′N,100°59′E,海拔3 159 m,是高原大陆型气候,属高寒地貌,干湿季分明,雨热同季,年平均降水量403.6 mm左右,年蒸发量1 581.75 mm左右,无绝对无霜期[12]。
1.2 样品采集
试验材料为不同生长年限的青牧1号老芒麦根际土壤。以种植3 a老芒麦 (Y3)根际土壤为对照组,4 a生老芒麦(Y4) 和7 a生老芒麦(Y7)根际土壤为试验组。试验地选择坡度、坡向、海拔一致的样方(10 m×10 m),按照对角线法选择长势一致的蜡熟期老芒麦,将其整株挖出,去除根系周围附着土壤,抖落离老芒麦根系1 cm 的土壤即为根际土壤[13]。分别采集Y3、Y4和Y7的根际土壤,每个样品3次重复。剔除可见的动、植物残体和石块后,将取得的土壤装入无菌样品采集袋中,放入采样箱(-4℃)带回实验室。一部分土壤置于室内自然风干,过1 mm及 0.25 mm筛子后用于理化性质测定;另一部分于-80℃保存,用于土壤总DNA 的提取。
1.3 试验方法
1.3.1 土壤pH值和营养指标的测定 土壤理化性质的测定方法参考 《土壤农化分析》[14],其中,土壤理化指标包括土壤pH、有机质(SOM)、全氮 (TN)、全磷 (TP)、全钾 (TK)、速效氮 (AN)、速效钾 (AK)和速效磷 (AP)。
1.3.2 土壤总DNA提取及细菌16S rRNA基因扩增 土壤总DNA 基因组采用DNA提取试剂盒进行提取,参考试剂盒说明书操作,并通过琼脂糖凝胶电泳检测DNA提取质量。将每个土样提取出的3个DNA样品充分混合后作为PCR扩增模版,采用16S rRNA基因V3~V4 区域通用引物338F和806R进行PCR扩增,扩增条件参照Fadrosh等[15]方法进行扩增。PCR扩增产物经2%琼脂糖凝胶电泳检测合格后,送至上海可力梅塔生物医药科技有限公司,采用Illumina Miseq 高通量测序技术进行测序和分析。
1.3.3 生物信息学分析 Miseq测序完成后,得到原始的下机数据,利用overlap将双端数据进行拼接,并进行质控、嵌合体过滤,获得高质量的有效数据。对最终获得的有效数据进行97%的相似度聚类,过滤singleton序列,获得最终的OTU丰度及代表序列,进一步进行多样性分析、物种分类组成分析和差异分析等[16]。
1.4 数据分析
采用SPSS 19.0软件对营养指标的数据进行单因素方差分析(One-way ANOVA),Duncan 新复极差法进行差异显著性检验(α=0.05),表中所有数据为平均值±标准差。用QIIME软件计算Chao1、Shannon 和Simpson指数,用R软件绘制稀释曲线、Venn图及物种分类柱状图。用R软件中psych包的corr.test函数计算细菌群落和土壤营养指标的Spearman相关系数值并检验其显著性,然后用pheatmap包中的pheatmap函数进行可视化。
2 结果与分析
2.1 土壤营养特征变化规律
表1表明,老芒麦种植年限对pH的影响表现为随种植年限的增加而增大,但Y4与Y7间差异不显著。较Y3而言,全氮、速效氮和速效磷含量随种植年限的增加均呈显著降低趋势(P<0.05),连续种植老芒麦4 a和7 a分别可使全氮减少21.9%和34.5%,速效氮减少12.0% 和24.2%,速效磷减少32.0% 和38.9%。有机质、全磷和全钾含量亦随种植年限的增加而降低,老芒麦种植第4年SOM、TP和TK较第3年分别减少28.5%、27.3% 和17.8%,但Y4与Y7之间差异均不显著。速效钾(AK)含量以Y4的含量最高,Y7最低,说明种植老芒麦第4年时对AK的含量贡献最大,种植第7年可使AK的含量减少。
2.2 测序数据分析及OTU量
本研究通过高通量测序共得到有效序列41022 条,质控过滤后得到36308 条优质序列,在97%的相似水平下对序列进行OTUs聚类,共产生6033 个OTUs (系列号:PRJNA562109)。OTUs的稀释曲线均趋于平缓,说明测序数据量已饱和,能够准确反映土壤细菌群落信息(图1)。
从图2可以看出,3个土壤样品所共有的OTUs为1149个,其中Y3、Y4和Y7中所特有的OTUs数目分别为221、101和152个,较Y3而言,Y4和Y7的OTUs出现减少的现象,Y4的OTUs最少。

表1 不同种植年限老芒麦的根际土壤营养指标
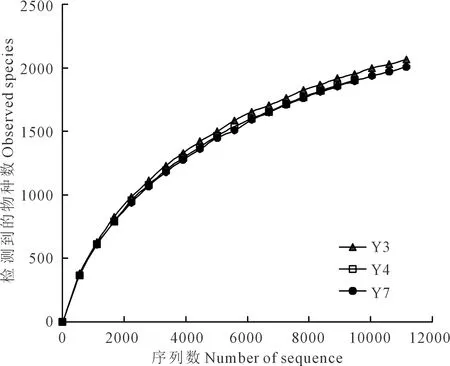
图1 样品稀释曲线Fig.1 Sample rarefaction curve

图2 不同样地根际土壤细菌OTUs数量韦恩图Fig.2 Wenn diagram of the number of bacterio OTUs inrhizosphere soil from different plots
2.3 细菌群落多样性
2.3.1 细菌群落Chao 1指数和Shannon指数的变化 Chao1指数越高表明样品物种丰富度越高,由图3(a)可知,Y3、Y4、Y7的Chao 1指数分别为2 605.42,2 518.46,2 483.89,随着老芒麦种植年限的增加呈下降趋势,表明种植年限越长,老芒麦根际土壤细菌群落的丰富度下降。
Shannon指数越高表明样品物种多样性越高,从图3(b)可以看出,不同年限老芒麦根际土壤细菌群落Shannon指数呈现减小的趋势, Y3、Y4和Y7的Shannon指数分别为9.79,9.65和9.62(P>0.05),表明种植老芒麦4 a以后细菌群落的多样性趋于不变。
2.3.2 细菌群落门水平Unifrac 距离的UPGMA聚类分析 通过对Y3、Y4和Y7样品在门水平上进行加权Unifrac 距离的UPGMA聚类分析(图4),结果显示Y4与Y3样地间细菌组成及丰度相似性基本一致,与Y7样地间差异较大。
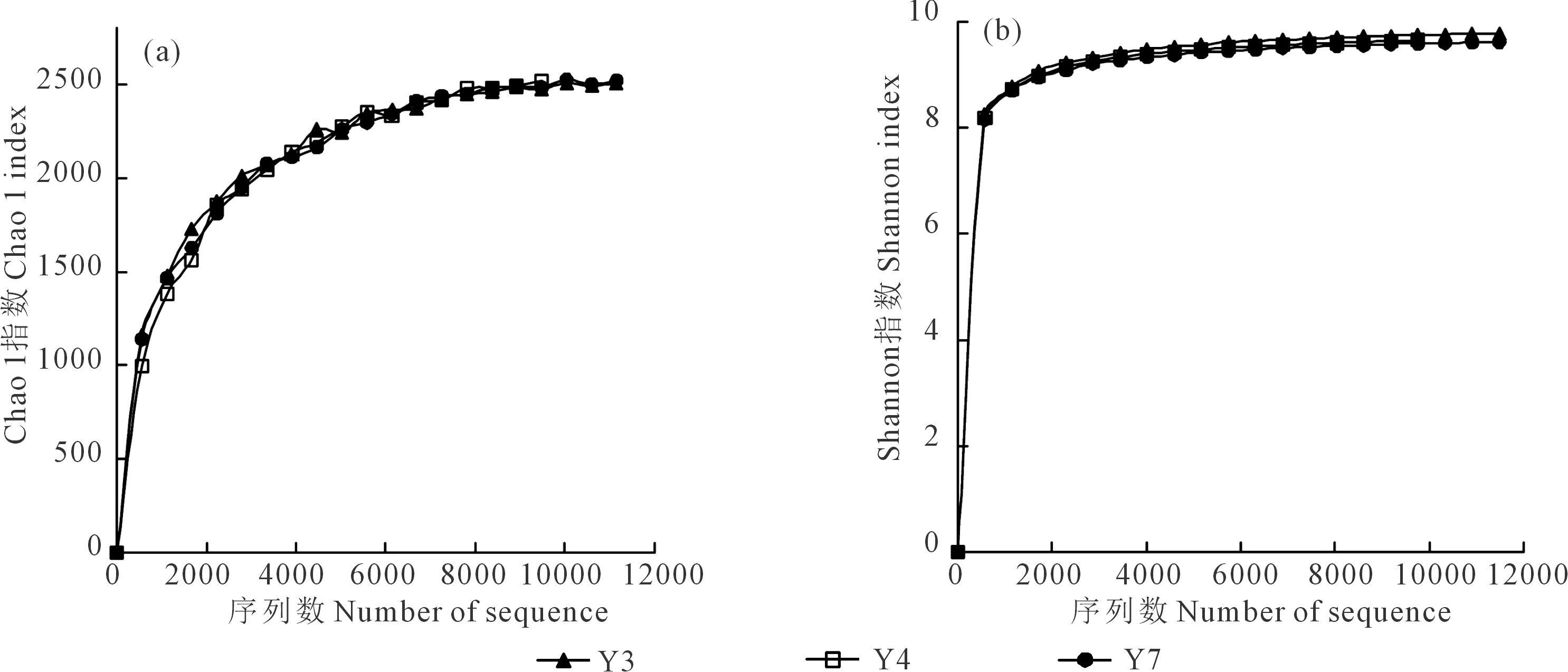
图3 不同种植年限老芒麦根际土壤细菌群落Chao 1 (a)和Shannon (b)指数的变化Fig.3 Changes of Chao 1 (a) and Shannon (b) indices of bacteria community ofrhizosphere soil of Elymus sibiricus in different planting years

图4 门水平上物种组成UPGMA聚类分析Fig.4 UPGMA cluster analysis of bacteria communitycomposition at phylum level
2.4 土壤细菌群落分布特征
2.4.1 细菌群落在门水平上的组成 由图5(a)可见,在门分类水平上,对丰度前20的细菌群落组成进行分析,不同种植年限老芒麦根际土壤细菌群落以变形菌门 (Proteobacteria)、放线菌门 (Actinobacteria)、酸杆菌门 (Acidobacteria)、绿弯菌门 (Chloroflexi)、芽单胞菌门 (Gemmatimonadetes)、拟杆菌门 (Bacteroidetes)、厚壁菌门(Firmicutes)为主。其中变形菌门的丰度以Y7(35.3%)的最高,Y3(31.4%)次之,Y4(28.6%)最低;酸杆菌门以Y4(21.2%)的最高,Y3(17.5%)次之,Y7(17.3%)最低;放线菌门随种植年限的增加而减少,其丰富度在Y3、Y4和Y7中依次为28.6%、26.8%和26.7%;芽单胞菌门随种植年限的增加而增加,Y3、Y4和Y7中的丰富度依次为5.9%、6.6% 和8.0%。
2.4.2 细菌群落在属水平上的组成 图5(b)表明,在属分类水平上,Y3、Y4和Y7中未鉴定的菌属分别为48.4%、52.9%和47.1%,对Y3、Y4和Y7已鉴定的细菌群落丰富度在前20的细菌进行分析,发现优势菌群依次为Norank_c_Subgroup_6、鞘氨醇单胞菌属(Sphingomonas)、Norank_f_Gemmatimonadaceae、芽球菌属(Blastococcus)和RB41。其中Norank_c_Subgroup-6在Y3、Y4和Y7的相对丰度分别为9.4%、11.6%和10.2%,Sphingomonas的相对丰度分别为 5.5%、4.8%和5.1%,Norank_f_Gemmatimonadaceae的相对丰度分别为3.7%、4.3%和5.8%,Blastococcus的相对丰度分别为4.2%、3.7%和3.4%。
2.5 细菌组成与土壤营养指标的Spearman相关性分析
Spearman相关性分析表明(图6),土壤pH与Bacillus、RB41和Norank_f_67-14呈极显著正相关(P<0.001),与Norank_f_Gemmatimonadaceae、Norank_c_Subgroup_6、Cryobacterium、Ellin6055和Ellin6067呈极显著负相关;SOM与Gaiella和MND1呈极显著正相关(P<0.001),与Norank_o_Rokubac-teriales、Norank_c_KD4-96、Skermanella、Solirubrobacter和Candidatus_Alysiosphaera呈极显著负相关;TN、TP和TK 与Norank_o_Rokubacteriales、Norank_c_KD4-96、Skermanella、Solirubrobacter和Candidatus_Alysiosphaera均呈极显著正相关(P<0.001),与MND1和Gaiella呈极显著负相关;AN与Norank_f_JG30-KF-CM45、鞘氨醇单胞菌属、Rubrobacter、芽球菌属和Arthrobacter呈极显著正相关(P<0.001); AP和AK与Candidatus_Alysiosphaera、Skermanella、Solirubrobacter、Norank_c_KD4-96和Norank_o_Rokubacteriales呈显著正相关(P< 0.001),与MND1和Gaiella呈极显著负相关。

图5 细菌群落在门水平(a)和属水平(b)分布特征分析 Fig.5 Analysis of distribution characteristics about bacterial communities at phylum level (a) and genus level (b)
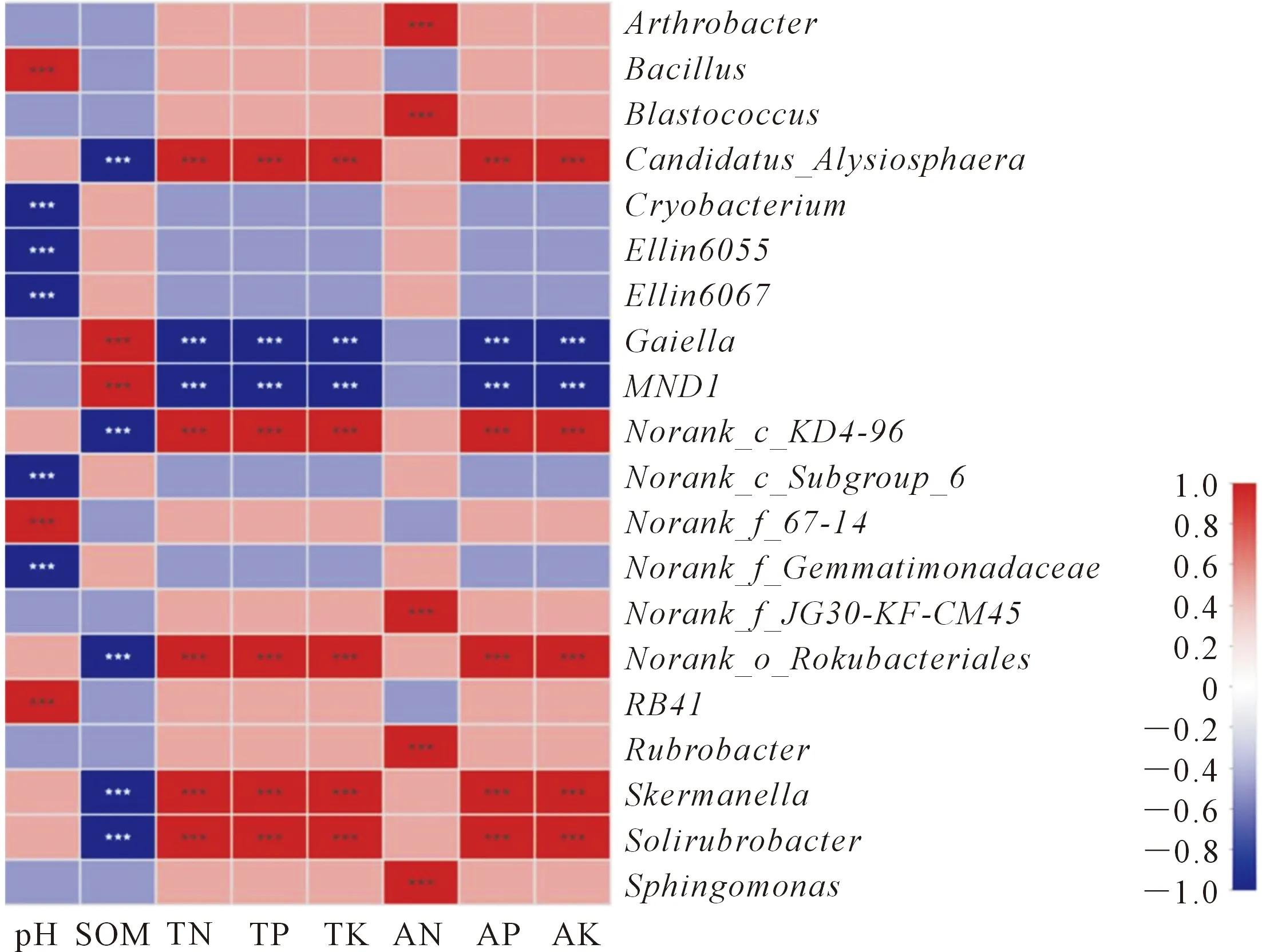
注: X轴和Y轴分别为环境因子和物种,通过计算获得相关性R值和P值。R值在图中以不同颜色表示,若P<0.05则用 * 标出,右侧图例是不同R值的颜色区间; * 表示0.01 作物的连续种植会向土壤释放一系列的次生代谢产物,代谢产物的积累会引起土壤营养指标的恶化并且产生严重的毒害作用[17]。本研究发现老芒麦人工草地4 a以后,随着年限的逐渐延长,土壤根际的全氮、速效氮、速效磷的含量逐渐减少。有研究发现茶树连续种植4 a后可使土壤的全氮、速效磷含量及脲酶的活性下降,致使土壤营养元素缺乏和循环能力降低[7],并且植物的生产力也会受到抑制[18]。 本研究发现,pH随种植年限的增加而增大,这一结论与研究不同种植年限对设施蔬菜土壤pH逐年酸化的结论相反[19]。此外,本研究还发现老芒麦根际土壤有机质、全磷和全钾含量也随种植年限的增加而降低,但Y4与Y7均差异不显著。这说明不同种植年限的老芒麦根际土壤的有机质、全磷和全钾呈现先减少后保持稳定的趋势,究其原因可能是老芒麦人工草地建植的前3年适应能力强,草地的物种组成单一,微生物主要在老芒麦根际进行繁殖及代谢活动,促进了土壤有机质的大量分解,全磷被溶磷微生物所分解,致使全磷的含量减少[7,16],这一研究结论通过相关性分析也得到了证实(图6),如Norank_o_Rokubacteriales、Norank_c_KD4-96、Skermanella、Solirubrobacter和Candidatus_Alysiosphaera均与全磷呈极显著正相关(P<0.001),而MND1和Gaiella与全磷呈极显著负相关。但也有研究发现随着人工草地种植年限的增加,会有大量的杂草不断生长,草地发生演替,植物的丰富度和多样性会逐年升高,植物根际的有机质和全磷被其他的杂草生命活动所利用[20]。 Chao 1指数和Shannon指数分别表示样品中细菌群落的丰富度和多样性,Chao 1值越高表明细菌群落的丰富度越高,Shannon指数越高表明微生物群落的多样性越高[21]。试验发现Y3、Y4和Y7的Chao1指数呈不断下降趋势,表明随种植年限增长,老芒麦根际土壤细菌群落的丰富度下降越明显。Shannon指数的变化趋势与Chao 1相一致。邵颖等[18]研究发现微生物群落的组成和多样性主要与其所处的生境有关,种植年限增加,植物根际分泌的次生代谢物降低了根际生态环境的稳定性,使得根际微生物的数量减少。 本研究发现在门水平上变形菌门和放线菌门的相对丰度均较高且含量大于18%,并且放线菌门的丰度在Y3、Y4和Y7中依次减少,表明老芒麦种植年限的增加不利于放线菌门细菌群落的繁殖,究其原因主要是放线菌门参与土壤中有机质的代谢活动,能将有机质分解为碳源[22],这也与本研究中随着老芒麦种植年限的增加有机质含量减少的结论相似。变形菌门和酸杆菌门由于其不同的生活方式,常被用作衡量土壤营养状况的指标[21],酸杆菌门的相对丰度能够表明土壤的酸性条件[23]。芽单胞菌门的丰度在Y3、Y4和Y7中依次增大,因为芽单胞菌门有很强的脱氮功能,其相对丰度随着氮素水平的增加而降低[24],而本研究中随着老芒麦种植年限的增加,全氮及速效氮的含量均减小。 在属水平上,细菌群落芽球菌属的丰富度随着老芒麦种植年限的增加呈减少趋势,表明老芒麦种植年限会影响芽球菌属的相对丰富度,不利于芽球菌属细菌群落的繁殖,通常芽球菌属可适应干旱、酸性、重金属、抵抗辐射和厌氧等极端环境,可产生孢子,但不容易分离培养,其抗逆境的特性可在环境修复、沙漠治理等方面应用[25-26]。鞘氨醇单胞菌属在Y3、Y4和Y7中的细菌群落丰富度以Y4最低,Y7次之,Y3的丰富度最高,此结果表明,较Y3而言,鞘氨醇单胞菌属的丰富度以第4年下降最快,已有研究表明鞘氨醇单胞菌属的群落在其生命活动中可分泌过氧化氢酶,而过氧化氢酶可分解植物根系分泌的有毒性物质,通常起到解毒作用,被视为植物益生菌[27]。此外,本研究发现在老芒麦根际细菌群落未鉴定菌属丰富度在Y3、Y4和Y7中分别为48.4%、52.9%和47.1%,表明在老芒麦种植的样地中依然存在大量的未挖掘利用的微生物资源。3 讨论与结论
3.1 不同种植年限老芒麦根际土壤肥力特性
3.2 不同种植年限老芒麦根际土壤细菌群落多样性

