阿帕替尼结合替吉奥对晚期胃癌患者血清肿瘤标志物、Th1及Th2类细胞因子水平的影响
张 汯
江西省人民医院胃肠外科,江西南昌 330000
胃癌为临床常见的恶性肿瘤,与长期食用致癌物质、幽门螺杆菌感染等因素密切相关[1]。由于早期症状不明显,多数患者就诊时已属晚期。现阶段,针对该类患者,临床多通过化学药物帮助其控制病情进展,继而延长生存期。替吉奥为氟尿嘧啶衍生物抗癌剂,具有优良的口服生物利用度[2]。阿帕替尼则为新一代口服小分子抗血管生成抑制剂,可有效抑制肿瘤血管生成[3]。本研究通过分析阿帕替尼结合替吉奥对晚期胃癌患者血清肿瘤标志物、辅助性T 细胞1(Th1)及辅助性T 细胞2(Th2)类细胞因子水平的影响,明确阿帕替尼结合替吉奥的应用价值,从而为临床治疗晚期胃癌提供参考,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2017年1月~2019年12月我院收治的80 例晚期胃癌患者的临床资料,根据治疗方法的不同将其分为对照组和观察组,每组各40 例。对照组中,男26 例,女14 例;年龄45~75 岁,平均(61.54±4.98)岁;胃癌TNM 分期[4]:Ⅲ期22 例,Ⅳ期18 例。观察组中,男25 例,女15 例;年龄46~75 岁,平均(61.60±4.94)岁;胃癌TNM 分期:Ⅲ期23 例,Ⅳ期17 例。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经我院医学伦理委员会审核批准。
纳入标准:①患者经细胞学、病理学等检查确诊为晚期胃癌;②患者预计生存期>5 个月,卡氏(KPS)评分[5]>60 分;③患者临床资料完善。排除标准:①患有严重心肝肾等脏器疾病者;②精神疾病、沟通困难者;③对本研究所用药物过敏者。
1.2 方法
两组患者均行常规对症治疗:口服醋酸甲地孕酮片(上海信谊天平药业有限公司;国药准字H20053712;生产批号:20160802、20180504;规格:160 mg/片),1片/次,2 次/d;口服奥美拉唑肠溶胶囊(江苏飞马药业有限公司;国药准字H20066751;生产批号:20160601、20171203;规格:20 mg/粒),20 mg/次,2 次/d;口服盐酸羟考酮片(北京华素制药股份有限公司;国药准字H20090214; 生产批号:20161202、20190101;规格:5 mg/片),5 mg/次,3 次/d。
对照组患者予替吉奥片(福州海王福药制药有限公司; 国药准字H20140020; 生产批号:20160501、20180102;规格:每片含替加氟25 mg、吉美嘧啶7.25 mg、奥替拉西钾24.5 mg)口服,体表面积<1.25 m2者40 mg/次,体表面积1.25~1.50 m2者50 mg/次,体表面积>1.50 m2者60 mg/次,2 次/d,28 d 为1 个疗程,共治疗3 个疗程,每个疗程间隔14 d。
观察组患者在对照组的基础上加用甲磺酸阿帕替尼片(江苏恒瑞医药股份有限公司;国药准字H20140105; 生产批号:20160103、20170902; 规格:0.425 g/片)口服,0.85 g/次,1 次/d,28 d 为1 个疗程,共治疗3 个疗程。
1.3 观察指标
比较两组治疗前后的血清肿瘤标志物、Th1 及Th2 类细胞因子水平。①血清肿瘤标志物:比较两组治疗前后的血清癌胚抗原(CEA)、糖类抗原19-9(CA19-9)、糖类抗原72-4(CA72-4)水平,以FAITH-2000 全自动生化分析仪(南京劳拉电子有限公司)测定。②Th1 及Th2 类细胞因子:比较两组治疗前后的血清白细胞介素-2(IL-2)、γ 干扰素(IFN-γ)、白细胞介素-4(IL-4)、白细胞介素-10(IL-10)水平,以FAITH-2000 全自动生化分析仪测定。
1.4 统计学方法
采用SPSS 25.0 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,两组间比较采用t 检验;计数资料用率表示,组间比较采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者治疗前后血清肿瘤标志物水平的比较
治疗前,两组患者的血清肿瘤标志物水平比较,差异无统计学意义(P>0.05)。治疗后,两组患者的血清CEA、CA19-9、CA72-4 水平均低于治疗前,差异有统计学意义(P<0.05);治疗后,观察组患者的血清CEA、CA19-9、CA72-4 水平均低于对照组,差异有统计学意义(P<0.05)(表1)。
表1 两组患者治疗前后血清肿瘤标志物水平的比较(±s)
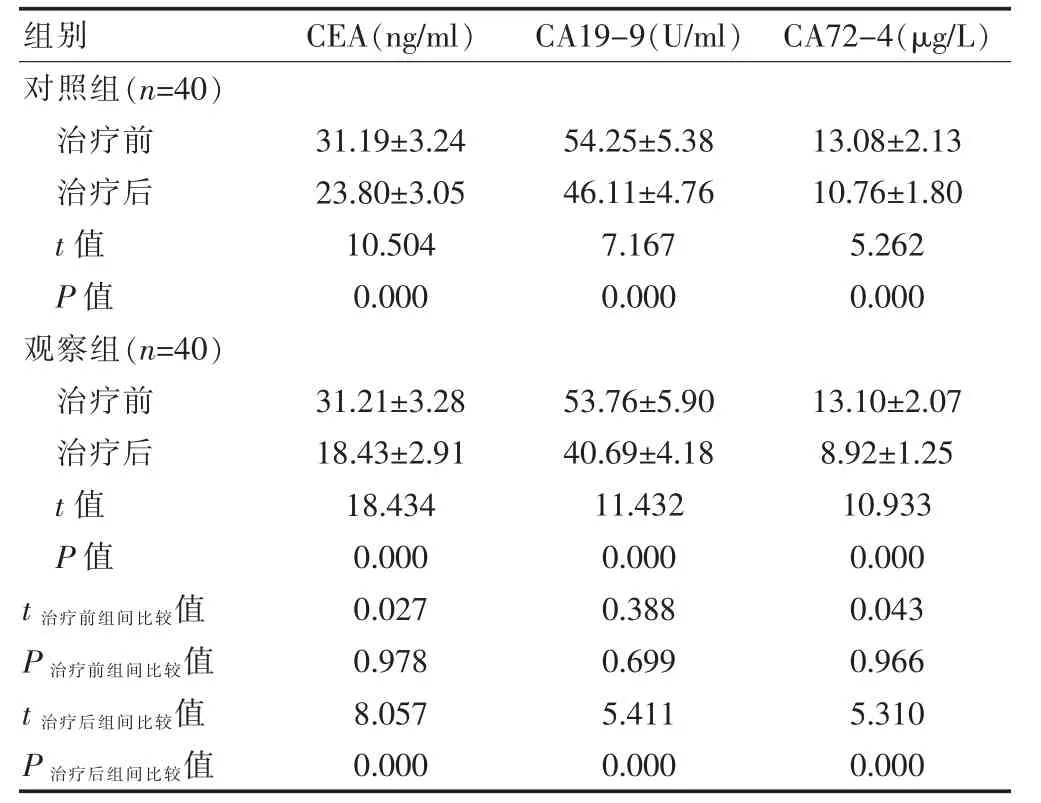
表1 两组患者治疗前后血清肿瘤标志物水平的比较(±s)
组别 CEA(ng/ml) CA19-9(U/ml) CA72-4(μg/L)对照组(n=40)治疗前治疗后t 值P 值观察组(n=40)治疗前治疗后t 值P 值31.19±3.24 23.80±3.05 10.504 0.000 54.25±5.38 46.11±4.76 7.167 0.000 13.08±2.13 10.76±1.80 5.262 0.000 t 治疗前组间比较值P 治疗前组间比较值t 治疗后组间比较值P 治疗后组间比较值31.21±3.28 18.43±2.91 18.434 0.000 0.027 0.978 8.057 0.000 53.76±5.90 40.69±4.18 11.432 0.000 0.388 0.699 5.411 0.000 13.10±2.07 8.92±1.25 10.933 0.000 0.043 0.966 5.310 0.000
2.2 两组患者治疗前后Th1 及Th2 类细胞因子水平的比较
治疗前,两组患者的Th1 及Th2 类细胞因子水平比较,差异无统计学意义(P>0.05)。治疗后,两组患者的IL-2、IFN-γ 水平高于治疗前,IL-4、IL-10 水平低于治疗前,差异有统计学意义(P<0.05);治疗后,观察组患者的IL-2、IFN-γ 水平高于对照组,IL-4、IL-10水平低于对照组,差异有统计学意义(P<0.05)(表2)。
表2 两组患者治疗前后Th1 及Th2 类细胞因子水平的比较(pg/ml,±s)
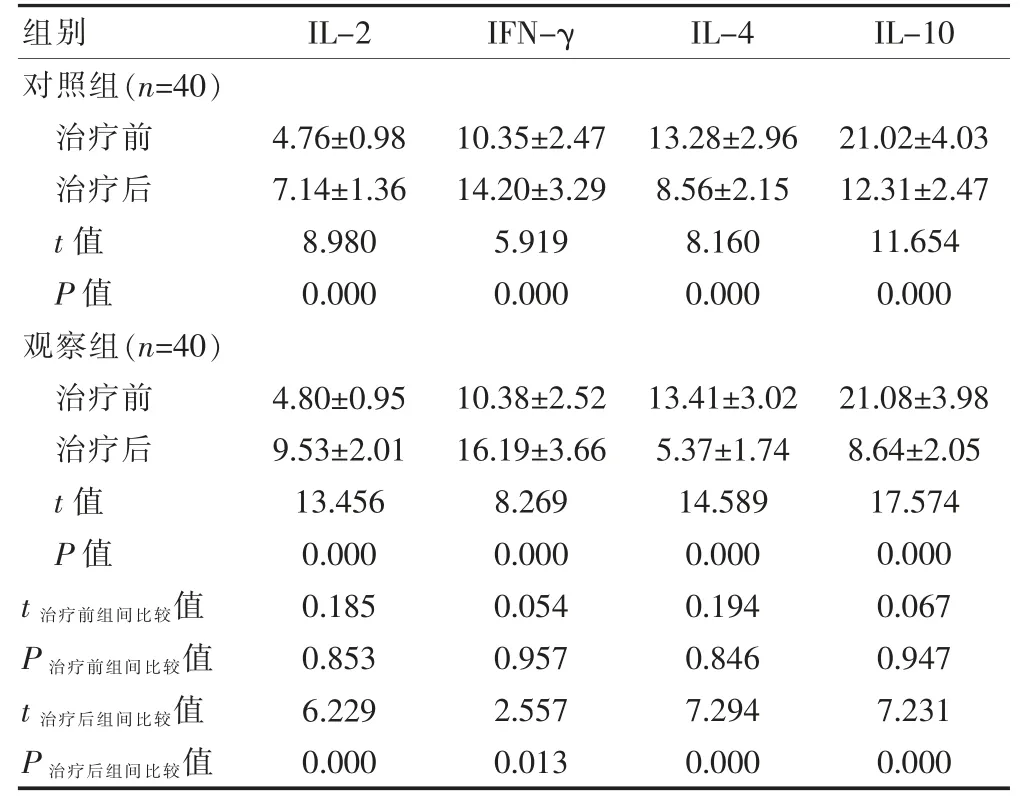
表2 两组患者治疗前后Th1 及Th2 类细胞因子水平的比较(pg/ml,±s)
组别 IL-2 IFN-γ IL-4 IL-10对照组(n=40)治疗前治疗后t 值P 值观察组(n=40)治疗前治疗后t 值P 值4.76±0.98 7.14±1.36 8.980 0.000 10.35±2.47 14.20±3.29 5.919 0.000 13.28±2.96 8.56±2.15 8.160 0.000 21.02±4.03 12.31±2.47 11.654 0.000 t 治疗前组间比较值P 治疗前组间比较值t 治疗后组间比较值P 治疗后组间比较值4.80±0.95 9.53±2.01 13.456 0.000 0.185 0.853 6.229 0.000 10.38±2.52 16.19±3.66 8.269 0.000 0.054 0.957 2.557 0.013 13.41±3.02 5.37±1.74 14.589 0.000 0.194 0.846 7.294 0.000 21.08±3.98 8.64±2.05 17.574 0.000 0.067 0.947 7.231 0.000
3 讨论
目前,对于早期胃癌患者,手术仍然是其首选治疗方式,可有效切除病灶,清扫淋巴结,进而延缓病情进展[6]。但对于手术耐受性较差或肿瘤广泛转移者,临床多通过化疗帮助其延长生存期。常用一线化疗方案为铂类、氟尿嘧啶类两药联合,或在其基础上加用紫杉类药物,以达到增强治疗效果的目的[7]。而对于因不良反应严重或肿瘤细胞对化学药物敏感性低而导致一线化疗失败者,则推荐使用二线治疗方案。
本研究结果显示,治疗后,两组患者的血清CEA、CA19-9、CA72-4、IL-4、IL-10 水平均低于治疗前,IL-2、IFN-γ 水平均高于治疗前,且观察组患者的血清CEA、CA19-9、CA72-4、IL-4、IL-10 水平低于对照组,IL-2、IFN-γ 水平高于对照组,差异有统计学意义(P<0.05),提示阿帕替尼结合替吉奥治疗晚期胃癌效果显著,可调节患者血清肿瘤标志物、Th1 及Th2 类细胞因子水平,缓解其临床症状。分析其原因为替吉奥主要成分为替加氟、吉美嘧啶以及奥替拉西,其中替加氟经代谢可产生5-氟尿嘧啶(5-FU),其作用机制为抑制脱氧嘧啶核苷酸转换成胸腺嘧啶核苷酸,干扰脱氧核糖核酸以及核糖核酸的合成,进而阻碍肿瘤细胞复制[8];吉美嘧啶可特异性拮抗5-FU 被二氢嘧啶脱氢酶所分解这一过程,延长血液及肿瘤组织内5-FU的有效深度[9];而奥替拉西则可通过阻断5-FU 的磷酸化,影响5-FU 在体内的分布,进而降低其毒性[10]。
CEA 为广谱性肿瘤标志物,其异常表达多提示存在恶性病变;CA19-9 在血清中以黏蛋白的形式存在,其水平升高与消化道肿瘤密切相关;CA72-4 是一种高分子糖蛋白类癌胚抗原,其水平升高多见于恶性肿瘤[11-12]。而Th 细胞对于机体的免疫系统则具有重要意义。大量临床实验发现,在胃癌患者体内,Th2 类细胞普遍占优势地位[13]。阿帕替尼通过选择性竞争细胞内血管内皮生长因子受体-2(VEGF-2)的腺嘌呤核苷三磷酸结合位点,阻碍下游信号传导,抑制VEGF-2 的磷酸化,从而控制肿瘤组织新血管生成,降低甚至阻断肿瘤细胞血供,促使其萎缩、坏死,进而达到抗肿瘤的效果,调节血清肿瘤标志物水平[14]。此外,该药可影响肿瘤细胞内线粒体的正常功能,诱导肿瘤细胞凋亡、分化。与替吉奥联合应用,有助于增强机体免疫监视及清除变异细胞的能力,加快胃粘膜上皮细胞自我修复,进而促进Th1 类免疫细胞因子的优势表达,下调Th2 类细胞因子水平[15]。
综上所述,阿帕替尼结合替吉奥治疗晚期胃癌效果显著,可调节患者血清肿瘤标志物、Th1 及Th2 类细胞因子水平,减轻其临床症状,值得推广使用。

