豌豆分离蛋白-羧甲基纤维素纳静电复合物在乳液中的应用研究
庞淑婕,李娜娜,任 思,刘丽娅,*,佟立涛,王丽丽,周闲容,周素梅,*
(1.中国农业科学院农产品加工研究所,农业部农产品加工重点实验室,北京 100193; 2.江南大学食品学院,江苏无锡 214122)
豌豆是重要的豆科作物,豌豆产值占豆类作物总产值的36%[1]。豌豆富含蛋白质(20%~25%)[2-3],豌豆分离蛋白(Pea protein isolate,PPI)氨基酸组成平衡,且赖氨酸含量丰富[4],同时具有低致敏、非转基因的特点[5],且有益于降低心脑血管等慢性疾病的发生的风险[6]。因此近年来被作为优质的植物蛋白资源应用于食品工业中,尤其是高浓度豌豆蛋白饮料和酸奶产品受到越来越多的关注。
与其它豆类蛋白相似,豌豆蛋白在饮料和酸奶体系中常作为乳化剂、起泡剂,其功能特性与pH、温度、离子强度等环境因素和加工方式有关[7-8]。然而,酸性饮料和酸奶的pH一般在4.2左右,该pH正好接近豌豆蛋白的等电点(约为pH4.6)。因此豌豆蛋白在这类体系中应用时溶解性和乳化性不佳[9],体系常通过多种机制发生失稳[10],主要表现为脂肪上浮、蛋白絮凝沉淀等,严重影响了产品的食用品质和货架期[11]。
阴离子多糖常被添加到蛋白稳定的酸性乳饮料中,提高蛋白质的稳定性。邱荣[12]研究表明阴离子多糖能够附着在油滴包裹的蛋白质表面,部分结构深入两相中,通过增强液滴间静电排斥或空间位阻,提高乳液的稳定性。然而,在一定条件下,少量的多糖则会导致蛋白乳液体系发生桥连絮凝作用,反而加速乳液失稳[13]。羧甲基纤维素钠(CMC)是 D-吡喃葡萄糖通过β-1,4-糖苷键链接而成的阴离子型线性高分子,由于价格低廉,应用性能优异,常作为酸性蛋白饮料的稳定剂[14]。乳液体系的稳定性与CMC浓度密切相关[15],CMC 浓度过低时,蛋白结合部分CMC发生架桥絮凝而使体系失稳,当CMC浓度适量时,对酸性乳饮料的状态具有改善作用。
本团队前期研究了PPI和CMC在水相溶液中的相互作用。研究发现当CMC浓度为0.4%、体系pH为4.5条件下,CMC可以与PPI形成稳定的静电复合物(数据暂未发表)。然而,CMC与PPI在乳液体系中的相互作用及其对乳液稳定性的影响尚不清楚。基于此,本研究拟从PPI与CMC在水相体系中的相互作用入手,研究二者所形成的静电复合物物对乳液体系的影响。通过分析二者所形成的静电复合物对乳液ζ-电位、粘度、粒径、稳定性及液滴聚集程度,以期了解CMC在高浓度PPI酸性乳液体系中的应用特性,揭示CMC引起PPI乳液稳定/失稳的内在机制,为豌豆蛋白在高蛋白植物基酸性乳品和饮料中的开发利用提供理论依据和技术支撑。
1 材料与方法
1.1 材料与仪器
脱皮豌豆 涞水县金谷粮油食品有限公司;羧甲基纤维素钠 国药集团化学试剂有限公司,分子量360 kDa,取代度DS 0.92;葵花籽油 多力葵花籽油;盐酸、氢氧化钠分析纯 国药集团化学试剂公司;磷酸盐缓冲液、尼罗红、尼罗蓝 北京索莱宝生物科技有限公司。
F-4500型荧光分光光度计 日本日立公司;PB-10型pH计 Satorius公司;TB-214型电子天平 美国Denver仪器公司;SC-15型数控超级恒温槽 宁波新芝生物科技股份有限公司;LGJ-18S型冻干机 北京松源华兴公司;DF-101S型集热式恒温加热磁力搅拌器 上海振捷实验设备有限公司;XHF-DY型高速分散器 宁波新芝生物科技股份有限公司;APV-2000型高压均质机 德国APV公司;MS3000型激光粒度分析仪 英国Malvern仪器公司;Zetasizer Nano ZS型ζ-电位分析仪 英国Malvern仪器公司;Physica MCR301型流变仪 奥地利Anton Paar有限公司;Turbiscan Lab® Expert apparatus稳定性分析仪 法国Formulaction公司;880LSM T-PMT型Carl Zeiss蔡司激光共聚焦显微镜 德国Zeiss。
1.2 实验方法
1.2.1 豌豆分离蛋白的制备 参考Lan等[16]的方法并稍做修改。将脱皮豌豆研磨粉碎后,以质量体积比为1∶15的比例分散在去离子水中,用1.0 mol/L NaOH调节pH至9.5。在25 ℃,500 r/min搅拌速度下搅拌1 h后4500 r/min离心20 min。收集上清液后,用1.0 mol/L HCL调节pH至4.5,4000 r/min离心20 min,收集沉淀重新分散于去离子水中,调节pH至7.0。冻干72 h后取出,冻干物即为豌豆分离蛋白(PPI)。经凯氏定氮法测得其蛋白含量为85.50%(N×6.25)。
1.2.2 不同CMC浓度的PPI-CMC混合溶液和乳液的制备 参考贾惜文等[17]的方法将PPI和CMC分别分散在10 mmol/L磷酸缓冲溶液(PBS)中,室温下搅拌4 h后放置于4 ℃冰箱中过夜以确保完全水化,得到5%PPI和1%CMC母液。将PPI、CMC按照一定比例混合,添加去离子水,配制成PPI浓度为3%,CMC浓度分别为:0%、0.1%、0.2%、0.3%、0.4%和0.5%的PPI-CMC混合溶液,充分搅拌溶解后取部分混合溶液用HCl和NaOH缓慢调节pH,得到pH4.5的混合溶液。
取部分混合溶液添加葵花籽油,使葵花籽油浓度为3%。用高速分散器将混合液于10000 r/min下剪切1 min后,于常温、400 Bar条件下高压均质两次,制备成添加不同CMC浓度的PPI乳液。用HCl和NaOH缓慢调节pH,得到pH4.5的乳液,置于4 ℃条件下贮藏备用。
1.2.3 不同CMC浓度的PPI-CMC混合溶液蛋白溶解度及表面疏水性测定 测定混合溶液蛋白溶解度,参考Beck等[18]方法的基础上做出细微修改。水相溶液12000 r/min离心20 min,为避免蛋白在离心过程中变性,离心温度为4 ℃,去除沉淀取上清液。不同CMC浓度(0~0.5%)的混合溶液上清液分别稀释10倍、10倍、10倍、20倍、30倍、40倍,用牛血清白蛋白检测试剂盒(BCA)测定上清液中可溶性蛋白含量。溶解度计算方法如下:

采用F-2500荧光分光光度计测定水相溶液中蛋白表面疏水性(PSH),参考Reinkensmeier等[19]的方法稍作修改。测定前,混合溶液采用pH4.5的10 mmol/L的PBS稀释150倍,注入比色皿中,25 ℃静置平衡。连续滴入10滴浓度为8 mmol/L的荧光探针8-苯胺基-1-萘磺酸-钠(ANS),每滴2 μL,滴入间隔时间2 min,静置测其荧光强度。狭缝宽度是10.0 nm,激发波长为390 nm发射波长为470 nm。PSH反映了蛋白表面结合位点的数量和强度。表面疏水性计算公式如下:
式中:Fmax是ANS溶液的浓度,Kd是蛋白溶液最大荧光强度,L0是表观结合解离常数。
1.2.4 ζ-电位测定 采用Zetasizer Nano-ZS90电位测定仪测定乳液液滴的ζ-电位,参考Liu等[20]的方法并稍作修改。测定前,样品采用pH4.5的10 mmol/L的PBS稀释5倍,测定温度25 ℃。每个样品重复测定3次,结果取平均值。
1.2.5 乳液粒径分析 采用Mastersizer 2000粒度分布仪测定乳液液滴粒径的大小,采用仪器配套软件进行数据分析。采用体积平均直径(volume weighted average diameter)d43表征液滴粒度的大小。每个样品重复测定3次,结果取平均值。参数设置为:分析模式:通用;进样器名:Hydro 2000MU(A);颗粒折射率:1.520;颗粒吸收率:0.10;分散剂:水;分散剂折射率:1.330;泵的转速:2500 r/min;测定温度:25 ℃。
1.2.6 乳液粘度的测定 根据Vélez-erazo等[21]的方法并稍做修改后,采用Physica MCR301流变仪测定乳液的粘度随剪切速率的变化。测定选用不锈钢平行板转子(pp50Ti),设定间距为1 mm,测定温度25 ℃,平衡时间3 min,剪切速率从0.1到100 s-1。加样时吸取2.3 mL样品在平板上,使其分布均匀并防止气泡产生。每个样品重复测定2次,结果取平均值。
1.2.7 乳液稳定性分析 乳液稳定性采用Turbiscan Lab稳定性分析仪测定,乳液制备好后,立即取20 mL新制乳液加入圆柱形玻璃小瓶中,并置于稳定性分析仪中,采用多次扫描模式进行测量,测定温度设为25 ℃,测定时长25 h,得到24条反射光强度(TS,BS,%)随样品高度变化的曲线。每隔1 h扫描一次,结果记录为透射光、背散射光扫描图和Turbiscan稳定性指数(TSI),其中,TSI指数越小,乳液越稳定[22]。
1.2.8 乳液的微观结构观察 采用激光共聚焦显微镜观测乳液的微观结构,参考赵谋明等[13]的方法并略作修改。在1 mL样品中加入40 μL混合染料(0.02% 尼罗红和0.1% 尼罗蓝),充分混合均匀。选用60×油镜,在显微镜下初调焦,找到乳液液滴分散平面。选择488 nm的Ar离子和633 nm的He/Ne 离子激光预扫描,采集荧光图像。所有液滴荧光图像按1024×1024像素,2×zoom进行采集。然后用激光扫描共聚焦显微镜LAS AF Lite软件进行图像分析与数据处理。
1.3 数据处理
2 结果与分析
2.1 CMC对PPI溶解度和表面疏水性的影响
由图1可知,当CMC浓度≤0.3%时,3%PPI在pH4.5时溶解度仅为3.06%,PPI溶解度随着多糖浓度的提高反而略有降低。这可能是因为在多糖分子不足时,CMC分子与蛋白分子发生桥连絮凝作用有关[23]。同时,在CMC浓度≤0.3%时,蛋白的PSH也略有下降,表明多糖的存在可能对荧光探针与蛋白疏水结合位点有一定的屏蔽作用。Xu等[24]报道了由于直链淀粉与蛋白的疏水结合作用导致蛋白PSH降低。

图1 CMC浓度对PPI溶解度性和表面疏水的影响(3% PPI,pH4.5,水相体系)Fig.1 Effects of CMC concentration on the solubilityand protein surface hydrophobicity(PSH)of PPI(3%)at pH4.5 in the aqueous solutions注:同一指标,字母不同表示差异显著(P<0.05);图2、图3同。
CMC浓度≥0.4%时,PPI在pH4.5下的溶解度和PSH均显著(P<0.05)提高(当CMC浓度>0.5%,由于其用量超出其在饮料体系中最大使用限量,故未做进一步研究)。PPI溶解度的提高与体系形成PPI-CMC静电复合物,PPI分子间的静电排斥和/或空间位阻作用提高有关(未发表结果)。Moure等[25]的研究表明蛋白质的溶解性取决于蛋白质分子的亲水性/疏水性的平衡,这种平衡取决于暴露于蛋白质分子表面的氨基酸组成。PSH的提高也意味着PPI通过与CMC发生相互作用,使蛋白分子内部更多的疏水性位点暴露出来,预示着经CMC稳定后PPI表面活性得到一定程度的改善。
2.2 CMC对PPI乳液ζ-电位的影响
由图2可知,在pH4.5条件下,体系未添加CMC时,单一的PPI稳定的乳液ζ-电位绝对值较小,约为+6.72 mV,表明在PPI蛋白的等电点附近(~4.6),液滴表面由于蛋白的吸附,呈正电性。随着CMC浓度逐渐的提高,界面吸附层上带有正电荷的PPI与带有负电荷的呈负电性的CMC分子量不断增加,CMC分子吸附到PPI分子带有正电荷的片段上,因此由PPI-CMC复合物所稳定的蛋白乳液ζ-电位由正值转变为负值,且绝对值随着CMC浓度的升高而明显增加,表明乳液体系中油滴间的静电排斥和空间位阻作用得到增强[15]。曾瑞琪等[26]报道了酸性条件下带负电荷的高酯果胶吸附到带正电荷的大豆蛋白表面,与本实验中ζ-电位变化结果相似。

图2 CMC浓度对PPI乳液ζ-电位的影响(3% PPI,pH4.5)Fig.2 Effects of CMC concentration on theζ-potential of 3% PPI stabilized emulsions at pH4.5
2.3 CMC对PPI乳液平均粒径的影响
由图3可知,对于未添加CMC的乳液,其平均粒径d43为38.5 μm(图3)。当CMC浓度≤0.2%时,平均粒径显著升高(P<0.05)。尤其当CMC浓度为0.2%时,液滴粒径增加到70.5 μm。根据pH4.5条件下CMC浓度对PPI乳液微观结构的影响(图4)的研究结果可知,未添加CMC或CMC浓度≤0.3%的体系(图4A~D),发生了严重的乳状液滴絮凝。因此,低浓度CMC引起的液滴平均粒径的增加主要是由于液滴的絮凝所致。这与较低浓度的CMC条件下,液滴表面吸附的蛋白多糖吸附层的绝对电荷量降低,静电斥力无法克服液滴间的吸引力,从而引起液滴间桥连絮凝有关。当CMC浓度≥0.4%时,乳液平均粒径随着CMC浓度的增加而不断减小,乳液絮凝得到明显的抑制(图4E~F)。当CMC浓度增加到0.5%时,乳液液滴粒径可降低至11.2 μm。表明在此CMC浓度下形成的PPI-CMC静电复合物可有效地稳定乳状液滴的界面层,液滴间的静电排斥和空间位阻效应增加有效抑制了液滴的絮凝[27]。

图3 CMC浓度对PPI乳液粒径的影响(3% PPI,pH4.5)Fig.3 Effects of CMC concentration on the particle size of3% PPI stabilized emulsions at pH4.5

图4 CMC浓度对PPI乳液微观结构的影响(3% PPI,pH4.5)Fig.4 Effects of CMC concentration on themicrostructure of 3.0% PPI stabilized emulsions at pH4.5注:图中A~F样品CMC浓度依次为:0、0.1%、0.2%、0.3%、0.4%、0.5%;红色标记为油脂,绿色标记为蛋白。
2.4 CMC对PPI乳液粘度的影响
乳液连续相粘度是影响乳液稳定性的重要因素。此外,多糖吸附到蛋白稳定的水油界面上,形成粘弹性凝胶界面结构,也会影响蛋白乳液的稳定性[28]。由图5可知,在pH4.5条件下,PPI乳液粘度较高,这可能与体系发生严重的絮凝有关。随着CMC浓度增加,体系的粘度首先呈现增加的趋势,当体系CMC浓度为0.3%时,粘度达到最大值,这可能与多糖诱发的液滴间架桥絮凝造成乳液絮凝程度的增加有关[12]。当CMC浓度达到0.4%时,体系的粘度显著下降(P<0.05),继续提高CMC浓度,粘度有一定程度的提高,但仍显著低于CMC浓度≤0.3%的体系(P<0.05)。添加0.5% CMC引起了体系粘度的增加,可能表明在此浓度下,界面相或连续相中存在的PPI所吸附的CMC均达到饱和,因此未被PPI吸附的CMC以游离态的形式存在于乳液的分散相中,引起体相粘度的升高有关[29]。这与CMC浓度≤0.3%时体系粘度增加的机理存在本质不同,由此可得CMC的增稠作用对乳液稳定的影响不显著。
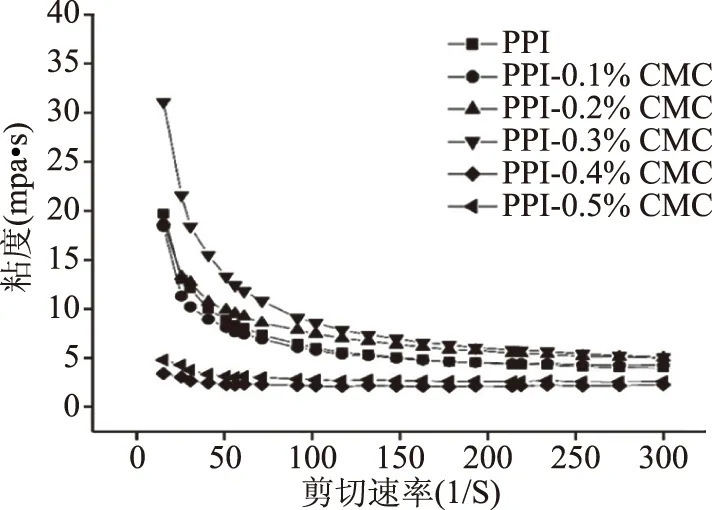
图5 CMC浓度对PPI乳液粘度的影响(3% PPI,pH4.5)Fig.5 Effects of CMC concentration on the viscosity of3% PPI stabilized emulsions at pH4.5
2.5 CMC对PPI乳液稳定性的影响
以样品池的高度为横坐标,以透射光和背散射光光强值变化值为纵坐标表征其随时间变化,结果见图6。可见,对于单一PPI制备的乳液(图6A),样品在放置1 h左右,样品底部有澄清层出现(透射光强度增加)。随着放置时间的增加,样品顶部产生了澄清层(背散射光强度随减小)而样品池底部出现了沉淀层,体系非常不稳定。当CMC浓度≤0.3%(图6B~D),体系的稳定性未得到改善。随着CMC浓度的增加到0.4%以上(图6E~F),样品的稳定性显著提高,由于乳液失稳产生的蛋白沉淀、液滴絮凝、析水现象得到显著抑制。
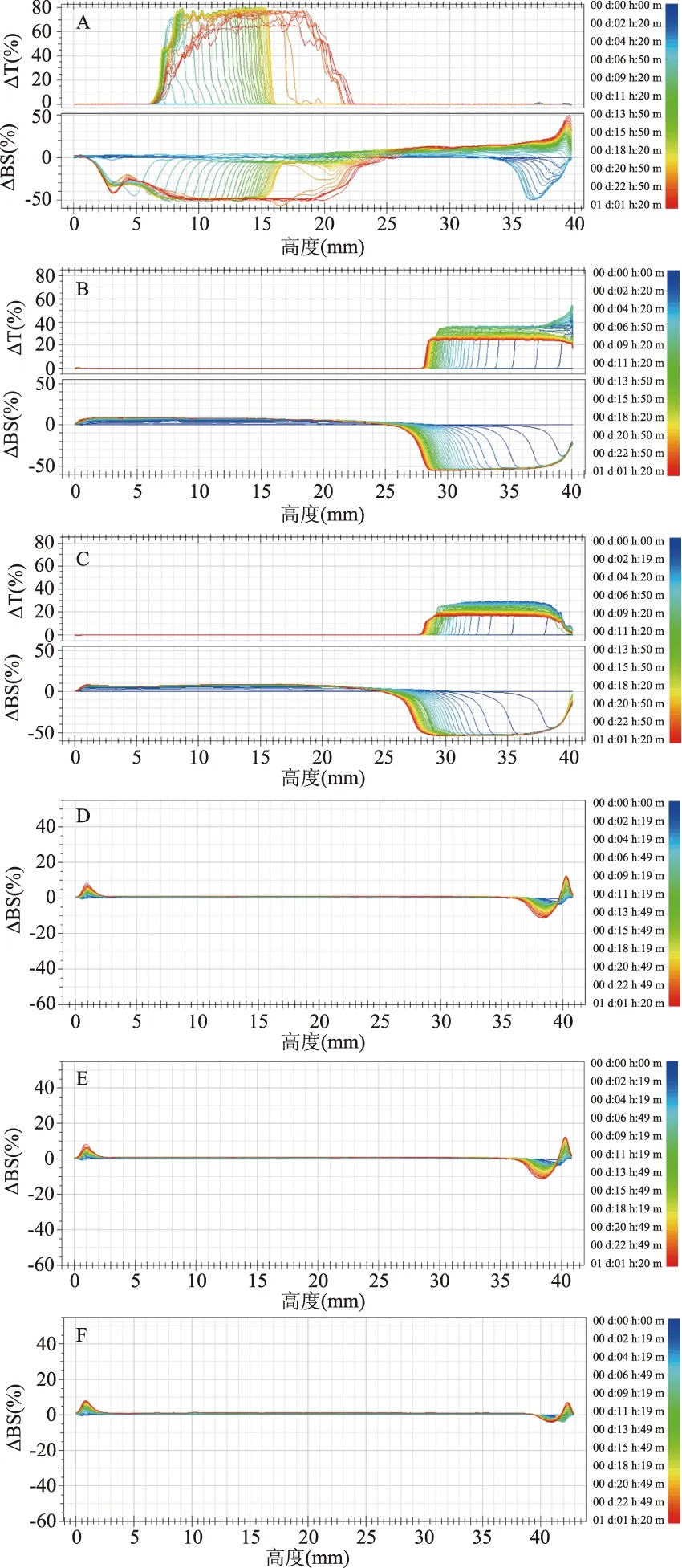
图6 CMC浓度对PPI透射光和背射光强度的影响(3% PPI,pH4.5)Fig.6 Effects of CMC concentration on the transmission andbacklight intensity of 3% PPI stabilized emulsions at pH4.5 注:图中A~F样品CMC浓度为:0、0.1%、0.2%、0.3%、0.4%、0.5%。
TSI指数是监测乳液动态稳定性的有效指标,TSI指数越小,乳液越稳定[30]。图6中乳液稳定性的变化也可以通过图7中TSI指数的变化来定量分析。由图7可知,在pH4.5条件下,PPI乳液体系TSI指数较高,放置时间较长时,体系发生严重的失稳现象。在一定储存时间内,CMC浓度≤0.3%的PPI乳液发生严重的絮凝和聚结,体系的TSI指数增加,乳液稳定性下降,但放置较长时间时,CMC对体系的稳定性仍产生积极贡献。当CMC浓度≥0.4%时,TSI指数明显减小,表明由PPI-CMC稳定的蛋白乳液由于液滴间静电排斥、空间位阻相应的增强,乳液稳定性明显改善,液滴絮凝、析水现象得到抑制。这与Zhao等[31]的研究结果类似,当乳铁蛋白乳液中添加0.05%~0.15%大豆多糖或甜菜果胶时,乳液发生桥连絮凝,浓度超过0.35%时,乳液具有良好的稳定性。

图7 CMC浓度对乳液TSI指数的影响(3% PPI,pH4.5)Fig.7 Effects of CMC concentration on the TSI of3% PPI stabilized emulsions at pH4.5
3 结论
在pH4.5、CMC浓度≥0.4%条件下,带负电性的CMC分子与呈正电性的PPI通过静电吸附作用形成的复合物有效改善了PPI在等电点附件的变性沉淀,明显提高3% PPI溶液在酸性条件下的溶解性。经CMC稳定的PPI分子,其蛋白内部结构中的部分被埋藏的疏水位点暴露出来,表面疏水性得到提高。对于PPI-CMC静电复合物稳定的乳液体系(3% PPI,3% 油相),当CMC浓度不足时(≤0.3%),多糖引起的桥连絮凝效应导致乳液体系中的液滴发生严重的絮凝现象,乳液粒径明显增加,体系失稳严重。而当CMC浓度≥0.4%,PPI-CMC形成的复合界面层,有效提高了液滴表面的ζ-电位,液滴间静电排斥和空间位阻效应的增加,有效地抑制了液滴间引力作用,从而抑制了液滴的絮凝,PPI乳液的稳定性显著改善,液滴粒径降低。
本研究表明PPI-CMC静电复合物对3%PPI乳液体系的稳定作用与CMC的浓度密切相关。考虑到实际食品体系中组分和加工工艺的影响,今后的研究需要关注体系共存组分(如离子、糖、蛋白、油脂的种类和浓度等)以及加工工艺(均质、杀菌条件等)等因素对PPI-CMC乳液体系的影响,从而为豌豆蛋白基酸性乳品和饮料的开发利用提供更为丰富的理论依据和指导。

