微胶囊技术在益生菌CICC 6075冰淇淋中的应用
田文静,赵东瑞,孙玉清,柳 青,罗红霞,邓志峰,汪慧华
(1.北京农业职业学院食品与生物工程系,北京 102442; 2.北京工商大学食品质量与安全北京实验室,北京 100048)
冰淇淋是一种具有独特风味和细腻口感的乳制品,深受消费者喜爱。但随着生活水平的不断提高,人们对食品的要求不仅仅是美味,更关注其在改善人体健康水平以及疾病预防上的表现。而冰淇淋作为一种低温储存的乳制品,是益生菌的理想载体。益生菌冰淇淋同时结合了冰淇淋的感官特性和益生菌的营养特性,其口感良好、营养价值较高,且低温的储存环境对益生菌的保存十分有利,因而货架期远远超过酸奶等乳制品,市场前景广阔,也引起了越来越多研究者和消费者的关注[1]。Góral等[2]将富镁乳酸菌添加至冰淇淋中,并对其理化性质和微生物学特性进行探究,结果发现,富镁菌的添加对冰淇淋的颜色、可溶性、硬度、化学参数等均没有影响,但与对照组相比,冰淇淋中富镁菌的存活性较低。
益生菌类食品中所含益生菌需在食品和宿主中达到一定数量(通常认为在食品中不低于106CFU/g或106CFU/mL)且保持代谢稳定才能提供健康功效[3-4]。益生菌进入宿主后要发挥益生作用需对胃酸和胆汁酸具有抗性、对粘膜和肠上皮细胞具有粘附性[5-6]。但是,在食品的实际生产、储运、消费等过程中,益生菌会受到食品组分(酸、碱、添加剂等)、加工和储存条件(冷冻、氧气等)及宿主消化系统(胃酸、胆汁酸、消化酶)等的不良影响[7]。这些不良因素会导致益生菌类食品中活菌数大幅下降,甚至低于其能够发挥生理功效的最小阈值[8]。例如,在冰淇淋的制作过程中,快速凝冻等工艺会损伤菌体细胞膜,进而影响菌的生理功能和代谢活性;此外,搅拌过程充入的空气对厌氧菌的生长和活性保持也有不利影响[1]。因此,如何提升益生菌对不利因素的抗性成为了研究人员关注的热点。
微胶囊技术的出现为以上问题提供了可靠的解决方案。研究表明,利用微胶囊技术将益生菌包埋在肠溶性壁材中,不仅可以增强菌体对不良环境的抵抗性,还能使微胶囊中的益生菌在肠道适宜条件下快速释放,显著提高菌体在肠道中的存活率,更好地发挥益生菌的益生功效[9-10]。Farias等[11]分别将鼠李糖杆菌ASCC 290和干酪乳杆菌ATCC 334的裸菌及以海藻酸钙-壳聚糖为壁材的微胶囊添加至冰淇淋中,结果发现在模拟胃液中,微胶囊组中两种菌的存活率分别提高了86.2%和84%,在-18 ℃下贮藏150 d后,微胶囊组中两种菌的存活率分别提高了73.8%和79.5%。因此,将益生菌微胶囊化后添加至冰淇淋是提高益生菌存活率的一个有效方法。
本研究研发一种含益生菌微胶囊的冰淇淋,并通过考察益生菌微胶囊的加入对冰淇淋的理化性质、感官性质、耐贮藏性及消化特性的影响,来评估其可行性,为益生菌冰淇淋的研究提供参考。
1 材料与方法
1.1 材料与仪器
嗜酸乳杆菌CICC 6075 中国工业微生物菌种保藏管理中心提供;人结肠癌上皮细胞(Caco-2细胞) 中国疾病预防控制中心传染病预防控制所提供;MRS肉汤培养基、MRS琼脂培养基、NaCl、NaOH、凝乳酶(1000 U/g)、CaCO3、冰醋酸、HCl溶液、胃蛋白酶(3000 U/mg)、稳定剂 国药集团化学试剂有限公司;高糖DMEM培养基、胎牛血清、胰蛋白酶-EDTA消化液、青霉素、链霉素 美国Sigma 公司;植物油、牛乳、雀巢淡奶油、白砂糖、蛋黄粉、脱脂乳粉 永辉超市。
LRH-250F恒温培养箱 上海一恒科学仪器有限公司;eppendorf 5810R高速离心机 德国艾本德公司;磁力搅拌器 常州国华仪器有限公司;恒温振荡器 常州国华仪器有限公司;冰淇淋机 德玛仕科技有限公司;METTLER TOLEDO FE-28pH计 美国梅特勒-托利多公司;UV-2600分光光度计 岛津仪器有限公司;KONICA MINOLTA CM-3700A色差仪 日本柯尼卡美能达公司;BROOKFIELD CT3质构仪 美国博勒飞公司;SEM-SU8010扫描电子显微镜 日本日立公司。
1.2 实验方法
1.2.1 主要溶液的配制 解囊液:分别配制浓度为0.1 mol/L的磷酸氢二钠和浓度为 0.05 mol/L 的柠檬酸,调节 pH=7.25,121 ℃灭菌15 min,待用[12]。
模拟胃液:参照Felicio等[13]的方法,用0.5 mol/L的HCl溶液将0.85%的NaCl溶液pH调节至2.0,加入3 g/L的胃蛋白酶,最后用0.22 μm的滤膜进行过滤灭菌。
1.2.2 益生菌及微胶囊制备
1.2.2.1 益生菌的准备 将嗜酸乳杆菌CICC 6075接种于MRS 液体培养基,于37 ℃下活化培养至对数期末期,离心收集菌泥(3000 r/min,10 min),用0.85%的无菌生理盐水清洗2次后,于4 ℃储存备用,并通过平板计数测其活菌数。
1.2.2.2 益生菌微胶囊的准备 以乳蛋白为壁材,用乳化法对益生菌进行包埋,制备方法参考Tian等[14]的方法。具体方法为:将脱脂乳粉溶解于蒸馏水中配成质量分数为30%的溶液,在4 ℃下搅拌过夜;取28 g 脱脂乳液加入2.0 g 浓缩菌液和400 μL凝乳酶(100 U/mL),在低温下(4 ℃)搅拌1 h;随后,取菌乳混合液10 g 加入1.5 g CaCO3混合均匀后,加入到100 g 葵花油中,在磁力搅拌器的作用下反应约15 min,待混合物分散到油相中形成均匀的油包水(W/O)型乳化液,加入100 μL冰醋酸,静置30 min后,离心(1000 r/min,1 min)、洗涤,收集凝胶颗粒,存于4 ℃备用。
1.2.3 微胶囊的包埋率及形态观察
1.2.3.1 包埋率测定 取制得的微胶囊0.5 g,放入4.5 mL的解囊液中,在恒温振荡器中以37 ℃、180 r/min的条件振荡培养120 min至完全崩解,通过平板计数测其活菌数[15]。
微胶囊包埋率(Microencapsulation efficiency,ME,%)计算如下:
ME(%)=Q1/Q2×100
式中:Q1指微胶囊中活菌数量(CFU),为每克湿微胶囊的含菌量(CFU/g)与收集得到的微胶囊总质量的乘积(g);Q2指初始活菌数量(CFU),为每毫升浓缩菌液的含菌量(CFU/mL)与加入的浓缩菌液总体积的乘积(mL)。
1.2.3.2 形态观察 为观察微胶囊的形态,利用光学显微镜和扫描电镜对制得的微胶囊进行观察,具体操作参照Matias等[16]的方法:取1 g微胶囊样品,置于2%戊二醛溶液中固定2 h,用超纯水洗涤两次后,依次用25%、50%、75%、90%、95%、100%的乙醇溶液进行脱水,最后用超临界CO2法进行干燥。将干燥后的膜置于铝桩上,喷射镀金,用扫描电子显微镜进行菌体形态观察和样本图像采集。
1.2.4 冰淇淋的制作及理化性质检测
1.2.4.1 冰淇淋的制作 配制2 L冰淇淋浆液:称量1.25 L牛奶与150 g奶油混合,再加入50 g脱脂奶粉和部分糖粉(糖粉含量共250 g),混合均匀后,加热至60 ℃,再加入剩余糖粉和10 g复合稳定剂(明胶∶甘油硬脂酸酯∶瓜尔胶=2∶3∶5),均质后进行巴氏杀菌(80 ℃,20 s),然后在4 ℃下储存12 h熟化。
准确称取三份上述样品(均为450 g),第一份不添加外物,作为空白对照,记为冰淇淋A;第二份加入50 g益生菌菌泥,记为冰淇淋B;第三份加入一定量的益生菌微胶囊,使冰淇淋中的活菌数与冰淇淋B中相近,记为冰淇淋C;最后分别将样品混匀,置于4 ℃冰箱进行熟化,24 h后加入冰淇淋机中进行搅拌充气,得到的冰淇淋分装到50 mL的冰淇淋杯中,于-20 ℃下硬化,储存待测。
1.2.4.2 色差分析 冰淇淋制好后的第一天,采用色差仪在-18 ℃的条件下对冰淇淋样品的色泽进行测定。首先分别用黑板和白板对色差仪进行校正,然后对冰淇淋样品进行测定。每组样品重复测定3次,取平均值。
所得到的参数L*值表示明亮度,a*值为正值时表示偏红色,为负值时表示偏绿色;b*值为正值时表示偏黄色,为负值时表示偏蓝色[17]。色度(C*)和白色指数(WI)用以下公式计算[18]:
C*=(a*2+b*2)1/2
WI=100-[(100-L*)2+a*2+b*2]1/2
1.2.4.3 质构分析 取储存在-18 ℃条件下的冰淇淋样品,利用CT3质构仪对其硬度和粘附度进行测定,测定条件为:Normal模式,TA-17探头,测试前探头速度为2 mm/s,试验和后试验速度为1 mm/s,穿透距离为25 mm,探头两次测试间隔为5.00 s,触发类型为自动,每批样品在大约-18 ℃的温度下测定三次。硬度测定为探针穿透时的峰值压缩力(g),粘附度测定为退出时的负峰值压缩力(mPa·s)[19]。
1.2.4.4 pH 将上述制得的冰淇淋于-20 ℃条件下储存150 d,以30 d为间隔取样,取三组冰淇淋各10 g,用无菌蒸馏水稀释至20 mL,用pH计测量各样品的pH,每个样品测三个平行样品。
1.2.4.5 膨胀率 冰淇淋膨胀率(overrun,%)的测定参照Rinaldi等[20]的方法,在冰淇淋浆液搅打前后分别量取同等体积的冰淇淋浆液和冰淇淋成品,分别测其质量,计算公式如下:
膨胀率(%)=(M1-M2)/M2×100
式中:M1为同等体积冰淇淋浆液的质量,g;M2为同等体积冰淇淋成品的质量,g。
1.2.4.6 融化率 冰淇淋的融化特性常用融化率(%)来表示[21],具体方法为:准确称取冰淇淋50 g,放置在纱网上于37 ℃恒温箱中进行融化,45 min后测定融化的冰淇淋浆液质量,计算公式如下:
融化率(%)=N1/N2×100
式中:N1为融化的冰淇淋浆液质量,g;N2为称取的冰淇淋质量,g。
1.2.4.7 脂肪失稳度 脂肪失稳度的测定参照Balthazar等[18]的方法,具体方法为:分别称取10 g冰淇淋浆液和冰淇淋成品,用无菌蒸馏水以1∶500 (V/V)进行稀释,1000 r/min离心10 min后,用分光光度计在540 nm波长下测定其吸光度,以无菌蒸馏水为空白对照,脂肪失稳度的计算方法如下:
脂肪失稳度=(A1-A2)/A1×100
式中:A1为冰淇淋浆液的吸光度;A2为冰淇淋成品的吸光度。
1.2.5 感官检验 选取30名年龄为18~25岁的人员组成感官评价小组(其中男性16人,女性14人),对刚制作完成的冰淇淋产品进行感官评估,并使用感官评定量表进行评分。评价指标选取风味和滋味、质构、颜色和外观,感官评分标准如表1所示[22]。

表1 冰淇淋的感官评分标准Table 1 Sensory evaluation standard of ice cream
1.2.6 冰淇淋的耐贮藏性 将上述制得的冰淇淋于-20 ℃条件下储存150 d,以30 d为间隔取样,取三组冰淇淋各5 g,37 ℃条件下放于45 mL解囊液中以180 r/min的转速振荡至完全崩解,通过平板计数测其活菌数,对比分析在冰淇淋产品中微胶囊对益生菌的保护作用。
1.2.7 冰淇淋贮藏过程中益生菌的消化特性检验
1.2.7.1 耐胃酸性试验 在冰淇淋的贮藏过程中,每隔30 d对冰淇淋中益生菌的耐胃酸性进行一次检测,具体方法为:分别取三组冰淇淋各5 g,加入45 mL模拟胃液中,37 ℃培养2 h后,取5 mL样品溶液加至45 mL解囊液中37 ℃振荡培养2 h,使菌体完全释放,从中取1 mL溶液进行梯度稀释,通过平板计数测其活菌数,并按下式计算CICC 6075在胃液中的存活率:

表2 微胶囊的包埋率及粒径Table 2 The microencapsulation efficiency(ME)and size of microcapsules
在胃液中的存活率(%)=N1/N2×100
式中:N1:经胃液处理2 h的冰淇淋中活菌数,CFU/g;N2:相同贮藏时间的冰淇淋中所含活菌数,CFU/g。
1.2.7.2 体外粘附性试验 参照Balthazar等[23]的方法,将Caco-2细胞以105cell/孔的浓度加入24孔板中,孔板中为高糖DMEM培养基(含20%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素),于37 ℃、CO2浓度5%的潮湿环境中培养约7~10 d,直至形成融合的单层细胞。粘附试验前1 d,用不含抗生素(青霉素-链霉素)的培养基代替生长培养基,用无菌磷酸盐缓冲盐水(PBS)冲洗3次。
分别称取1 mL冰淇淋B溶液和1 mL解囊后的冰淇淋C溶液,加至Caco-2细胞融合后的单层细胞中,在37 ℃、5% CO2的加湿培养箱中孵育2 h。随后,用PBS彻底冲洗细胞,以去除剩余的食物颗粒和不粘附的乳酸菌。然后,在每个孔中加入1 mL胰蛋白酶-EDTA消化液将乳酸菌与Caco-2细胞进行分离。最后,分别从每个孔吸取1 mL悬浮液,加到9 mL蛋白胨水中,连续稀释,用MRS琼脂培养基进行活菌计数。
为测定冰淇淋在储存过程中益生菌的粘附性变化,每30 d取一次样,进行体外粘附率的测定,并按下列公式计算了CICC 6075的粘附率:
粘附率(%)=Y2/Y1×100
式中:Y1:经胃液处理2 h的冰淇淋中活菌数,CFU/g;Y2:粘附于Caco-2细胞的活菌数,CFU/g。
1.3 数据处理
所有独立试验至少重复3次,应用SPSS 22.0统计软件对各试验数据进行方差分析和显著性检验,试验数值以平均数±标准差(X±S)表示。
2 结果与分析
2.1 微胶囊的包埋率及形态观察
微胶囊的包埋率及粒径大小见表2,由表2可知,以乳蛋白为壁材,采用乳化法对嗜酸乳杆菌CICC 6075进行微胶囊化,其包埋率为84%,表明该方法和壁材与嗜酸乳杆菌CICC 6075的相容性较好。此结果与Heidebach等[24]的研究结论一致。
利用光学显微镜和扫描电镜对微胶囊的形态和结构进行观察,结果如图1和图2所示。由图1可以看出,微胶囊颗粒大小均匀,粒径分布范围较窄,用光学显微镜图像分析软件测量得微胶囊的平均直径为(145.37±23.64)μm;图2可以看到微胶囊形状较规则、表面致密,为其中的乳杆菌提供了严密的保护。Fahimdanesh等[25]认为,形状规则、粒径较小的微胶囊添加至食品后对其感官性质影响较小,在感官评价中一般不影响口感、不会出现砂砾感。也有研究表明,粒径为微米级的胶囊加入食品后能使其产生光滑的质地[26]。但并非粒径越小越好,Rokka等[27]研究发现,粒径小于100 μm的胶囊对益生菌的保护作用减弱,尤其是在模拟人工胃液中,微胶囊中益生菌的存活率与裸菌相比并无显著提高。
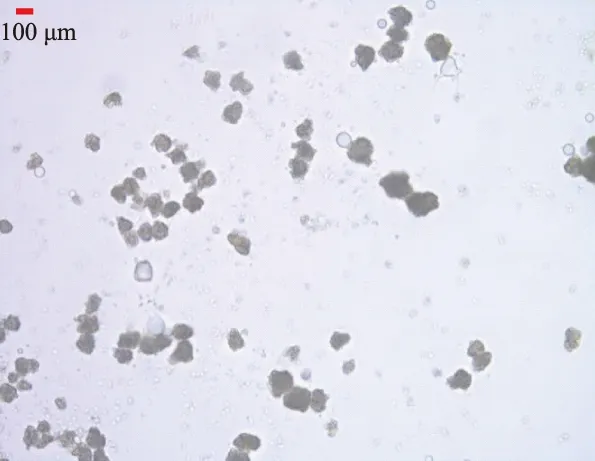
图1 光学显微镜下CICC 6075微胶囊的形态(100×)Fig.1 Morphology of CICC 6075 microcapsules(100×)

图2 电子显微镜下CICC 6075微胶囊的形态(800×)Fig.2 SEM morphology of CICC 6075 microcapsules(800×)
2.2 益生菌及微胶囊的添加对冰淇淋理化性质的影响
为探讨益生菌及微胶囊的添加对冰淇淋理化性质的影响,对三种冰淇淋的膨胀率、融化率、脂肪失稳度、色差、质构等理化指标进行了检测(见表3),同时测定了不同贮藏时间三种冰淇淋的pH变化(见图3)。结果表明,与冰淇淋A相比,冰淇淋B的膨胀率、融化率和脂肪失稳度均有所下降,但差异不显著(P>0.05);而冰淇淋C的三项指标均有所上升,可能与微胶囊的加入增加了冰淇淋浆液的黏度有关[2]。
有研究表明,冰淇淋的理化性质与其组成成分及加工过程密切相关,且各性质之间也存在一定的相关性。其中,膨胀率是指在冷冻过程中由于冰淇淋混合物中加入空气而膨胀的百分比,是冰淇淋的重要物理特性之一,对产品的质量(如质地、柔软度及产品的稳定性等)有一定影响[28]。同时,膨胀率也决定了融化速度,冰淇淋B的融化率较低,可能是因为其相应的膨胀率较低[29]。脂肪失稳度可表征脂肪的不稳定程度,因为冰淇淋中不稳定的脂肪常以脂肪球团的形式存在,而这些脂肪球可以包裹并支撑空气分子,使其持有一定的膨胀率[30]。所以,脂肪失稳度与膨胀率成正相关,本研究中冰淇淋C的脂肪失稳度和膨胀率均高于B,符合此论断。此外,冰淇淋的融化率与其硬度也存在相关性,通常融化率低的产品相对硬度较大[28]。本试验的结果与上述观点相符,在质构检测中发现,冰淇淋B的硬度最大,为(67.86±3.92) g;而冰淇淋C的硬度最小,为(45.31±3.26) g,与相应的融化率呈负相关。此外,冰淇淋的粘附度也呈现冰淇淋C>冰淇淋A>冰淇淋B的趋势,这可能与其固形物含量有关。

表3 益生菌及微胶囊的添加对冰淇淋理化性质的影响Table 3 Effects of probiotics and microcapsules addition on physicochemical properties of ice cream
颜色是食品的一个重要属性,是消费者感知食品的第一特征,颜色的好坏往往影响消费者的选择[31]。表3数据显示,在颜色参数方面,三种冰淇淋的亮度L*值为93.97±1.25~94.31±0.82,样品间无显著差异(P>0.05)。此外,白度是牛乳基产品的一个重要特征[20]。在本研究中,冰淇淋A呈极白色,CICC 6075裸菌及微胶囊的添加对冰淇淋的颜色参数影响不显著(P>0.05)。
由图3可以看出,在贮藏过程中,CICC 6075微胶囊的添加对冰淇淋的pH影响并不显著(P>0.05)。而贮藏150 d冰淇淋B的pH下降了0.39,这可能是由于贮藏过程中嗜酸乳杆菌CICC 6075的代谢产物使冰淇淋的pH降低,而微胶囊将菌包埋在其中,导致菌对营养物质吸收缓慢、代谢产物释放减少,故pH下降不显著[32]。Homayouni等[33]报道称,微胶囊化的乳酸菌在MRS肉汤培养基中培养50 h可使pH降至4,而乳酸菌裸菌仅需要20 h。Abghari等[34]也发现添加游离鼠李糖乳杆菌会影响冰淇淋样品的pH,但对其物理性质没有影响。这均与本研究的结论一致。

图3 冰淇淋贮藏过程中pH的变化Fig.3 Changes in pH of ice cream during storage注:字母不同代表同一产品在不同贮藏时间下差异显著(P<0.05)。
2.3 益生菌及微胶囊的添加对冰淇淋感官性质的影响
对三种冰淇淋的感官评价结果见图4,由图4可以看出,三种冰淇淋的各项评价指标均没有显著差异(P>0.05),表明CICC 6075裸菌及CICC 6075微胶囊的添加对冰淇淋的口感、质地、风味、颜色、外观等感官特性均没有显著影响,在评价中,没有任何一个冰淇淋样品观察到不良的味道、蓬松感或砂砾感。原因可能是乳化法制得的微胶囊粒径较小,不容易被口腔感觉器官识别,但由挤压法制得的微胶囊粒径相对较大,很可能导致砂砾感[35]。Kataria等[36]也有类似的发现,认为益生菌裸菌或微胶囊的添加不会导致冰淇淋产生不良感官特性。

图4 三种冰淇淋的感官评价结果Fig.4 The sensory evaluation results of three ice cream
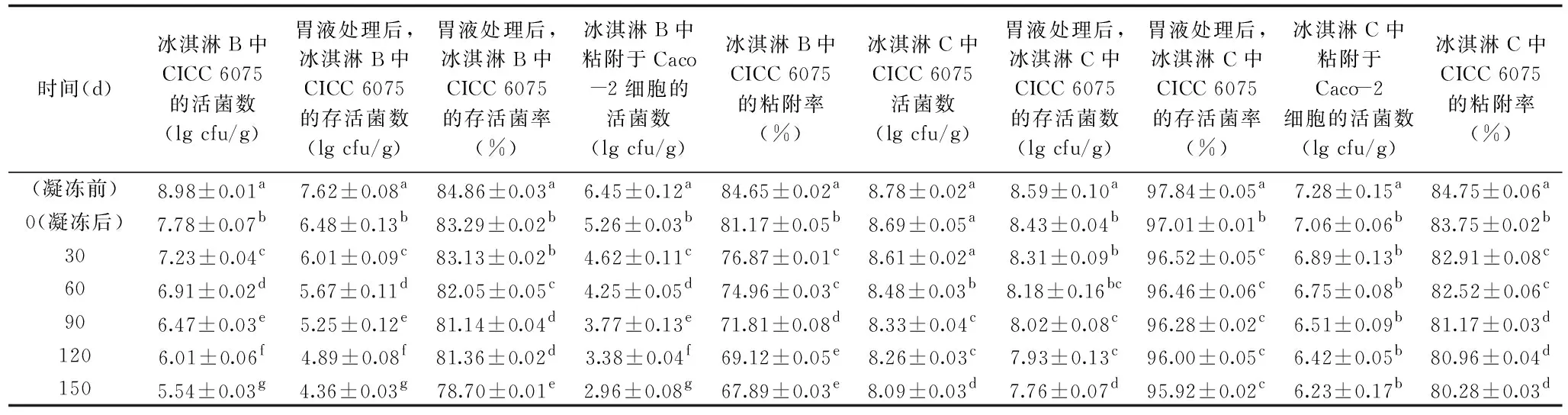
表4 加工、贮藏及模拟胃液对三种冰淇淋中CICC 6075活菌数的影响Table 4 Effects of processing,storage and SGF on the survival of CICC 6075
此外,感官评价发现,三种冰淇淋都有良好的可接受度。在购买意向测试中,80%的测试者表示可能会购买含有益生菌微胶囊的冰淇淋,同时,也有很多测试者表示对功能性冰淇淋的营养价值及健康功效非常感兴趣。因此,本研究指出了含益生菌冷冻甜品的潜在市场。
2.4 冰淇淋的耐贮藏性
贮藏期间,冰淇淋中益生菌的活菌数能否维持在其发挥生理功效的最小阈值之上(>106CFU/g)是衡量冰淇淋保健功效的重要指标。表4为加工及贮藏过程中冰淇淋B和冰淇淋C中嗜酸乳杆菌CICC 6075的存活情况。结果表明,冰淇淋的凝冻过程对菌体的损伤较大,1 h的搅拌凝冻使冰淇淋B中的CICC 6075活菌数下降了(1.20±0.08)lg CFU/g;在-18 ℃的条件下贮藏150 d后,CICC 6075活菌数更是显著下降(P<0.05),从(7.78±0.07)lg CFU/g降至(5.54±0.03)lg CFU/g,低于益生菌发挥健康功效的最低阈值。原因可能是搅拌过程中机械力对菌体造成伤害,或是凝冻过程中温度迅速降低,水分结晶形成的机械力对益生菌细胞结构破坏所致,同时长时间暴露在低温下也会降低细胞活性[1]。此外,凝冻搅拌会使冰淇淋内部包含大量空气,而作为厌氧菌的嗜酸乳杆菌对氧气较敏感,因此高溶氧量的环境也不利于菌体的生长[37]。
然而,凝冻过程中冰淇淋C中的CICC 6075活菌数变化不显著(P>0.05),仅下降了(0.09±0.07)lg CFU/g。在-18 ℃的贮藏条件下,冰淇淋C中的CICC 6075也保存较好,150 d后活菌数仅下降了(0.60±0.08)lg CFU/g,最终活菌数为(8.09±0.03)lg CFU/g,远高于益生菌发挥健康功效的阈值。原因可能是微胶囊为CICC 6075提供了保护层,使其与外界环境隔绝,提高了菌体对冷冻及氧气等不适环境的抗性。Farias等[11]也有类似结论,以海藻酸钠-壳聚糖为壁材、利用挤压法制得的微胶囊对-18 ℃条件下保护鼠李糖乳杆菌ASCC 290十分有效。Zanjani等[32]也发现,与裸菌相比,贮藏过程中微胶囊能显著提高冰淇淋中的干酪乳杆菌ATCC 39392和双歧杆菌ATCC 15703的活菌数,原因是微胶囊均匀、完整的结构为内部的菌体提供了良好的保护。
2.5 冰淇淋贮藏过程中益生菌的消化特性检验
2.5.1 耐胃酸性试验 益生菌要想发挥益生功效,除了需要在产品中保持一定活性外,更重要的是要抵御胃肠道消化液的伤害,最终顺利到达肠道定植[6,38]。本实验探究了冰淇淋贮藏过程中嗜酸乳杆菌CICC 6075的耐胃酸性能变化,由表4可以看出,随着贮藏时间的延长,冰淇淋B中CICC 6075的耐胃酸性显著下降(P<0.05),经150 d的低温贮藏,CICC 6075在胃液中保存2 h后活菌数从凝冻前的(7.62±0.08)lg CFU/g降至(4.36±0.03)lg CFU/g,减少了(3.26±0.11)lg CFU/g;而冰淇淋C中CICC 6075仅降低(0.83±0.17)lg CFU/g,这可能与冷冻及贮藏过程中冰淇淋里本身存在的活菌数下降有关。
经计算发现,随着贮藏时间的延长,两种冰淇淋中CICC 6075在胃液中的存活率均有所下降,且冰淇淋B中CICC 6075裸菌在胃液中的存活率下降更快(6.16%±0.04%),显著低于冰淇淋C中CICC 6075微胶囊在胃液中的存活率(P<0.05)。这可能是因为凝冻过程中菌体的细胞膜受到损伤,加速了胃液的渗透,导致活菌数在胃液中迅速下降[1]。而微胶囊在冷冻过程中为菌体提供较好的保护,避免其细胞膜受损,此外,微胶囊致密的结构也可以延缓胃液的渗透,减小胃液对菌体的损害。Afzaal等[39]也有类似发现,在模拟胃肠实验中,海藻酸钠微胶囊中嗜酸乳杆菌ATCC-4356的活菌数仅下降3 lg CFU/g,显著低于裸菌的减少量(7 lg CFU/g)。
2.5.2 体外粘附性试验 Caco-2细胞是考察益生菌或致病菌在肠道上皮细胞的粘附性中应用最广泛的细胞系之一,常常用来检测乳酸菌菌株的粘附能力[40]。益生菌对肠道细胞的粘附性关系到其功能特性的发挥,如通过竞争营养成分或分泌抗菌物质来调节肠道菌群、减少肠道致病菌、防止感染肠道疾病,加强肠粘膜的屏障作用,刺激宿主的免疫系统等[41]。
本研究以体外培养的Caco-2细胞株为模型,探究在冰淇淋贮藏过程中,嗜酸乳杆菌CICC 6075的粘附性变化,以及微胶囊对菌体粘附性的影响(表4),为探讨冰淇淋产品的功能性提供依据。实验结果表明,嗜酸乳杆菌CICC 6075对Caco-2细胞的有较高粘附性,这与Adriana等[42]的研究一致,干酪乳杆菌和嗜酸乳杆菌对Caco-2细胞的有较高粘附性。益生菌的高粘附性可能与其生理生化特性有关,如有些菌细胞壁上存在黏液结合菌毛,可促进粘附过程[43]。但在贮藏过程中发现,随着贮藏时间的延长,冰淇淋B和冰淇淋C中粘附于Caco-2细胞的活菌数均有所降低,这可能与胃酸处理后冰淇淋中本身存在的活菌数下降有关,因此,本研究进一步计算了CICC 6075的粘附率。经计算发现,随着贮藏时间的延长,两种冰淇淋中CICC 6075的粘附率均有所下降,且冰淇淋B中CICC 6075的粘附率下降更快(16.76%±0.05%),显著低于冰淇淋C中CICC 6075的粘附率(P<0.05)。原因可能是在冰淇淋的贮藏期间,菌体本身的粘附性有所降低,相对而言,微胶囊可以在一定程度上维持菌体的粘附性。Deepika等[44]也报道称在酸奶或冰淇淋的贮藏过程中,其中菌的粘附性会降低,原因是在储存过程中细菌的细胞表面发生了构象变化,而相比于其他因素(如载体食品基质中的脂肪和糖含量),储存时间在维持细菌粘附性方面影响更大。因此,冰淇淋C中CICC 6075的粘附率更高,原因可能是在冷冻及贮藏过程中,微胶囊对菌体形成保护,减缓了细菌表面构象的变化;也可能是微胶囊壁材对菌体的粘附性有促进作用,具体机理有待进一步探究。
3 结论
嗜酸乳杆菌CICC 6075裸菌及微胶囊的添加对冰淇淋的理化和感官性质均无显著影响。但在冰淇淋的制作过程中,微胶囊由于结构致密可对菌体提供良好的保护,因而能够明显提高CICC 6075的冻后存活率、耐贮藏性(-15 ℃,180 d)、耐胃酸性及对小肠上皮细胞的粘附性。基于上述结果,微胶囊技术可以明显提升益生菌对不良环境(如低温、胃液)的抗性,因而可以在保证冰淇淋良好品质特性的同时,提高益生菌冰淇淋的功能潜力,具有一定的应用前景。

