黄皮果肉可溶性膳食纤维制备工艺优化及单糖组成和结构表征
文 攀,裴志胜,朱婷婷,于紫娟,耿玉坤,陈彩玉,薛长风,*
(1.海南热带海洋学院,海南三亚 572022: 2.海南省海洋食品工程技术研究中心,海南三亚 572022; 3.海洋食品精深加工关键技术省部共建协同创新中心,海南热带海洋学院,海南三亚 572022)
黄皮[ClausenaLansium(Lour.)Skeels(C.Wampi Blanco)],芸香科黄皮属(黄皮果属)常绿乔木,在我国海南、广东、广西、台湾等地种植较多[1]。黄皮果实富含糖、有机酸、果胶、维生素C、挥发油、黄酮苷等,且具有健脾开胃、消痰化气、润肺止咳、去疳积等功效,具有较高的食用、药用价值[2]。黄皮果上市时间集中在5月中旬~7月初之间,逢台风、梅雨季,但果实保鲜方面仍处于瓶颈,不及时加工往往带来大量黄皮果的损失。目前关于黄皮的果皮、叶子、茎和根等的研究已经极大地扩展了黄皮资源的应用[3-12],但黄皮果肉的研究则主要集中于黄皮果酱、果脯、软饮料等初级产品的开发[13-18],而关于黄皮果肉膳食纤维的研究则未见相关报道。
膳食纤维是指在人体小肠内抵抗消化吸收而在大肠内能够完成或部分发酵的多糖类物质。研究表明可溶性膳食纤维(Soluble Dietary Fiber,SDF)的生理功能有助于预防高血脂、糖尿病、冠心病等疾病[19-22],黄皮果肉中SDF的制备有利于拓展黄皮果的精深加工,为黄皮果的深入开发利用提供参考。
目前对于膳食纤维的提取主要方法有酸碱法[23]、酶法[24]、超声波辅助酶法[25-26]、微波-化学法[27]等。酶法制备膳食纤维无溶剂残留,但不容易破坏提取物结构,且需要适宜的酶解温度。超声波的机械振动则有助于膳食纤维的溶出[28],微波则可提供高能使物质内外温度快速升高。三者的协调作用对膳食纤维提取的研究鲜有报道。因此,本实验以黄皮果肉为原料,利用响应面法采用超声波-微波协同辅助酶法萃取SDF,对SDF进行结构表征及单糖组分分析,为黄皮果肉SDF的开发利用提供理论基础。
1 材料与方法
1.1 材料与仪器
黄皮果 海南三亚南滨农场;糖化酶(10万U/g) 博立生物制品有限公司;纤维素酶(10万U/g) 和氏璧生物科技有限公司;95%乙醇、磷酸缓冲液、盐酸、亚硝酸钠、溴化钾(光谱级) 西陇科学股份有限公司;MES-TRIS缓冲液 天津市永大化学试剂有限公司;2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS) 合肥博美生物有限公司;1,1-二苯基-2-三硝基苯肼 日本东京化成工业株式会社;没食子酸、三氯化铁、福林酚试剂 国药集团化学试剂有限公司。
T6新世纪 紫外可见分光光度计 北京普析通用仪器有限责任公司;Pilot7-12E 真空冷冻干燥机 北京博医康实验仪器有限公司;TRACE 1300气相色谱仪 美国Thermo公司;IRAffinity-1 傅里叶变换红外光谱仪 日本岛津公司;XO-SM300超声波微波协同萃取仪 南京先欧仪器制造有限公司;HSC-2差示扫描量热仪 北京恒久实验设备有限公司。
1.2 实验方法
1.2.1 黄皮果肉SDF提取工艺 将一定比例的柠檬酸-柠檬酸钠缓冲液(pH4.0~4.5)加入黄皮果肉粉(M2)中并充分搅拌至混合均匀,加入一定比例的糖化酶、纤维素酶,于超声波-微波萃取仪中处理(控温模式55 ℃)[23]。处理液于4000 r/min转速下离心15 min,取上层液置于4倍的95%乙醇中,4 ℃下静置过夜。过夜物料4000 r/min转速下离心15 min,取沉淀物冷冻干燥,得到黄皮果肉SDF粗提物,称重得M1。SDF得率按下式计算:
式中:Y为SDF得率,%;M1为提取的粗SDF重量,g;M2为样品重量,g。
1.2.2 SDF净产率的测定 参考国标GB 5009.88-2014的方法[29],测定黄皮果肉中提取的粗SDF的纯度,纯度根据GB 5009.88-2014测定。利用公式计算净产率如下[30]:
膳食纤维净产率(%)=Y×纯度
式中:Y为SDF得率,%。
1.3 黄皮果肉中SDF的提取单因素实验
在固定温度为55 ℃,糖化酶用量为0.5%的基础上,单因素试验设计为:设定超声功率300 W、超声时间20 min、纤维素酶用量0.6%,考察料液比1∶10、1∶15、1∶20、1∶25、1∶30、1∶35 g/mL条件下SDF的得率;设定料液比1∶25 g/mL、超声功率300 W、纤维素酶用量0.6%,考察改变超声时间10、15、20、25、30 min条件下SDF的得率;设定料液比1∶20 g/mL、超声时间25 min、纤维素酶用量0.6%,考察改变超声功率100、200、300、400、500 W条件下SDF的得率;设定料液比1∶15 g/mL、超声功率300 W、超声时间15 min,考察纤维素酶用量0.2%、0.4%、0.6%、0.8%、1.0%、1.2%条件下SDF的得率。
1.4 超声波辅助提取SDF响应面优化试验
根据单因素试验结果,以SDF得率为指标,将料液比、超声时间、超声功率、加酶量为自变量,设计四因素三水平实验的Box-Behnken响应面试验,如表1所示,确定最佳提取条件。

表1 响应面试验因素与水平Table 1 Factors and levels of response surface experiment
1.5 黄皮果肉中SDF理化性质测定
1.5.1 膨胀力(SWC)的测定 称取SDF 100 mg放入10 mL的玻璃试管中,加纯水5 mL,振匀后在室温下放置24 h,即读取液体中膳食纤维的体积变化。膨胀力用每克干物质的膨胀体积来表示,计算如公式所示[31]。
SW(mL/g)=[膨胀后体积(mL)-干样品体积(mL)]/样品干质量(g)
1.5.2 持水力(WHC)的测定 称取SDF 0.5 g样品放入100 mL烧杯中,加入纯水10 mL,振动均匀后在37 ℃水浴中放置12 h,以4000 r/min,离心15 min后称重,计算如公式所示[32]。
1.5.3 持油力(OHC)的测定 准确称取0.1 g SDF置于1.5 mL的离心管中,加入1 g食用花生油,振动均匀后在37 ℃水浴中放置12 h,以4000 r/min,离心15 min后称重。计算如公式所示[33]。
OHC(g/g)=[吸附后的样品质量(g)-样品干质量(g)]/样品干质量(g)
1.6 SDF的结构表征
1.6.1 扫描电镜形貌观察 将冷冻干燥后的样品固定在样品台上镀金,镀金方法:离子溅射,镀金条件:15 kV、15 mA、2.5 min,最后将样品置于扫描电子显微镜(10 kV)下观察其显微结构。
1.6.2 傅里叶变换红外光谱的测定 精确称取干燥SDF样品2 mg于玛瑙研钵中,加入200 mg干燥的KBr晶体,在红外灯照射下轻轻研磨至极细混匀,用压片机压制成薄片,用红外分光光度计于400~4000 cm-1中红外区扫描,测定傅里叶变换红外光谱曲线[34]。
1.7 SDF单糖组分GC分析
1.7.1 单糖混合物的制备 称取制备样品50 mg于安瓿管中,加入10 mL 2 mol/L的三氟乙酸,酒精喷灯封口。将其放置于105 ℃干燥箱中水解8 h,待溶液冷却至室温后,70 ℃恒温水浴加热10 min。取样品水解液于具塞试管中,放入50 ℃、0.09 MPa真空干燥箱中干燥[35]。
1.7.2 糖腈乙酰化衍生反应 将1.7.1中真空干燥好的样品中加入50 mg盐酸羟胺、2.5 mL无水吡啶,加塞于90 ℃恒温水浴锅中加热30 min,用混合器振荡混匀,待其冷却至室温后加入5.0 mL无水醋酸酐,加塞于90 ℃恒温水浴锅中加热30 min,用混合器振荡混匀,冷却室温即为膳食纤维的单糖衍生物。
1.7.3 标准品单糖衍生化 准确称取各种单糖标准品10 mg,衍生方法参照1.7.2样品衍生化。
1.7.4 GC分析条件 色谱柱:日本岛津公司Rtx-1毛细管柱(0.5 μm×0.32 mm×30 m);检测器:氢火焰离子化检测器;载气:高纯氮,流速1 mL/min,分流比为45∶1。气化室温度:280 ℃;检测器温度:260 ℃;程序升温:120 ℃保持2 min,然后以10 ℃/min升至180 ℃,保持8 min,再以10 ℃/min升至240 ℃,保持5 min;240 ℃保持15 min;进样量:1 μL。
1.8 数据处理
采用Origin 9.1、Excel 2007、SPSS 18.0对数据进行统计分析。所有数据的表示方式为平均值士标准差(3次重复)。所有表中数据均为3次重复试验结果的平均值。
2 结果与分析
2.1 单因素实验结果
2.1.1 料液比对黄皮果肉SDF得率的影响 由图1可知,随着料液比的增大,SDF得率先升高再降低,在料液比为1∶20 g/mL时,得率达到最大值为12.05%。料液比从1∶10 g/mL到1∶20 g/mL,得率升高,可能是由于料液比增大使黄皮果肉粉在溶剂中扩散开来后,与溶剂的接触面积变大,使得率增大;料液比超过1∶20 g/mL后得率下降,可能是随着溶剂的增加,反应中的酶浓度降低,使得SDF得率降低,故选择料液比1∶20 g/mL为中心点。

图1 料液比对得率的影响Fig.1 The influence of materialliquid ratio on extraction rate

图2 超声时间对得率的影响Fig.2 The effect of ultrasonictime on the extraction rate
2.1.2 超声时间对黄皮果肉SDF得率的影响 由图2可知,随着超声时间的增长,得率整体呈上升的趋势,在25 min时,得率趋于平缓,一定的超声波时间可以使溶剂同物料更好地接触,超声波的机械振动和空穴效应加快了果肉粉内部的分子移动速度,提升了酶解的效率,使超声提取的效果更好。但在超声时间30 min时,醇沉后得到的物质呈果冻状,出现这一现象可能是因为超声时间增加,超声波的机械剪切作用使膳食纤维及果肉中的其他大分子结构遭到破坏[36],从而被部分降解溶出至上层清液中,并在随后的醇沉处理中与可溶性膳食纤维一并沉淀。故选择超声时间25 min为中心点。
2.1.3 超声功率对黄皮果肉SDF得率的影响 由图3可知,随着超声功率升高,得率呈现先升高再降低的趋势,且趋势较为明显。在超声功率为300 W时,达到最大得率为12.01%。在超声功率小于300 W时,得率升高,是因为超声波具有一定的空化作用和机械振动的特性,随着超声功率的增大,可以在短时间内使黄皮果肉的组织受到破坏,使其中果胶等可溶性物质加速进入缓冲溶剂中,得率升高,在功率为300 W时达到最大。而在超声功率大于300 W时,得率开始下降,出现这一结果的原因可能是,高功率的机械剪切的作用过于剧烈,使SDF结构也遭到破坏[37],同时超声波功率过大,会引起纤维酶开始失活,使酶解反应无法顺利进行[25],从而造成SDF得率急速下降。故选择超声功率300 W为中心点。

图3 超声功率对得率的影响Fig.3 The influence of ultrasonicpower on extraction rate
2.1.4 加酶量对黄皮果肉SDF得率的影响 由图4可知,随着纤维素酶添加量的增加,SDF得率呈现先增加再减少的趋势,且趋势较为明显。在纤维素酶添加量为0.6%时,达到最大得率12.48%。继续增大纤维素酶添加量,SDF得率呈下降趋势。这是因为随着纤维素酶用量的提高,纤维素酶将IDF降解为溶解度更高的葡聚糖,SDF得率随着增大,当纤维素酶用量达0.6%时,SDF得率达到最大。当继续增大酶的用量,纤维素酶会将葡聚糖水解为分子量更低的寡葡聚糖、纤维二糖和单糖,在随后的醇沉反应中难以沉淀,因此SDF得率会明显下降[38]。故选择加酶量0.6%为中心点。

图4 加酶量对得率的影响Fig.4 The effect of enzyme quantity on extraction rate
2.2 响应面试验结果
2.2.1 响应面模型的建立与分析 利用SAS 9.3建立响应面模型并进行数据分析,根据Box-Behnken设计,以得率为响应值,料液比、超声时间、超声功率、加酶量为因变量,设计4因素3水平的响应面分析实验,空白实验重复3组,共27 组。试验因素水平结果如表2所示,方差分析结果见表2所示。

表2 响应面设计试验及结果Table 2 Response surface design and results
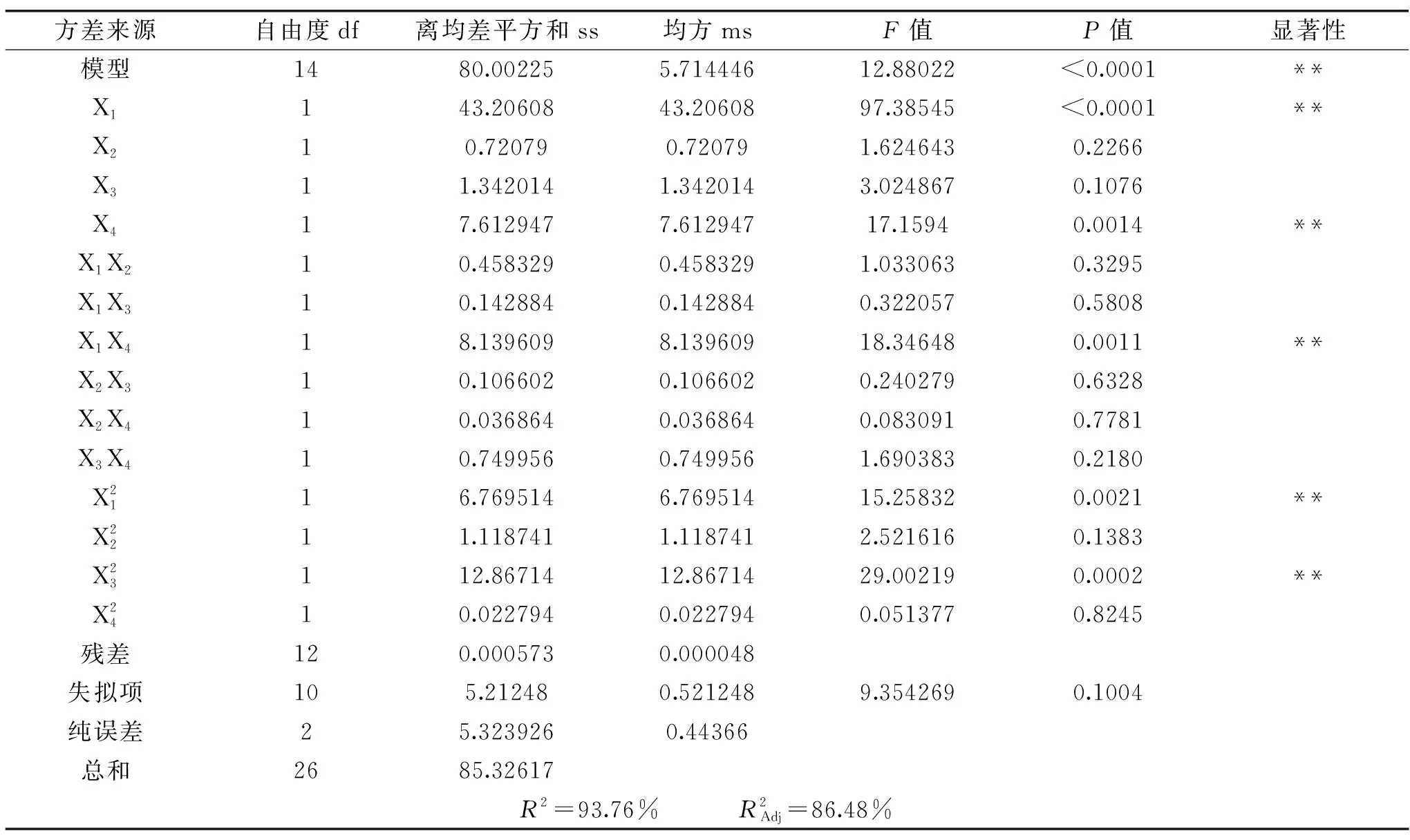
表3 方差分析Table 3 Variance analysis
对照表2中的数据进行回归分析,得到如下二次回归方程:

2.2.2 响应面分析 如图5所示,当其他因素水平不变时,两个因素水平发生变化对响应值所发生的影响情况图。等高线的形状可以反映不同因素之间交互作用的强弱,等高线为鞍型或椭圆形表示两者交互作用显著,等高线为圆形则表示两者交互作用不显著[39]。图5c响应面的曲线走势陡峭,等高线为鞍型,说明料液比和加酶量两个因素相互作用显著;其他交互作用对应的响应面曲面较平缓,表明对响应值无显著影响,同表3的方差分析结果一致。

图5 提取条件对黄皮果肉SDF得率影响的交互作用响应面图Fig.5 Response surface plots of interaction between various extraction conditions on yield of SDF from Clausena lansium sarcocarp
2.2.3 回归模型的验证 利用SAS软件进行分析,得到黄皮果肉中SDF最佳提取工艺为,X1料液比1∶22.97 g/mL、X2超声时间24.37 min、X3超声功率279.52 W、X4加酶量0.64%。预测SDF得率Y理论值为12.57%。结合实验可操作性,将最优提取工艺实验参数确定为:料液比1∶23 g/mL、超声时间25 min、超声功率280 W、加酶量0.64%。称取等量黄皮果肉5份,按照实验确定的工艺条件进行验证实验,得到的SDF得率平均值为12.55%,与预测值相差0.13%,纯度为79.65 g/100 g,净产率为10.00%,进一步验证了该回归模型的拟合度较好,模型较为合理有效。
2.3 黄皮果肉SDF的理化性质
对制备的黄皮果肉SDF进行理化特性指标测定,结果见表4。

表4 SDF的理化性质Table 4 Physicochemical properties of SDF
由表4可知,SDF具有较强的膨胀性,其膨胀力为39.25 mL/g,说明SDF中亲水基团和保持水分的网络结构所占比例较高。SDF具有一定的持水力,充分吸水后导致内容物体积增大,增强饱腹感,加快人体代谢,有助于预防结肠癌等肠道疾病[40];SDF具有一定的吸油力,可吸收脂肪,防止脂肪的堆积。黄皮果肉SDF与蓝莓果渣[41]SDF的膨胀力(40.34 mL/g)相比,均有较高的膨胀力,说明黄皮果肉SDF有一定的开发潜力。
2.4 可溶性膳食纤维的结构表征
2.4.1 可溶性膳食纤维扫描电镜结果 图6可知黄皮果肉SDF在高倍镜下放大600倍结构呈片状,在1000倍下可见片状结构表面呈现褶皱状、致密,在3000倍和5000倍下SDF表明则平滑,呈现褶皱状,凹槽深,相对表面积大。

图6 水溶性膳食纤维的扫描电镜结果Fig.6 SEM results of water-soluble dietary fiber
2.4.2 傅里叶变换红外光谱 由图7可知,SDF在3200~3500 cm-1内出现较强的吸收峰,为O-H的伸缩振动峰,由于分子间和分子内氢键的形成,此处吸收峰较宽,说明其中处于缔合状态的氢键较多[42]。在2800~2933 cm-1附近出现吸收峰,是糖类甲基和亚甲基的C-H键的伸缩振动峰[43];1200~1400 cm-1附近出现的是C-H变角振动峰,这些吸收峰都是糖类的特征吸收峰。在1600 cm-1附近出现了较强的吸收峰,是羧基COO-的特征峰。在1000 cm-1附近存在较大吸收峰,是由两种C-O伸缩振动引起的,分别为C-O-H和糖环C-O-C,或者由一级醇的O-H变角振动引起,因此分子存在C-O-H和糖环C-O-C结构。810 cm-1处有吸收,表明含半乳糖。1418 cm-1附近是C-H的弯曲振动峰,是木聚糖的特征峰[45]。SDF具有糖类的特征吸收峰,有多糖红外图谱的典型特征[46]。

图7 SDF的傅里叶变换红外光谱分析Fig.7 Fourier transform infrared spectroscopy analysis of SDF
2.5 DF中单糖组成成分含量测定结果分析
2.5.1 单糖线性回归方程 以各峰面积(pA)为纵坐标(Y),各标准品的质量(mg)为横坐标(X)绘制标准溶液曲线,计算回归方程及决定系数。

表6 样品中单糖的含量Table 6 Monosaccharide content in sample
结果见表5,决定系数R2均大于0.98,说明方程拟合良好。

表5 各种单糖的回归方程及决定系数Table 5 Regression equations and correlationcoefficients of various monosaccharides
2.5.2 黄皮果肉DF中单糖组分分析 通过对标准品和样品的衍生物进行气相色谱分析,对比保留时间对本试验选取的单糖进行定性分析,由于其他杂质成分的干扰,在标样和样品中都出现了一些杂峰。单糖标准品衍生物及黄皮果肉SDF GC出峰图见图8、图9。

图8 标准单糖GC出峰图Fig.8 GC chromatogram of monosaccharides注:1:鼠李糖;2:阿拉伯糖;3:半乳糖;4:葡萄糖;5:甘露糖;6:山梨糖。
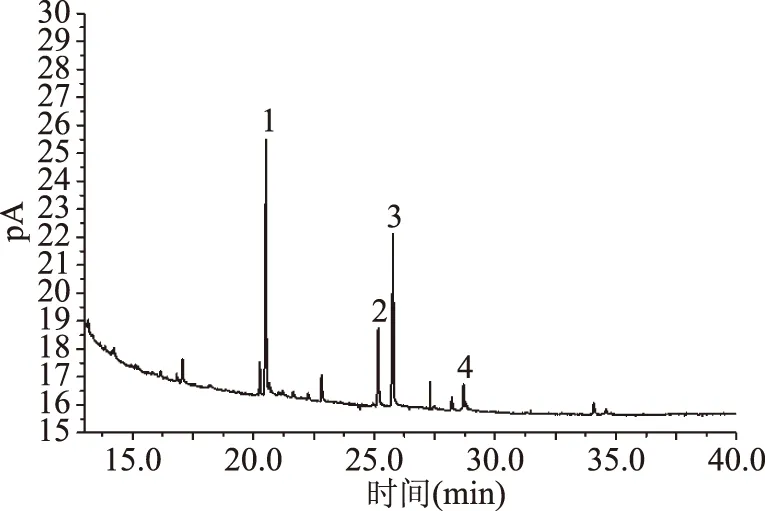
图9 SDF中单糖衍生物的气相色谱图Fig.9 Gas chromatogram of monosaccharide derivatives in SDF注:1:阿拉伯糖;2:半乳糖;3:葡萄糖;4:甘露糖。
经对比标准单糖样品衍生物和黄皮果肉SDF的保留时间发现,通过比对标准样品的峰面积,结果见表6。SDF中四种单糖的摩尔比为:12∶7.5∶3∶1(阿拉伯糖∶葡萄糖∶半乳糖∶甘露糖)。SDF中含量较高的单糖依次为阿拉伯糖(36.31%)、葡萄糖(27.59%)。阿拉伯糖、半乳糖主要来自于半纤维酸水解产生的已糖和戊糖[47],研究表明[48],可溶性半纤维素能降低食用高胆固醇饮食大鼠的血清TC及肝脏脂肪积累,可溶性膳食纤维来源的扩展有利于食品行业的不断发展。
3 结论
在固定温度为55 ℃,糖化酶用量为0.5%的基础上,黄皮果肉中SDF的最佳提取条件为:料液比1∶23 g/mL、超声时间25 min、超声功率280 W、纤维素酶加酶量0.64%,SDF得率平均值为12.55%。纯度为79.65 g/100 g,净产率为10.00%。黄皮果肉SDF的形貌紧密,表明呈现光滑的褶皱型,傅里叶红外光谱具有多糖类的特征吸收峰。黄皮果肉SDF含有四种单糖,其中阿拉伯糖(36.31%)、葡萄糖(27.59%)含量较高。黄皮果肉SDF具有较强的膨胀性,其膨胀力为39.25 mL/g,说明SDF中亲水基团和保持水分的网络结构所占比例较高。黄皮果肉中可溶性膳食纤维的研究有利于黄皮果精深加工的开发,延伸黄皮果产业链,为黄皮果的应用于食品加工奠定一定的理论基础。

