植物内生细菌MY1 的分离、鉴定及其防治效果
马东丽,石玉星,张宝俊,任 璐
(山西农业大学植物保护学院,山西太谷030801)
从植物中发掘具有抑制病原物生长或增强植物抗病能力的植物内生菌是新农药研究和创制的方向之一。其中,植物中的内生细菌已在多种植物的不同组织中被分离筛选出来,并且是迄今为止发现的相对丰富的生防资源,其制剂不仅降低了化学农药用量,还缓解了化学农药带来的负面问题,对绿色和低毒化农药的发展具有重要意义。已有研究显示,一些内生细菌在植物病害的生物防治上具有良好的效果[1-3]。ARIMA 等[4]研究报道,枯草芽孢杆菌(Bacillus subtilis)可抗菌、抗病毒;PAPAVIZAS[5]和 HWAGNG 等[6]报道了利用(Bacillus subtilis)可防治多种土传真菌病害。
随着对植物内生细菌认识的不断加深,其分离源也不断扩大。目前,已报道的植物分离源主要有药用杂草、粮食作物、药用树木、蔬菜等陆生植物。另外,近年来随着生物保鲜领域的发展,其分离源也扩大到采后海生植物、果蔬及种子[7-9]。从不同植物中分离到的内生菌能产生抑菌活性物质,其可以抑制或杀死植物病原菌,从而增强植物的抗病性[10-12],或者植物内生细菌还可通过竞争营养物质等方式来诱导植物抗病性的产生[13]。水稻、玉米等多种植物内生菌已被广泛应用于植物病害的生物防治[14-15]。
曼陀罗(Datura stramonium)是茄科曼陀罗属野生、直立、木质的1 年生大型草本植物,普遍生长于温带、热带地区,并且在全国各地广泛分布[16]。曼陀罗中所含的生物碱对多种疾病的治疗研究在病理方面已取得重大成果[17]。周静等[18]研究发现,曼陀罗提取物对菜青虫和黏虫均具有触杀和拒食作用。但目前尚未见曼陀罗内生菌对植物病原真菌具有拮抗作用的相关报道。
本研究从曼陀罗中筛选出1 株对多种植物病原真菌具有良好抑制作用的内生细菌,并对其杀菌谱、分类地位及防治效果进行研究,以期为利用拮抗内生细菌进行植物病害的生物防治奠定理论基础。
1 材料和方法
1.1 试验材料
供试植物材料均是摘取健康无伤的组织,装入无菌样品袋中,带回实验室即刻进行内生菌分离。植物组织包括柽树茎,番茄根、茎、叶,花椒果实,葡萄茎、叶,辣椒根、茎、叶,曼陀罗叶、花,醉鱼草根、茎、叶。
供试植物病原真菌为菜豆菌核病菌(Sclerotinia sclerotiorum),菜豆炭疽病菌(Colletotrichum lindemuthianum),番茄灰霉病菌(Bortytis cinerea),番茄早疫病菌(Alternaria solani),谷瘟病菌(Pyricularia grisea),黄瓜灰霉病菌(Botrytis cinerea),胡萝卜褐腐病菌(Leptosphaeria libanotis),核桃腐烂病菌(Monilinia laxa),辣椒枯萎病菌(Fusarium oxysporium),棉花立枯病菌(Rhizoctonia solani),苹果腐烂病菌(Valsa mali),桃褐腐病菌(Monilinia fructicola),西瓜枯萎病菌(Fusarium oxysporum),小麦赤霉病菌(Fusarium graminearum),均由山西农业大学植物化学保护实验室保存提供。
1.2 试验方法
1.2.1 植物内生细菌的分离 采用裴淑兰等[19]的方法进行内生细菌的分离。分别对不同植物的根、茎、叶和果实进行无菌水超声波清洗,晾干后切成适合的小块;依次浸泡于75%乙醇2 min、3%次氯酸钠30 s、75%乙醇30 s,每次浸泡后均用无菌水冲洗3 次;后放入无菌研钵中,加入10 mL 无菌水,研碎后取汁液稀释后涂布于NA 平板培养基上,每浓度3 次重复,30 ℃下培养3~7 d;待平板内长出菌落后,根据菌落颜色、大小、突起特征等挑取形态差异较明显的菌落,用平板划线法转接于空白NA 平板,对新长出的菌落再划线分离2~3 次,获得纯培养物,转接于NA 斜面,于4 ℃保存。
1.2.2 内生拮抗细菌的筛选
1.2.2.1 初筛 经预试验选取Pyricularia grisea 为靶标菌,采用谢宗华等[20]的四点平板对峙法筛选出拮抗菌株。用直径5 mm 的打孔器在已培养5 d 的Pyricularia grisea 病菌菌落边缘取菌饼,并接种在PDA 平板中央,然后接种已分离纯化的供试内生细菌于四周20 mm 处;对照组仅接种Pyricularia grisea,每处理重复3 次。在28 ℃恒温倒置培养7 d 后,观察是否有抑菌带产生,并测定抑菌带大小,计算抑制率。
1.2.2.2 复筛 以Pyricularia grisea 为靶标菌,通过生长速率法进行复筛。将分离纯化后的内生细菌接种到LB 培养基中,在30 ℃、160 r/min 下振荡培养72h;终止发酵后,在 4℃、12000r/min 下离心 10min,弃去菌体,收集上清发酵液,并通过0.22 μm 微孔滤膜过滤,得到发酵滤液;将发酵滤液和PDA 培养基按1∶9(V∶V)比例均匀混合,以制备平板;待平板培养基固化后接入Pyricularia grisea 菌饼,并在26.5 ℃的恒温培养箱中倒置培养,以空白PDA 仅接种Pyricularia grisea 为对照,每处理进行3 次重复,培养7 d 后,通过十字交叉法测定菌落直径,计算抑制率。
1.3 测定项目及方法
1.3.1 内生拮抗细菌MY1 抑菌谱测定
1.3.1.1 菌株MY1 抑菌活性测定 采用1.2.2.1 的平板对峙法,测定菌株MY1 对多种供试病原真菌的抑制率。
1.3.1.2 菌株MY1 代谢物抑菌活性的测定 采用1.2.2.2 的生长速率法,测定菌株MY1 的发酵液对多种供试病原真菌的抑制率。对制得的发酵液分别进行2 种处理:一种是通过0.22 μm 微孔滤膜过滤;另一种是在高温灭菌锅121 ℃灭菌30 min;以2 种方式处理的发酵液和PDA 培养基按1∶9(V∶V)的比例混合均匀以制备平板。采用生长速率法分别测定对14 种病原菌的抑制活性;培养3~7 d 后测定各个菌落直径,计算抑制率。
1.3.2 菌株MY1 鉴定 将菌株MY1 点接于NA 培养基上,26.5 ℃活化培养24 h 后,用肉眼直接观察菌落的颜色、光泽、质地、边缘情况、表面情况、透明度等形态特征;用扫描电镜观察内生细菌MY1 的菌体、芽孢形态及大小。
参照《常见细菌系统鉴定手册》[21]对菌株MY1的生理生化特征进行鉴定。将菌株MY1 的16SrDNA序列(测序由宝生物工程(大连)有限公司完成)与GenBank 中序列进行BLAST 比对,选择与之有高度同源性的菌株基因序列,使用MEGA 5.05 软件分析并构建菌株MY1 的系统发育树。
1.3.3 菌株MY1 防效测定
1.3.3.1 预防效果测定 选取5、6 叶期长势一致的番茄幼苗,在叶片分别喷洒MY1 发酵液原液、5 倍、10 倍、20 倍、50 倍、100 倍稀释液以及对照药剂腐霉利(50%WP)和清水对照。待自然晾干后,接种灰霉病菌和早疫病菌菌饼(直径5 mm),置于24 ℃、95%相对湿度下培养3 d,后采用十字交叉法测定每片叶片的病斑直径,计算防治效果。每处理10 株,每株调查5 片叶片。
1.3.3.2 治疗效果测定 在叶片上接种灰霉病菌和早疫病菌菌饼,24 h 后喷洒1.3.3.1 各处理液;后置于24 ℃、95%相对湿度条件下培养3 d,测定每片叶片的病斑直径,计算防治效果。每处理10 株,每株调查5 片叶片。
2 结果与分析
2.1 植物内生细菌的分离及筛选
根据菌落形态、颜色、湿润度等特征,分别从不同植物组织中分离得到87 株拮抗细菌,其中,根部23 株、茎部 25 株、叶部 30 株、果实部 9 株,叶部分离到的拮抗细菌最多,占34.5%。
随机选择17 株内生细菌菌株进行初步筛选,17 株拮抗细菌均对Pyricularia grisea 具有一定的抑制作用,且抑制率在45.36%~69.17%,其中,菌株MY1 对Pyricularia grisea 的抑制率最高。
测定了17 株内生细菌发酵液的抑菌活性,抑制率在16.93%~91.33%,其中,菌株ZJ1 和MY1发酵液对Pyricularia grisea 的抑菌率较高,分别达到91.33%和90.6%。可以选择菌株ZJ1、MY1 进行后续研究,本研究选择曼陀罗内生细菌MY1 进行鉴定及抑菌谱的测定。
2.2 内生拮抗细菌MY1 抑菌谱测定结果
2.2.1 菌株MY1 抑菌活性测定 试验结果表明,菌株MY1 对供试病原真菌具有一定的抑制作用,抑制率在50.06%~100%(表1),其中,对桃褐腐病菌和谷瘟病菌的抑制率较高,分别达到98.95%和92.65%;对于菜豆炭疽病菌的抑菌效果较差,抑制率为50.06%;对其他病原真菌的抑制率在59.56%~76.86%。抑菌效果如图1 所示。
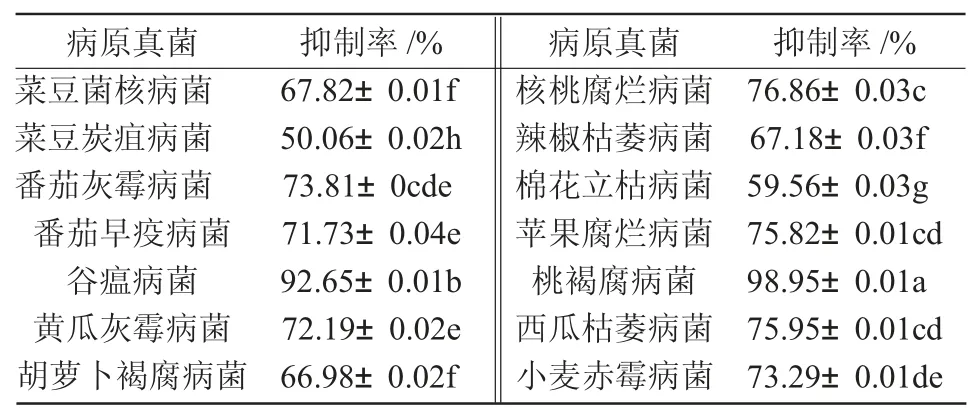
表1 菌株MY1 对14 种病原真菌的抑制作用
2.2.2 菌株MY1 发酵液抑菌活性测定结果 对发酵液过微孔滤膜后,MY1 发酵液对14 种病原真菌的抑制率在76.65%~100%(表2),其中,抑制率在95%以上的有桃褐腐病菌、谷瘟病菌、黄瓜灰霉病菌、苹果腐烂病菌、核桃腐烂病菌5 种病原真菌;抑制率在90%~95%的有4 种、80%~90%的有3 种、在75%~80%的有2 种。经高温处理后,对14 种病原真菌的抑制率仅有2.54%~49.85%,其中,仅对黄瓜灰霉病菌和谷瘟病菌的的抑制率在45%以上;抑制率低于20%的有9 种、介于25%~45%的有3 种,抑菌作用较过微孔滤膜处理明显减弱。抑菌效果如图2 所示。

表2 菌株MY1 发酵液对14 种病原真菌的抑制率分析 %
2.3 内生细菌MY1 的鉴定
2.3.1 菌落形态特征观察 曼陀罗内生菌MY1 培养性状:菌落为米白色,边缘裂叶状,表面干燥且不透明(图3),表明菌株MY1 与芽孢杆菌属(Bacillus sp.)较为相似;扫描电镜观察发现,MY1 菌株菌体呈杆状,周生鞭毛,大小为(0.5~1.5)μm×(1.5~2.0)μm(图 4)。
2.3.2 生理生化鉴定 对菌株MY1 各项生理生化指标进行鉴定,生理生化检测结果表明,菌株MY1可以利用柠檬酸盐与接触酶反应,并可以发酵葡萄糖,甲基红试验呈阴性,V-P 测定呈阳性,并且可水解淀粉和纤维素,硝酸盐还原呈阳性,亚硝酸还原呈阴性,吲哚试验呈阴性,可使明胶部分液化,可产生硫化氢,并且可氧化乙醇和乙酸。该菌株可耐受4、20、30、37、41、45、65 ℃的环境,可以在含有 2%~10%的NaCl 培养液中生长,对甘露醇、麦芽糖、蔗糖、乳糖、葡萄糖5 种碳源均有较好的利用率。结合形态特征和生理生化特征,菌株MY1 初步被鉴定为甲基营养型芽孢杆菌(Bacillus methylotrophicus)。
2.3.3 分子生物学鉴定 菌株MY1 16S rDNA 全序列解析,获得序列长度为1 427 bp,测序后的序列上传至GenBank(登录号为MN055702);将16S rDNA 序列与GenBank 中登录相似的16S rDNA 序列进行比对,选取具有较高同源性的菌株基因序列,使用MEGA 5.05 软件进行分析,并采用Neighbor-Joining 法构建MY1 菌株的系统发育树,结果显示(图 5),MY1 菌株与 Bacillus methylotrophicus 聚于同一分支,同源性达到100%,具有较高的亲缘关系。综合形态及生理生化鉴定结果,初步将菌株MY1 确定为甲基营养型芽孢杆菌。
2.4 内生拮抗细菌MY1 防治效果测定
菌株MY1 发酵液原液及各稀释倍数发酵液均对番茄灰霉病和番茄早疫病具有一定的预防和治疗效果(表3),其中,发酵液原液及5~50 倍发酵液稀释液对灰霉病和早疫病的防治效果均超过60%,其中,5 倍稀释发酵液的预防和治疗效果最好,对灰霉病分别达到86.4%和80.2%,对早疫病分别达到88.9%和82.6%,且与50%腐霉利WP 对照药剂的预防和治疗效果间没有显著差异;发酵液原液的防治效果低于5 倍稀释发酵液和对照药剂,且预防效果高于治疗效果。

表3 发酵液对盆栽番茄灰霉病和早疫病的防治效果 %
3 结论与讨论
植物内生细菌是一种生防资源,其分布广、种类多、存在于绝大多数植物中,在生物防治中具有重要意义[22]。许多野生植物由于生长时间长、抗逆性强、生长环境复杂等特性,成为筛选内生细菌的有利植物资源[23]。本研究从柽树、番茄、花椒、葡萄、曼陀罗和醉鱼草等植物的不同组织中共分离得到87 株内生细菌,根、茎、叶和果实中均可以分离得到,通过生长速率法筛选发现,对谷瘟病菌抑制作用高于80%的内生细菌有7 株,其中5 株来源于野生草本植物,且从草本植物茎和叶中分离的内生细菌数量高于根部,这与林木组织中内生细菌分布以根部最多存在差异[24],其原因还有待进一步研究。
本研究测定曼陀罗内生细菌MY1 的抑菌谱发现,该菌株抑菌谱较广,特别对桃褐腐病菌和桃褐腐病菌抑制率高达90%以上,且发酵液抑菌活性高于活菌菌体。该菌株的抑菌活性同已报道的多株植物内生细菌相比具有更高的抑菌活性[25-27],说明菌株MY1 在植物病害防治中具有良好的应用潜力。今后还需进一步进行室内盆栽试验及田间防效研究。
《常见细菌系统鉴定手册》[21]从形态学及生理生化的角度为细菌鉴定提供了参考,并对植物内生细菌的种类进行了大致的分类,但是,由于同属内生细菌或近缘内生细菌的形态特征和生理生化特征较为接近,因此,仅凭这些特征很难对种别进行判定。近年来,16S rDNA 序列分析已被广泛应用于细菌鉴定和系统分类研究,以有效区分无法依靠形态及生理生化特性区分的菌株,这是一种常用且较为准确的细菌鉴定方法。本研究结合形态学、生理生化鉴定以及16S rDNA 序列分析方法,将菌株MY1 鉴定为甲基营养型芽孢杆菌(Bacillus methylotrophicus)。但是这3 种手段的联合使用对于一些近缘种依然较难准确鉴定,由于序列间的相似度太高,16S rDNA 基因序列分析往往容易失效[23,28],如区分枯草芽孢杆菌(Bacillus subtilis)和解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。因此,可以进一步加入一些特异基因(如芽孢杆菌中的gyrA 和gyrB),从而更加准确地确定其分类地位[29]。
本研究表明,菌株MY1 发酵液对番茄灰霉病和早疫病具有较好的防治效果,推测该菌株主要是通过产生抗菌物质发挥作用。室内盆栽防效同已报道的多株生防内生细菌相比较相似[30-33]。但由于菌株本身、番茄品种、试验条件以及处理方式和处理时间的不同,防效略有差异,且不同来源菌株和不同种菌株,在植物病害的防治上存在一定差异,还需进一步加强其定殖特性和田间防效的研究。
本研究对菌株MY1 的抑菌特性和分类地位进行了探讨,除此之外,关于甲基营养型芽孢杆菌生物防治的研究报道还包括生防机制研究、可湿性粉剂制备和乳悬剂制备等[34-36],今后将继续进行菌株MY1 抑菌物质的鉴定及抑菌机制的探索,并进行生防菌剂的制备,以期明确其生防机制和田间应用价值,为微生物农药的开发奠定基础。

