血红铆钉菇多糖超声微波联合提取工艺优化及其抗氧化活性
岳峥嵘,赵 博,张国财,吕明帅,张方明(东北林业大学林学院,黑龙江哈尔滨 150040)
血红铆钉菇[Chroogomphusrutilus(Schaeff.)O.K. Mill.]属牛肝菌目(Boletales)铆钉菇科(Gomphidiaceae)色钉菇属(Chroogomphus),是一种松属针叶树木外生大型菌根真菌[1-2],亦是我国珍贵的传统食药用菌之一[3]。研究表明,血红铆钉菇富含蛋白质[4]、多糖[5]、黄酮[6]、香豆素[7]及甾醇[8]等多种活性物质,具有极高的食用和药用价值。
多糖作为食用菌重要的活性成分[9],具有抗肿瘤[10]、抗氧化[11]、抗疲劳[12]、免疫调节[13]等诸多药理作用。然而,迄今关于血红铆钉菇多糖开发的研究较少,对其提取工艺进行系统研究亦鲜有报道。Wang等[11]以传统水提法提取血红铆钉菇子实体粗多糖,提取时间2.5 h得率仅为6.02%±0.15%。超声微波联合提取法具有提取时间短[14]、对活性物质影响较小[15]、得率高[16]等优点,目前已在多种食药用菌多糖提取研究中得到应用[17-19]。
因此,本文采用响应面法对超声微波联合提取血红铆钉菇多糖工艺进行优化,并与超声波提取法和传统水提法的提取效果和抗氧化活性进行比较分析,旨在提供高效血红铆钉菇多糖提取工艺,为其进一步研发和应用提供参考。
1 材料与方法
1.1 材料与仪器

JY92-IIN型超声波细胞粉碎机 宁波新芝生物科技股份有限公司;MDS-6型微波快速制样系统 上海新仪微波化学科技有限公司;DID-S14型电热恒温水浴锅 上海森信实验仪器有限公司;SHB-CIA型循环水式真空泵 郑州长城科工贸有限公司;Ultrospec 5300pro型紫外分光光度计 美国通用电气医疗集团;Thermo Heraeus BIOFUG型高速冷冻离心机 赛默飞世尔科技有限公司。
1.2 实验方法
1.2.1 提取工艺 将新鲜的血红铆钉菇子实体置于烘箱中,45 ℃条件下鼓风干燥至恒重,将烘干后的样品粉碎过80目筛,备用。以蒸馏水为提取液,在不同提取条件下,按照先超声后微波的操作顺序,以超声微波联合提取法提取血红铆钉菇多糖,抽滤除去残渣,取滤液以四倍量无水乙醇醇沉过夜,9000 r/min条件下离心20 min,取沉淀以Sevag法[20]除去蛋白。将除去蛋白的样品用四倍量无水乙醇醇沉过夜,次日离心后分别用乙醇、丙酮、乙醚洗涤沉淀,将样品溶解后,在截流量3500 Da条件下透析48 h,浓缩透析液后进行冷冻干燥,得血红铆钉菇粗多糖粉末。
1.2.2 单因素实验 以血红铆钉菇粉末为原料,以超声微波联合提取法进行多糖提取,研究超声时间(5.0、7.5、10.0、12.5、15.0 min)、超声功率(390、455、520、585、650 W)、微波时间(2、5、8、11、14 min)、微波温度(60、70、80、90、100 ℃)及液料比(10∶1、20∶1、30∶1、40∶1、50∶1 mL/g)对血红铆钉菇多糖得率的影响。固定提取条件为:超声时间7.5 min,超声功率520 W,微波时间8 min,微波温度90 ℃、液料比30∶1 mL/g,以多糖得率作为指标评价提取效果。
1.2.3 响应面试验设计 根据单因素实验所得结果,选取对多糖得率影响较大的四个因素(超声时间、微波时间、微波温度、液料比),选用Box-Behnken模型,对以上因素进行4因素3水平响应面设计,以多糖得率为响应值对多糖提取工艺进行优化,试验因素与水平设计见表1。各处理组重复3次,取平均值。
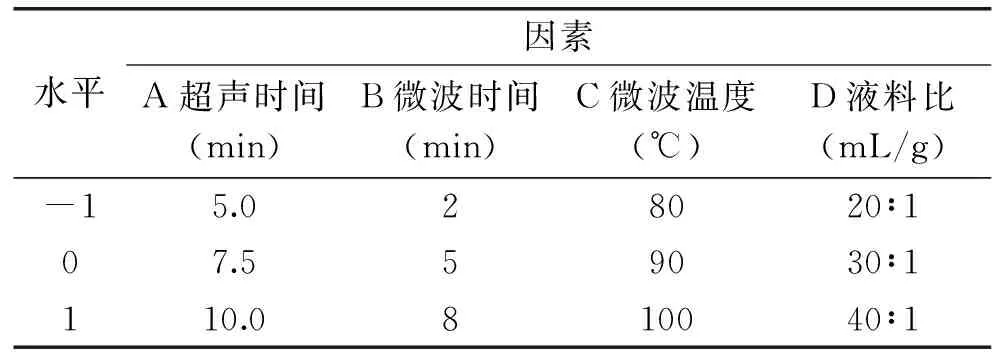
表1 响应面试验设计Table 1 Response surface design
1.2.4 多糖含量测定及得率计算方法 采用苯酚-硫酸法[21]进行测定。线性回归方程为:y=15.33x+0.2439(y为吸光值;x为多糖质量浓度),R2=0.9975。根据标准曲线计算多糖含量,按公式(1)计算得多糖得率:
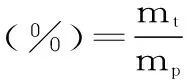
式(1)
式中,mt为样品所含多糖质量(g);mp为样品原料粉末质量(g)。


1.3 数据处理
采用Design-Expert 8.0.6软件选用Box-Behnken模型进行响应面试验设计,试验所得数据使用SPSS 17.0软件处理并进行单因素方差分析。
2 结果与分析
2.1 单因素实验结果
由图1a可知,在研究超声时间对多糖得率影响的实验中,得率随超声时间的增加呈先上升后下降趋势,且不同超声时间下多糖得率差异极显著(P<0.01)。当超声时间为7.5 min时,多糖得率最高为7.61%±0.13%。
由图1b可知,在研究超声功率对多糖得率影响的实验中,得率受超声功率影响变化的幅度不大,除390和520 W两组间存在显著差异外(P<0.05),其余各组间差异不显著(P>0.05)。当超声功率为520 W时,多糖得率最高为7.37%±0.22%。
由图1c可知,在研究微波时间对多糖得率影响的实验中,得率随微波时间的增加呈先上升后下降趋势,各组之间差异极显著(P<0.01)。当微波时间为5 min时,多糖得率最高为8.43%±0.11%。
由图1d可知,在研究微波温度对多糖得率影响的实验中,得率随微波温度的升高呈先上升后平稳趋势,各组之间差异极显著(P<0.01)。当微波温度为90 ℃时,多糖得率最高为7.17%±0.10%。
由图1e可知,在研究液料比对多糖得率影响的实验中,得率随液料比的提高呈先上升后下降趋势,不同液料比对多糖得率影响极显著(P<0.01)。当液料比为30∶1 mL/g时,多糖得率最高为7.20%±0.11%。

图1 超声时间(a)、超声功率(b)、微波时间(c)、微波温度(d)及液料比(e)对多糖得率的影响Fig.1 Effects of ultrasonication time(a),ultrasonic power(b),microwave time(c),microwave temperature(d)and liquor to solid ratio(e)on polysaccharides yield注:不同小写字母表示差异显著(P<0.05);不同大写字母表示差异极显著(P<0.01);字母相同表示差异不显著(P>0.05)。
方差分析结果表明,超声时间、微波时间、微波温度、液料比对多糖得率的影响均为极显著(P<0.01),相比之下,超声功率对多糖得率影响较弱,因而选用超声时间5 min、微波时间5 min、微波温度90 ℃、液料比30∶1 mL/g、超声功率520 W作为提取条件较为适合。分析可知,随着超声时间、微波时间的提高,在一定范围内得率会出现下降情况,长时间的超声波机械作用或微波热效应过强可导致部分多糖发生降解[24];而液料比在一定范围内得率也会下降,原因可能是提取液的增加对血红铆钉菇细胞内其他活性物质的溶出效果显著高于多糖,细胞内外渗透压发生变化,从而限制到多糖的溶出。
2.2 响应面优化试验结果
2.2.1 响应面试验结果 根据单因素实验结果,选取超声时间、微波时间、微波温度、液料比四个因素,采用四因素三水平进行设计,响应面试验方案及结果见表2。

表2 响应面试验结果Table 2 Response surface design experimental results


表3 回归模型方差分析Table 3 Analysis of varfance for the fitted quadratic polynomial model
2.2.3 各因素交互作用分析 由图2和表3可知,超声时间、微波时间、微波温度和液料比4个单独因素对多糖得率均有高度显著影响(P<0.001);交互作用方面,AB、AC、AD和CD响应面交互作用高度显著(P<0.001),BC响应面交互作用极显著(P<0.01),BD响应面交互作用不显著(P>0.05)。

图2 各因素交互作用下血红铆钉菇多糖得率Fig.2 Response surface plots showing the interactive effects of four extraction parameters on extraction polysaccharides
2.2.4 优化提取工艺参数验证 对回归方程进行分析可知,经优化所得血红铆钉菇多糖最佳提取工艺条件为:超声时间7.74 min、微波时间5.64 min、微波温度91.95 ℃、液料比28.58∶1 mL/g,得率预测值为8.77%。为便于实际操作,选取超声时间8 min、微波时间6 min、微波温度92 ℃、液料比29∶1 mL/g对提取工艺进行验证,在此条件下,重复3次试验,得到血红铆钉菇多糖得率为8.69%±0.19%,与预测值相近,说明模型预测较为准确。
2.3 不同提取方法的血红铆钉菇多糖体外抗氧化能力比较
2.3.1 血红铆钉菇多糖对总还原力的影响 由图3a可知,在0.5~5.0 mg/mL浓度梯度下,由三种方法提取的血红铆钉菇多糖均具有还原能力,OD值均随着多糖浓度的提高而增大,其中,超声微波联合提取法获得多糖的还原力最强,超声提取法次之,传统水提法所得多糖还原力最弱。在多糖浓度为5 mg/mL条件下,三者吸光值分别为1.24、0.71和0.40,且三种提取方法对血红铆钉菇多糖还原力影响差异显著(P<0.05)。
2.3.2 血红铆钉菇多糖对·OH清除率的影响 由图3b可知,在0.5~6.0 mg/mL浓度梯度下,超声提取法及超声微波联合提取法所得多糖对·OH清除率的影响随多糖浓度的上升呈先上升后趋于平稳变化,水提法所得多糖清除率始终呈缓慢上升趋势。在选取浓度范围内,超声微波联合提取法所得多糖对·OH清除效果最好,超声提取法次之,传统水提法所得多糖对·OH清除效果最弱,IC50依次为1.62、2.37和5.43 mg/mL,且三种提取方法所得多糖对·OH清除率影响均呈显著差异(P<0.05)。
2.3.3 血红铆钉菇多糖对DPPH自由基清除率的影响 由图3c可知,在0.1~0.8 mg/mL浓度梯度下,三种方法所得多糖对DPPH清除率的影响均随多糖浓度的上升呈逐渐上升趋势,且具有较强清除能力,超声微波联合提取法所得多糖在0.7 mg/mL浓度条件下,清除率达82.26%,其余两种提取方法所得多糖在0.5 mg/mL浓度条件下,清除率也均超过50%,清除效果由强至弱依次为超声微波联合提取法、超声提取法、传统水提法,DPPH清除率IC50值分别为0.29、0.38和0.48 mg/mL,且对DPPH清除率影响呈显著差异(P<0.05)。
2.3.4 血红铆钉菇多糖对ABTS自由基清除率的影响 由图3d可知,三种方法所得多糖对ABTS清除率亦呈现随多糖浓度上升逐渐提高的规律,与DPPH相比,所得多糖对ABTS清除能力相对较弱,在3~21 mg/mL浓度梯度下,清除效果由强至弱依次为超声微波联合提取法、超声提取法、传统水提法,ABTS清除率IC50值分别为10.28、12.92和17.59 mg/mL,且不同提取方法对ABTS清除率差异显著(P<0.05)。
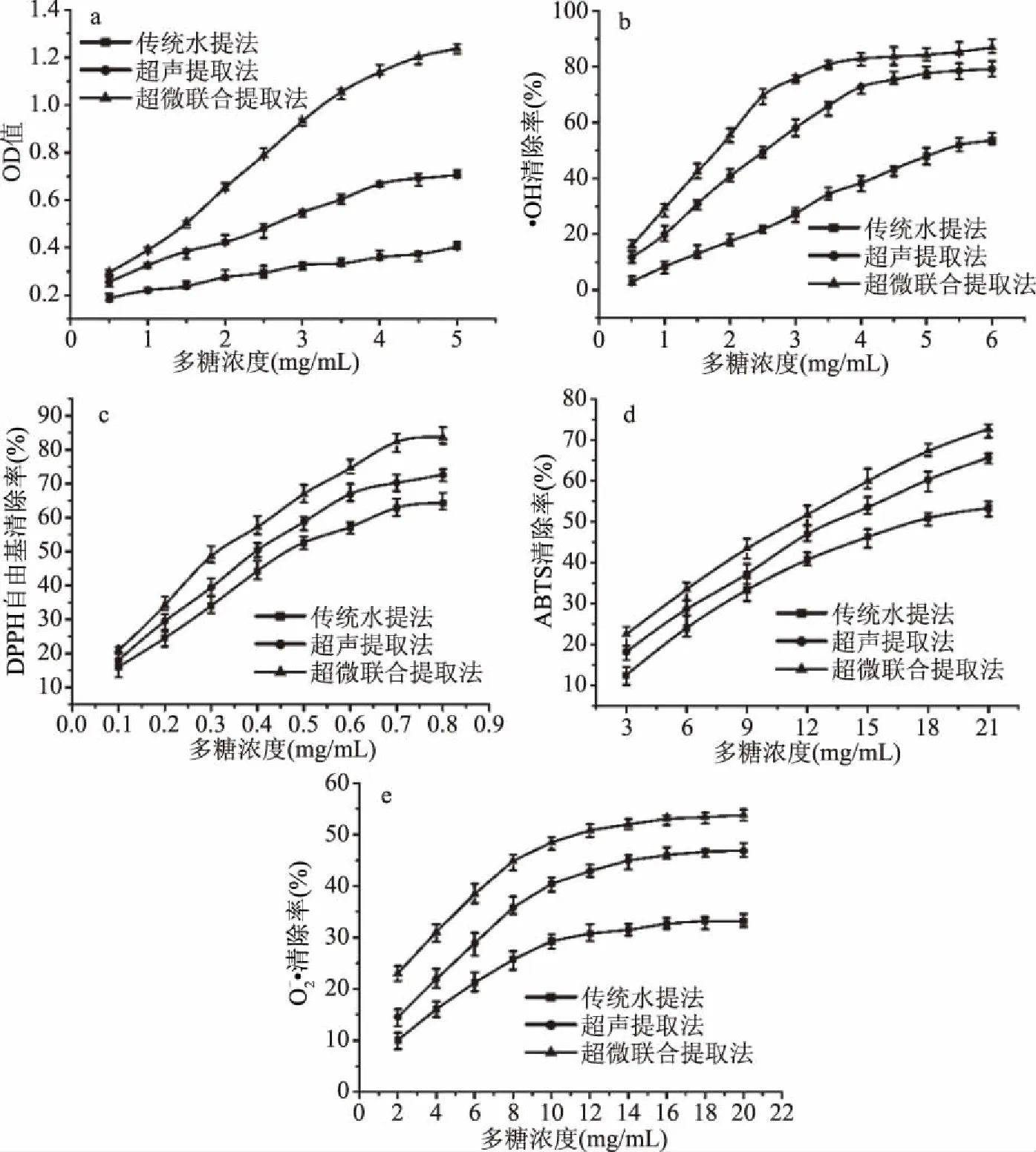
图3 不同提取方法所得血红铆钉菇多糖体外抗氧化能力Fig.3 Antioxidant activity in vitro of polysaccharides from Chroogomphus rutilus by different extraction techniques注:a. 总还原力;b. ·OH清除能力;c. DPPH自由基清除能力;d. ABTS自由基清除能力;清除能力。
2.4 不同提取方法差异比较


表4 不同提取方法提取效果比较分析Table 4 Comparative analysis of extraction effects of different extraction methods
3 结论


