葡萄耐铝毒基因MATE的克隆与表达分析
张永福,莫丽玲,徐金会,徐仕琴,裴徐梨
(昆明学院农学与生命科学学院,云南昆明 650214)
【研究意义】地壳中含量最丰富的金属元素是铝,在pH值<5.0的酸性土壤中,大量Al3+进入土壤溶液而使作物遭受铝毒害,严重抑制其生长[1]。全世界约有35%的可耕作土地为酸性(pH<5.0)土壤,而潜在的可耕种土地中约70%为酸性土壤[2]。酸性土壤占我国耕地总面积的21%,广泛分布于南方各省(区)[3]。葡萄(Vitisspp.)为世界大宗果树,因其浆果营养丰富、口感极佳而深受市场欢迎,取得较好的经济效益,因此近年来我国南方酸性土壤地区葡萄栽培面积迅速增加[4]。但葡萄耐铝毒能力弱,铝毒胁迫下,植株生长受抑,丙二醛含量、氧自由基产生速率、及SOD 和POD 活性均上升,根系活力下降[5]。可见,挖掘并克隆葡萄自身的耐铝毒基因,获得耐铝性强的种质资源势在必行。【前人研究进展】植物在长期进化中产生了多种解除铝毒的途径[6-8],其中,通过分泌苹果酸[9]、柠檬酸[10-12]和草酸[13]等有机酸与Al3+螯合来缓解铝毒是一条重要的途径,相对而言柠檬酸螯合铝的能力最强[14]。分泌柠檬酸的柠檬酸通道蛋白即次级主动运输蛋白家族中的多药及毒性复合物排出蛋白MATE(multidrug and toxic compound extrusion)[15],该蛋白与植物次生代谢产物的解毒机制密切相关[10,16]。铝毒胁迫下,MATE基因的表达能够促进柠檬酸分泌和根尖生长,表明该基因的表达量与作物的耐铝性呈正相关[17-18]。自从在高粱(Sorghum bicolor)中发现了第一个铝诱导编码的柠檬酸转运蛋白基因即SbMATE基因[17]后,相距发现了拟南芥(Arabidopsis thali⁃ana)AtMATE基因[19]、玉米(Zea mays)ZmMATE基因[16]、饭豆(Vigna unguiculata)VuMATE基因[20]、紫花苜蓿(Medicago sativa)MsMATE基因[21]及香橙(Citrus junos)CjMATE基因[22]等,这些MATE基因通过介导柠檬酸的分泌来增强其耐铝毒能力。【研究切入点】目前,虽然在上述植物中都克隆得到了MATE基因,且已知该基因编码的MATE蛋白具有降低铝毒对植物危害的功能,但在葡萄上还未见有MATE基因克隆与表达方面的研究报道。【拟解决的关键问题】本研究在前期对葡萄种质资源耐铝性评价的基础上,挑选耐铝性强的欧亚种品种‘红地球’和耐铝性弱的美洲种间杂种品种‘贝达’为试材,通过克隆分别获得了VvMATE和VrlMATE两个转录因子,并对其进行生物信息学分析和铝胁迫下的基因表达、丙二醛含量和抗氧化酶活性分析,为进一步探明葡萄耐铝毒的分子调控机制提供参考。
1 材料与方法
1.1 材料及铝胁迫处理
供试的葡萄品种‘红地球’(Vitis vinifera‘Red Globe’)和‘贝达’(V.riparia×V.labrusca‘Beta’)均来源于云南省弥勒市东风农场管理局,为1年生扦插苗。材料收集后用无土栽培的方式保存于昆明学院农学实践园,取其健康、成熟叶片用于MATE基因克隆。采集的叶片立即放入液氮中速冻后置于-80 ℃超低温冰箱中保存。
铝胁迫处理采用PVC 管道栽培的方式,管道一共两层,间距80 cm,在两层管道两端的上部,用直径3 cm 的PVC 管连接,并在一端安装抽水泵,使管中液体在上下两层管子中循环流动,调节抽水泵的抽水量使上下两层管中的液体量保持动态平衡,每天打开泵抽水时间不少于4 h。用于栽培葡萄的管道直径18 cm、长200 cm,管道的同一面上每隔40 cm 设置一个直径为10 cm 的栽培孔。铝胁迫前,分别把‘红地球’和‘贝达’1 年生苗的根系放入栽培孔中并用陶粒固定,在每一层管道内加入2/3 管的1/2 Hoagland’s营养液(pH=4.5)。缓苗后,在1/2 Hoagland’s营养液(pH=4.5)中加入5 mmol/L铝[Al2(SO4)3·18H2O,pH=4.5]进行胁迫处理。在铝胁迫的第0、7、14、21、28 天时,分别采集两份试材的健康、成熟叶片,用于MATE基因的表达分析。采集的叶片立即放入液氮中速冻后置于-80 ℃超低温冰箱中保存。
1.2 RNA的提取和cDNA的合成
称取0.1 g 叶样品,加1 mL TPIzol 提取液后研磨成匀浆,再加0.2 mL 氯仿后室温放置5 min,4 ℃、12 000 r/min离心10 min。取上清,加入异丙醇0.5 mL,摇匀后室温放置10 min,4 ℃、12 000 r/min离心10 min,倒弃上清,用75%乙醇洗涤沉淀,倒去乙醇后风干沉淀,加DEPC 水100 µL 溶解DNA。cDNA 第1 链用TaKaRa公司的PrimeScript 1stStrand cDNA Synthesis Kit试剂盒进行逆转录合成,方法参照说明书。
1.3 MATE全长cDNA的克隆
按照已报道的拟南芥AtMATE 蛋白序列,在Phytozome葡萄基因组数据库中进行BlastP搜索,获得葡萄同源基因的cDNA 及氨基酸序列。根据该cDNA 序列,用Premier 5.0 设计引物(表1)并送生物公司合成。用高保真酶PrimeSRAHS DNA Polymerase 进行基因扩增。扩增程序:98 ℃预变性2 min;98 ℃变性10 s,58 ℃复性10 s,72 ℃延伸25 s,35个循环;最后72 ℃延伸2 min。扩增结束后,产物在1.2%琼脂糖凝胶上点样进行电泳检测,切胶回收目的条带(从Axygen 公司购买回收试剂盒),与pMD19-T Vector 连接,转化大肠杆菌感受态细胞,把阳性克隆挑出送北京擎科新业生物技术有限公司测序。
1.4 MATE基因生物信息学分析
MATE基因翻译成蛋白质序列使用NCBI在线分析软件ORFfinder,预测蛋白质分子量和理论等电位使用ProtParam tool(http://web.expasy.org/protparam/);预测蛋白质二级结构使用GOR4(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html);预测蛋白质三级结构使用SWISS-MODEL(https://www.swissmodel.expasy.org/interactive);碱基酸序列分析比对用NCBI的BlastN、BlastP,氨基酸多序列比对和构建系统进化树用DNAMAN 8.0和MEGA 7.0软件。
1.5 MATE基因的表达量分析
参照TSE202[2xT5 Fast qPCR Mix(SYBR Green I),擎科]的说明书进行荧光定量PCR 分析,以GAP⁃DH基因作为内参基因,对铝胁迫不同时期的葡萄叶片MATE基因表达量进行荧光定量,引物序列见表1。以合成的cDNA 作为模板,按照2×T5 Fast qPCR Mix(SYBR Green I)试剂盒的说明书进行操作,反应体系为2×T5 Fast qPCR Mix(SYBR Green I)10µL、上下游引物各0.8µL、cDNA 1.0µL,加Nuclease-free Water至20µL。荧光定量PCR 反应程序为:预变性95 ℃1 min;循环阶段95 ℃10 s,60 ℃5 s,72 ℃10 s,40 个循环;熔解阶段95 ℃15 s,60 ℃1 min、95 ℃15 s、0.3 ℃/20 s。待反应结束后进行荧光值变化曲线和溶解曲线分析。
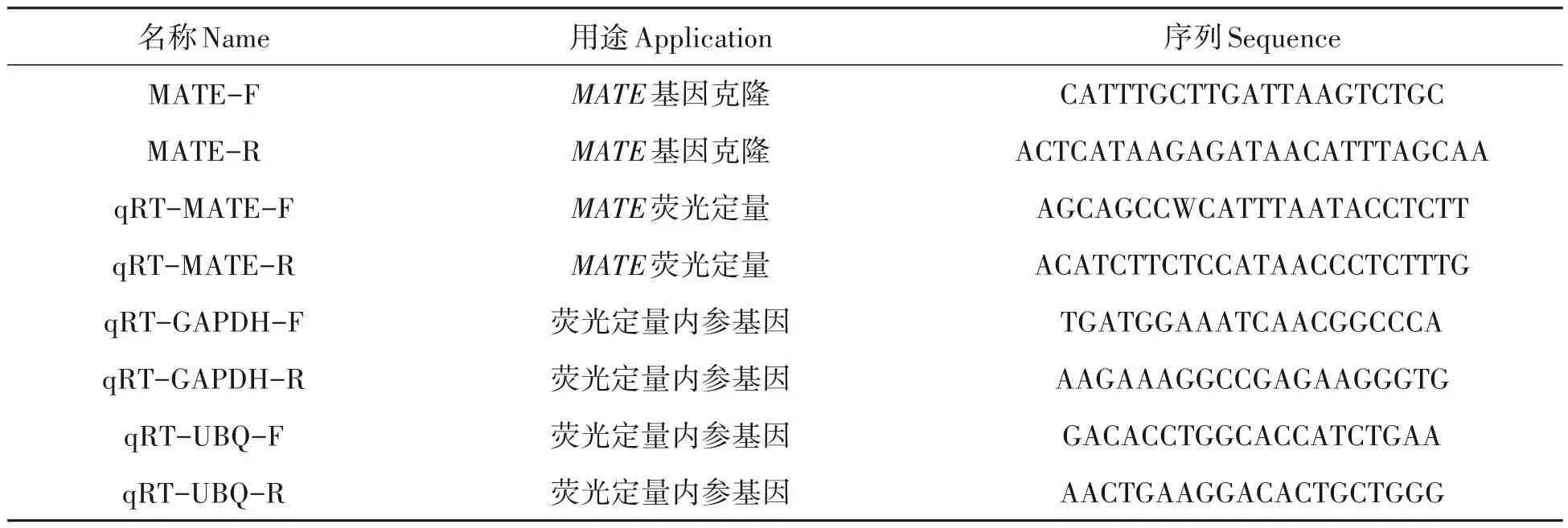
表1 研究所用引物序列Tab.1 Sequence of primers in this research
1.6 生理指标的测定
通过双组分光光度法测定丙二醛含量,通过氮蓝四唑光还原法测定超氧化物歧化酶(SOD)活性,通过愈创木酚-H2O2显色法测定过氧化物酶(POD)活性[23]。
2 结果与分析
2.1 葡萄MATE基因ORF序列的克隆
分别从‘红地球’和‘贝达’叶片中提取总RNA后,使用核酸蛋白检测仪测得浓度分别为561.2µg/mL和603.6µg/mL,A260/A280分别为1.81和1.78,说明所提取的RNA 纯度较高,可直接将其保存于-80 ℃冰箱中备用。以逆转录得到的‘红地球’和‘贝达’cDNA为模板,用特异性引物扩增出长度均为1 800 bp 左右的条带,与目标条带的大小一致(图1)。将二者的克隆结果送到北京擎科新业生物技术有限公司测序,发现二者的序列长度均为1 794 bp,序列与转录组获得的序列一致,通过DNAMAN 8.0分析得出其编码的氨基酸均为597个和1个终止密码子(图2和图3)。
2.2 MATE氨基酸序列的理化性质
用ProtParam tool 在线工具对‘红地球’和‘贝达’的MATE 多肽链氨基酸数目、分子式、等电点、相对分子量等进行预测。在‘红地球’中,MATE基因共编码597 个氨基酸,分子式为C3133H4918N838O820S26,分子质量为68.28 ku,理论等电点(pI)为10.15,含9 735 个原子;在‘贝达’中,MATE基因共编码597 个氨基酸,分子式为C3162H4905N837O848S19,分子量为68.82 ku,理论等电点(pI)为9.92,含9 771个原子。
2.3 MATE蛋白的结构预测
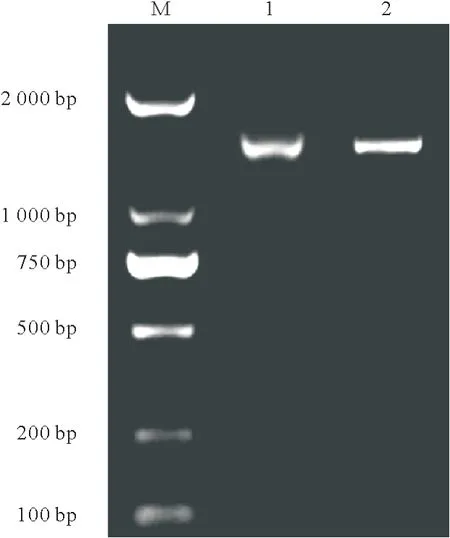
图1 葡萄MATE基因PCR产物电泳图Fig.1 The gel electrophoresis PCR product ofMATEin grape

图2 ‘红地球’的MATE基因cDNA全长序列及氨基酸序列Fig.2 MATEgene cDNA and amino sequence of‘Red Globe’
蛋白多肽链本身的折叠和盘绕方式即蛋白的二级结构。用GOR4对MATE基因编码的蛋白二级结构进行预测,结果如图4所示:在组成‘红地球’MATE蛋白的597个氨基酸中,无规则卷曲(Cc)占52.43%、α-螺旋(Hh)占26.97%、折叠延伸链(Ee)占20.60%;在组成‘贝达’MATE 蛋白的597 个氨基酸中,无规则卷曲(Cc)占49.73%、α-螺旋(Hh)占33.21%、折叠延伸链(Ee)占17.06%。两个品种二级结构中占比由高到低均有无规则卷曲、α-螺旋和折叠延伸链的规律,α-螺旋(Hh)对蛋白骨架主要起到稳定作用,而无规则卷曲(Cc)结构决定了蛋白质的功能,两个葡萄品种MATE蛋白无规则卷曲(Cc)和α-螺旋(Hh)所占比例最大,说明MATE基因对葡萄的解毒起着重要的作用。

图3 ‘贝达’MATE基因全长序列及氨基酸序列Fig.3 MATEgene cDNA and amino sequence of‘Beta’
用SWISS-MODEL 在线工具进行预测后发现,葡萄MATE 蛋白的三维结构由α-螺旋、β-折叠片、β-转角等组成。如图5 所示,‘红地球’MATE 蛋白的三级结构含有2 个α-螺旋、3 个β-折叠片、4 个β-转角;‘贝达’MATE蛋白的三级结构含有2个α-螺旋、3个β-折叠片、3个β-转角。
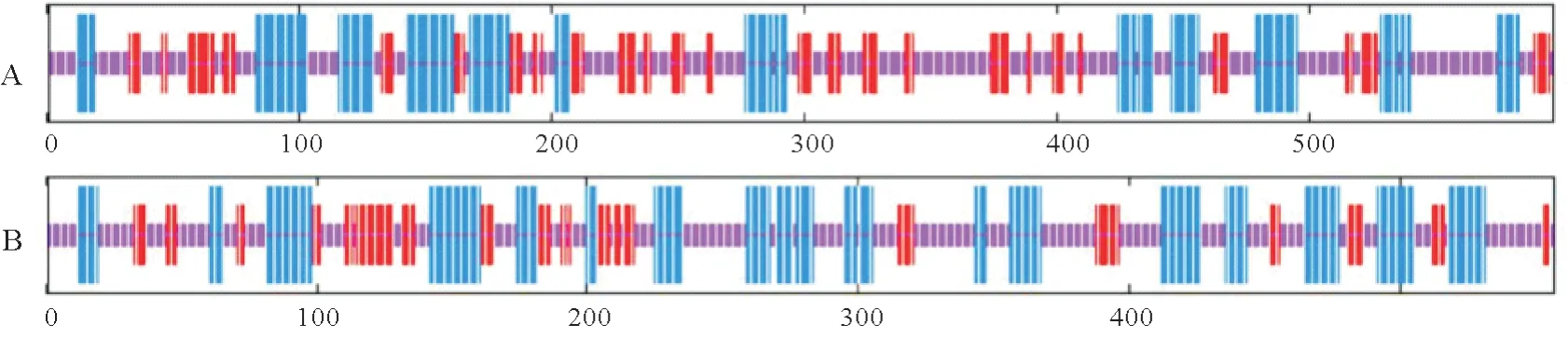
图4 MATE蛋白的二级结构预测Fig.4 Secondary structure prediction of the MATE protein
2.4 MATE系统进化关系结果
利用生物分析软件MEGA 7.0 构建了‘红地球’、‘贝达’、甘蓝(Brassica oleracea)、油菜(Brassica na⁃pus)、拟南芥、紫花苜蓿、大豆(Glycine max)、饭豆、黑麦(Secale cereale)、高粱、水稻(Oryza sativa)、大麦(Hordeum vulgare)、小麦(Triticum aestivum)、棉花(Gossypium arboretum)、蒺藜苜蓿(Medicago truncatula)、木豆(Cajanus cajan)、玉米等的MATE 同源蛋白的系统进化树。发现‘红地球’和‘贝达’的MATE 蛋白在氨基酸序列上具有高度同一性,相似度达91%。二者与大麦、小麦、高粱、水稻的同源性均在70%以上,与其他几个种的同源性在40%~60%。此外,从系统进化树上亦发现,‘红地球’与‘贝达’在同一个分支上,表明二者的MATE基因具有极近的亲缘关系;二者与高粱、水稻、大麦、小麦等的MATE蛋白氨基酸序列亲缘关系较近,与棉花、蒺藜苜蓿、木豆、玉米的MATE蛋白氨基酸序列亲缘关系较远(图6)。
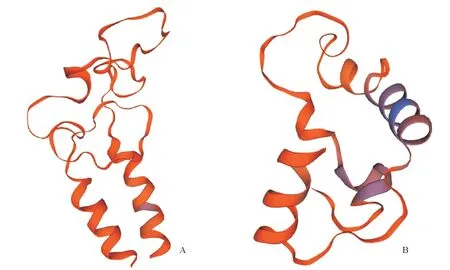
图5 MATE蛋白的三级结构模型预测Fig.5 Prediction results of the tertiary structure model of the MATE protein
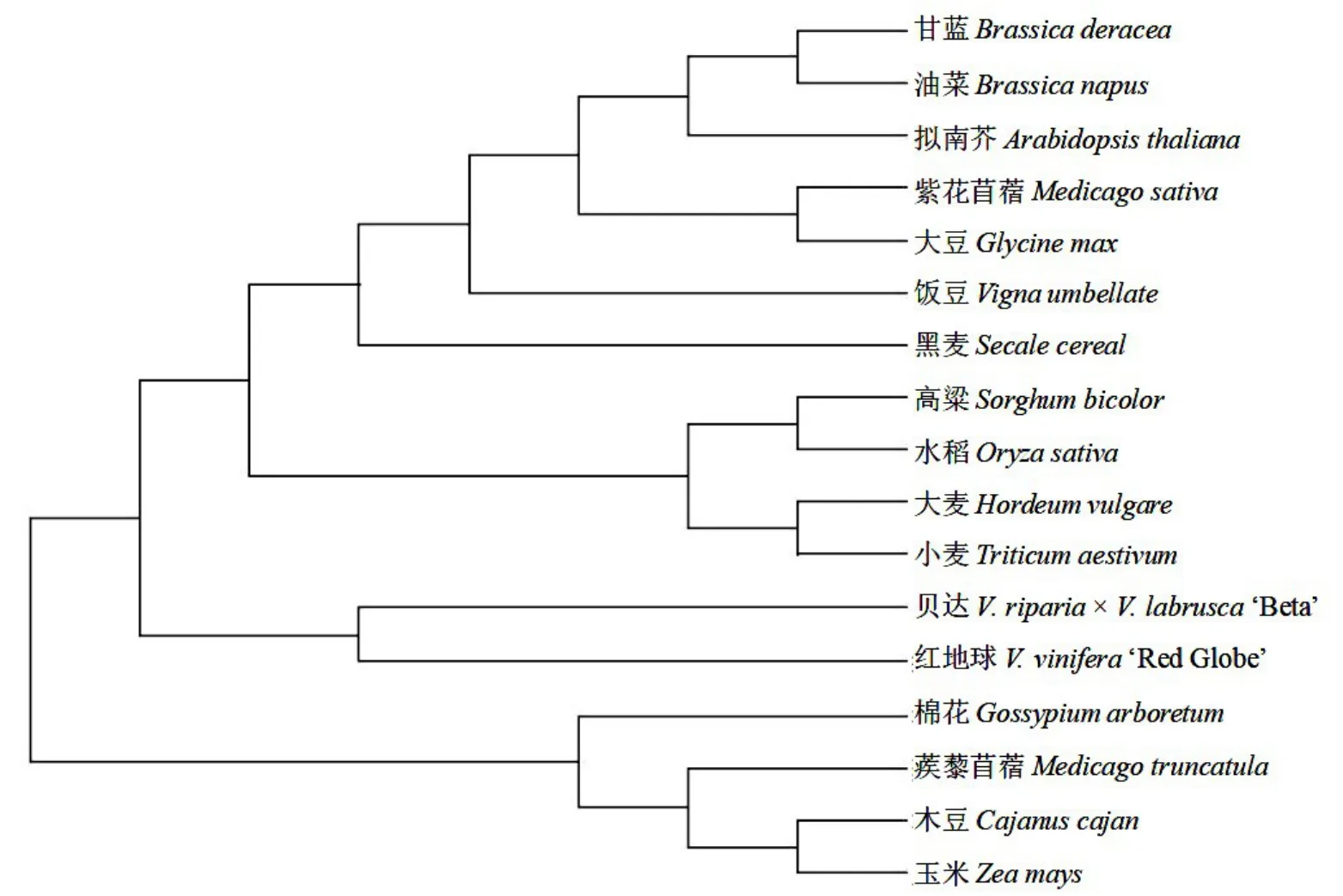
图6 葡萄MATE蛋白与其他植物MATE蛋白的系统发育树构建Fig.6 Phylogenetic tree construction results of MATE protein and other plant MATE proteins
2.5 铝胁迫期间葡萄MATE基因的相对表达量及MDA含量、抗氧化酶活性
通过qRT-PCR 分析发现,铝胁迫前,‘红地球’和‘贝达’的MATE基因相对表达量均在900 以下,但‘红地球’比‘贝达’高130.09%;‘红地球’MATE基因表达量的峰值在铝胁迫的第14 天,比铝胁迫前上升了281.08%,而到铝胁迫的第28 天则下降了15.14%,此时比‘贝达’高1868.15%;‘贝达’MATE基因表达量的峰值在铝胁迫的第7 天,比铝胁迫前上升了83.88%,而到铝胁迫的第28 天则降至比铝胁迫前低52.28%(图7)。可见,铝胁迫下耐铝性强的葡萄品种‘红地球’MATE基因表达量高,上升幅度大,且峰值出现的晚。
丙二醛是细胞膜脂过氧化的产物,其含量与膜脂受氧化破坏的程度呈正相关。图7所示,铝胁迫前,‘红地球’与‘贝达’的丙二醛含量相差不大;从铝胁迫开始至胁迫的第21天,两个品种均呈上升趋势,且‘贝达’的含量始终高于‘红地球’,到铝胁迫的第21 天时,‘贝达’达到峰值,比‘红地球’高18.45%;铝胁迫的第21 天后,‘红地球’丙二醛含量继续上升,‘贝达’则开始下降,到铝胁迫的第28 天时,‘红地球’比‘贝达’高44.31%。
SOD和POD可通过分解活性氧来防止膜脂被氧化破坏,其活性与防止膜脂被氧化破坏的能力呈正相关。从图7还可看出,铝胁迫期间,‘红地球’的SOD活性均不同程度的高于‘贝达’;从铝胁迫开始至第7天,两个品种的SOD活性均上升,且‘贝达’于铝胁迫的第7天达到峰值,此时比铝胁迫前高33.93%、比‘红地球’低18.82%;‘红地球’的峰值在铝胁迫的第14天出现,此时比铝胁迫前高61.20%、比‘贝达’高49.64%;到铝胁迫的第28天,‘红地球’比‘贝达’高97.41%。铝胁迫前,‘贝达’的POD活性比‘红地球’高140.20%,在铝胁迫的第14天达到峰值,此时比铝胁迫前高21.22%;而‘红地球’从铝胁迫开始至第28天均在上升,到第28天时共上升了226.47%,此时比‘贝达’高23.33%。可见,耐铝性强的‘红地球’在铝胁迫下丙二醛含量和抗氧化酶活性的峰值出现较晚,细胞膜受破坏的程度低,这与MATE基因的表达量较一致。
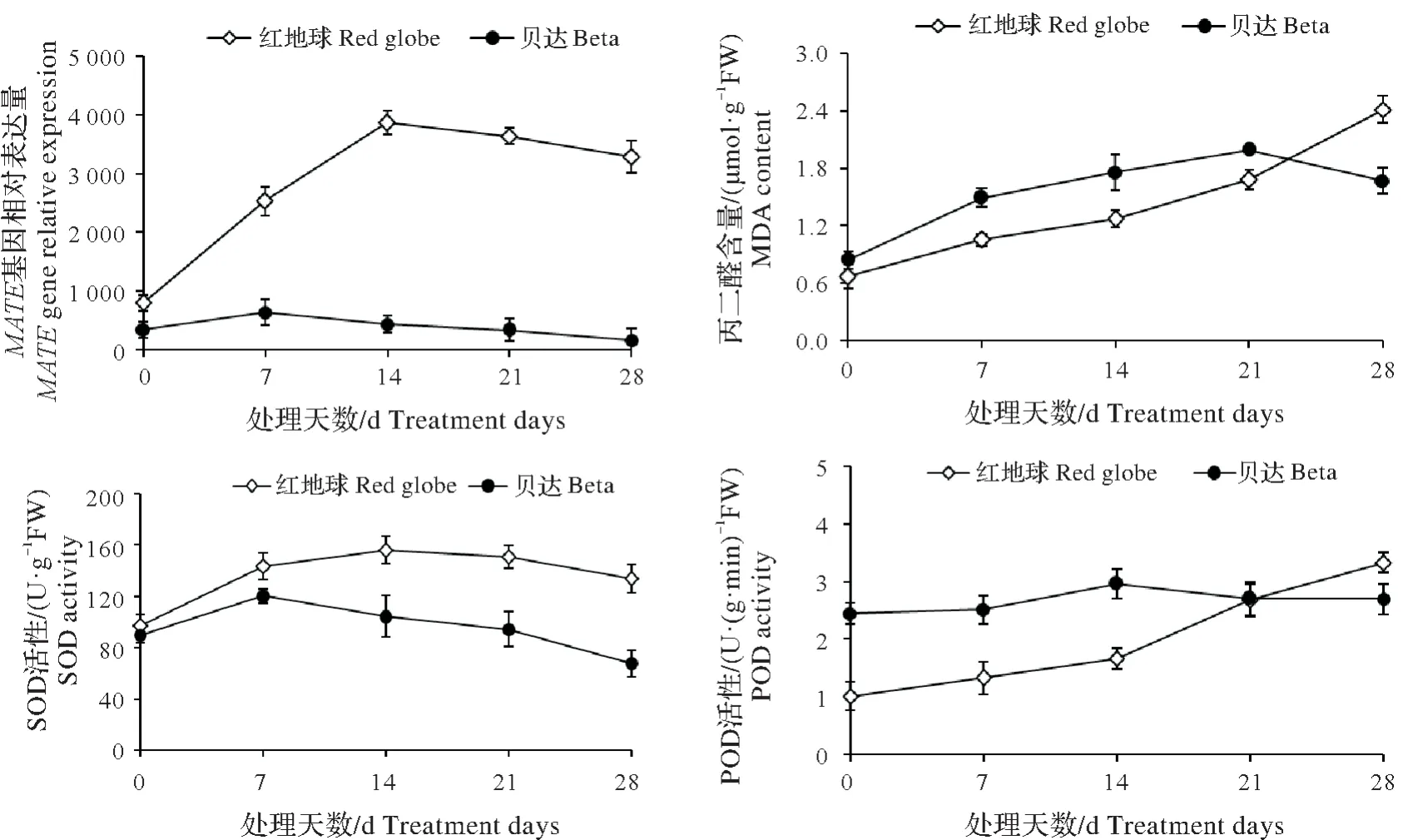
图7 铝胁迫期间MATE基因的相对表达量及膜脂过氧化指标的变化Fig.7 Relative expression ofMATEgene and changes of membrane lipid peroxidation indices during aluminum stress
3 讨论与结论
全世界的耕地约有35%为酸性土壤[2],而我国南方地区几乎全为酸性土壤[3]。这些地区起源的植物为适应环境而进化出多种耐铝机制,如分泌有机酸就是其耐铝机制之一[10-12]。植物感受到铝胁迫信号后立即激活细胞膜上的H+-ATPase酶,然后通过把大量H+泵到细胞外形成质子电化学梯度,使大量柠檬酸从柠檬酸通道蛋白中排出,从而使其耐铝性提高[24]。柠檬酸通道蛋白的合成受柠檬酸通道蛋白基因控制,第一个由铝诱导编码柠檬酸通道蛋白的基因是在高粱中发现的SbMATE基因[17],随后相距发现了拟南芥AtMATE基因[19]、小麦TaMATE1基因[25]、玉米ZmMATE基因[16]和丹波黑大豆GmMATE基因[26]。据报道[27],把耐铝性强的大麦品种的MATE基因转入耐铝性弱的大麦和小麦品种中,转基因植株的柠檬酸分泌量增多,耐铝性明显增强。这些为探究葡萄MATE基因提供了研究思路和理论依据。
在前期研究探明了‘红地球’的耐铝毒能力强于‘贝达’的基础上,本研究分别克隆出了二者的MATE基因,分别命名为VvMATE和VrlMATE基因。MATE基因在植物的耐铝性中起着重要作用,这在拟南芥[19]、高粱[17]和玉米[16]等多种作物中均有报道。张宝云[19]发现,紫花苜蓿由MsMATE基因编码的MsMATE通道蛋白定位于质膜上,铝胁迫下促进柠檬酸分泌,可推测本研究由VvMATE和VrlMATE基因编码的VvMATE 蛋白和VrlMATE 蛋白亦定位于质膜上且具有响应铝胁迫分泌柠檬酸的功能。进化分析表明,两个葡萄品种‘红地球’VvMATE 蛋白与‘贝达’VrlMATE 蛋白的亲缘关系最近,同源性达91%,二者与大麦HvMATE、小麦TaMATE、高粱SbMATE 和水稻OsMATE 的同源性均在70%以上,与甘蓝BoMATE、油菜BnMATE、紫花苜蓿MsMATE 和大豆GmMATE 等的同源性仅40%~60%不等。可见,不同植物MATE蛋白的氨基酸序列同源性相对较低,这与前人的研究结果相似[28-29],且不同物种间MATE 蛋白氨基酸具有较高的保守性。
铝胁迫可调控绝大多数植物MATE基因的表达,如铝毒胁迫下高粱SbMATE基因[17]、拟南芥AtMATE基因[19]、玉米ZmMATE基因[16]及丹波黑大豆GmMATE2基因[26]的表达量均显著增高,但亦有研究报道[30],铝胁迫下,大豆GmMATE基因的表达量并没有明显的变化。本研究中,在整个铝胁迫期间,耐铝性强的‘红地球’的MATE基因表达量远高于耐铝性弱的‘贝达’;在铝胁迫的前14 d,‘红地球’的VvMATE基因表达量均大幅度上升,但从胁迫的第14天至第28天,则略有下降趋势;而‘贝达’的VrlMATE基因表达量仅在铝胁迫前7 d 略有上升。整个铝胁迫期间,‘红地球’的丙二醛含量和POD 活性一直上升,SOD 活性则大幅度上升后又缓慢下降,说明该品种耐铝性强的原因除了VvMATE基因的高表达量使其分泌大量柠檬酸外,抗氧化酶活性增强使细胞膜受氧化破坏程度较轻也是一个重要的原因。
综上,本研究克隆了两个葡萄品种‘红地球’和‘贝达’的VvMATE和VrlMATE基因,二者的序列长度均为1 794 bp,编码597 个氨基酸;二者的分子质量分别为68.28 ku 和68.82 ku,理论等电点(pI)分别为10.15 和9.92。‘红地球’和‘贝达’的二级结构各组分占比由高到低均为无规则卷曲、α-螺旋>折叠延伸链,三级空间结构由α-螺旋、β-折叠片和β-转角等组成。系统进化树分析发现,VvMATE和VrlMATE的同源性为91%,二者与大麦HvMATE、小麦TaMATE、高粱SbMATE 和水稻OsMATE 的同源性均在70%以上。此外,铝胁迫下,两个葡萄品种的MATE基因表达量均先上升后下降,其中耐铝性强的‘红地球’MATE基因表达量与抗氧化酶的上升幅度均大于耐铝性弱的‘贝达’。

