人工合成小麦SHW-L1高硒含量KASP分子标记开发及其应用
魏广辉,李执,陈强,李阳,陈诗豪,裴英,周勇,程梦萍,唐豪,王际睿1,,魏育明1,,刘登才1,,陈黎,郑有良1,,蒲至恩
(1西南作物基因资源发掘与利用国家重点实验室,成都611130;2四川农业大学农学院,成都611130;3四川农业大学小麦研究所,成都611130;4宜宾市产品质量监督检验所,四川宜宾644000)
0 引言
【研究意义】人体需要 22种元素来维持身体健康,其中硒是构成含硒蛋白与含硒酶的重要组分,含硒复合物具有清除体内自由基、抗衰老、增强人体免疫力、拮抗重金属毒性等生物功能,近年来已成为国内外研究的热点[1-2]。中国是世界上缺硒最严重的国家之一,约有一亿多人口膳食结构中硒含量不足。与动物性食品相比,植物性膳食中的硒相对含量较低[3-4],其中,小麦作为人类的主要植物性膳食来源之一,籽粒中的硒含量与健康息息相关。在小麦中,硒主要以硒代蛋氨酸和甲基硒代半胱氨酸形式存在[5],不同形态的硒对人体的作用不同[6],而这两种形式的有机硒对人体健康的有效性远大于无机硒。故利用好小麦中的硒源是一条人体补硒的高效、低廉、简单和易行的途径,开展高硒小麦选育是克服硒元素缺乏的最经济有效方法之一。由于对硒元素检测手段颇为复杂,限制了育种单位对这一性状的选育,因此,有必要将控制小麦籽粒硒含量的基因或者标记开发成简单、易操作的PCR标记来解决这一难题。【前人研究进展】随着生物技术的发展,越来越多的分子标记用于育种[7-8],目前,在基因组层面丰度最大的为单核苷酸多态性(single nucleotide polymorphisms,SNP)[9]。并且 SNP已在很大程度上取代了已广泛测序的作物品种(如小麦)的简单序列重复序列(simple sequence repeats,SSR)用于分子标记辅助选择。竞争性等位基因特异性 PCR(kompetitive allele specific PCR,KASP)可以针对指定的 SNP和 InDel(insertions and deletions,InDels)进行高精度双等位基因分型。相比于其他的验证技术,KASP具有更高的分析稳定性和准确度、反应成本更低、通量更大,是一项优质价廉的基因分型技术[10-11]。这项技术是基于引物末端碱基的特异匹配来对SNP分型以及检测InDels[12-13]。通过全基因组关联分析(genome-wide association study,GWAS)与SNP标记联合使用,可以挖掘出大量的重要农艺性状的相关位点,开发相关的KASP标记,可以快速方便地进行材料的选择,包括在育种过程中对抗逆性、株高、穗长等性状的直接选择[14]。YU等[15]利用GWAS鉴定了小麦品系中与Ug99茎锈病抗性相关的基因座,标记特征关联鉴定了12个与抗性显著相关的SNP标记并开发了KASP标记,这些标记物可用于小麦对 Ug99茎锈病抗性的育种中的标记辅助选择。ZENG等[16]在小麦条锈病基因的发掘中,对重组自交系中利用BSA后的SNP阵列进行了单倍型分析,并开发了用于标记辅助选择的KASP标记用来进行条锈病的选择。可见在小麦中利用 SNP标记开发的KASP标记用于分子标记辅助选择是可行的。分子标记的广泛应用同时推动了硒相关基因的定位研究,孙明茂[17]、张现伟[18]研究得到的水稻硒含量相关 QTL位点将用以对杂种后代的选择改良;赵敏[19]通过筛选富硒基因型进行富硒大米及其农产品的研究与开发;陈大清等[20]通过对拟南芥耐硒突变体的基因定位,挖掘硒耐受基因与硒敏感基因;裴英[21]通过图谱构建得出小麦硒含量相关的QTL,利用高硒人工合成小麦资源SHW-L1与普通小麦品种川麦32杂交获得重组自交系群体(RILs),利用SSR标记与DArT标记技术对F10代的RILs群体进行基因型检测,构建了含有1 874个DArT标记和299个SSR标记、总长度3 985.6 cM 的遗传图谱。并结合多年多点对籽粒硒含量进行了定位,得到10个硒相关QTL位点,主要分布于3D、5A染色体。【本研究切入点】利用SNP开发出的KASP标记筛选高硒小麦资源的研究仍鲜见报道。【拟解决的关键问题】本研究利用SHW-L1×川麦32重组自交系群体已有的660K小麦SNP图谱芯片对RILs群体进行了图谱密化,把位于5A染色体上的QTL区间进一步缩小,开发稳定基因内的SNP位点为KASP标记,用于高硒小麦材料的筛选。
1 材料与方法
1.1 试验材料
供试材料总共152份,均来自四川农业大学小麦研究所,其中人工合成小麦亲本SHW-L1和川麦32及其衍生的含138个株系的RILs用于KASP标记开发。SHW-L1在温江种植条件下的硒含量为0.1048 mg·kg-1,约3倍高于川麦32的硒含量0.0401 mg·kg-1[22-23]。通过前期利用SSR标记、DArT标记研究,发现与硒含量相关的QTL来源于SHW-L1[22-23]。为了验证该标记的可靠性,选用了以人工合成小麦SHW-L1作为亲本衍生出的如蜀麦969、蜀麦580、蜀麦980、蜀麦830、蜀麦114等14个品系用于验证KASP标记。所有材料于2015、2016年分别种植于四川农业大学崇州、温江试验生产基地,栽培措施同一般大田生产。其中用于SNP分型和硒含量表型匹配的重组自交系 2015年种植于温江,表型选择标准为地方标准GB/T 22499-2008[24]0.0400 mg·kg-1,籽粒硒含量大于0.0400 mg·kg-1的材料为高硒品系,籽粒硒含量低于0.0400 mg·kg-1的贫硒品系。后续用于KASP标记的验证材料于2016年种植于崇州试验基地,硒含量划分标准根据当年籽粒硒含量平均值0.0130 mg·kg-1进行,大于 0.0130 mg·kg-1的材料为高硒。
1.2 SNP 图谱
参考杨剑[25]的方法构建重组自交系660K SNP图谱。
1.3 小麦籽粒硒含量测定方法
利用原子荧光法[26]对材料进行硒含量测定,由宜宾市产品质量监督检验所检测。
1.4 DNA 提取方法
采用改良的 CTAB法[27]方法提取幼苗新鲜叶片DNA,并且取1.5 μL DNA在0.8%琼脂糖凝胶上电泳检测纯度。
1.5 引物合成与反应体系
利用 Primer5.0软件(http://www.premierbiosoft.com/index.html),根据 SNP标记侧翼序列信息进行KASP引物的设计,并通过生工生物工程(上海)股份有限公司进行引物合成。
KASP验证条件:2条特异性正向引物3′末端碱基为SNP位点变异碱基(G或A),5′端分别加上FAM和HEX荧光序列标签序列。引物的混合比例为AL1∶AL2∶R∶ddH2O=6∶6∶15∶23,PCR反应体系为1 μL DNA、5 μL KASP Mix(LGC Genomics,Hoddeston, UK)、0.08 μL Μgcl2、2.52 μL ddH2O 和1.4 μL混合引物。利用CFX96荧光定量仪进行检测,PCR 反应程序为 94℃ 15 min;94℃ 20 s,61—55℃60 s,10个循环(touch-down,每循环降低0.6℃);94℃ 20 s,55℃ 60 s,30 个循环。
1.6 数据统计及分析
利用 CFX96荧光定量仪配套软件 BioRad CFX Manager的基因分型模块,读取各样品不同荧光信号值,并分析基因型;采用 Microsoft Excel 2010进行数据的整理,SPSS 20.0进行方差分析,根据广义遗传力计算公式估算遗传力。遗传力计算公式[28]如下:
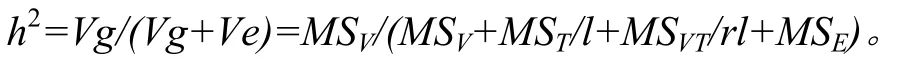
式中,Vg为品种的方差组分,Ve为残差的方差组分,MSV为品种的均方,MST为年份的均方,MSVT为品种与年份互作的均方,MSE为误差的均方,r为重复,l为年份。
2 结果
2.1 群体硒含量变异情况
通过对材料籽粒中的硒含量进行方差分析(表 1),可以看出,群体品种间籽粒硒含量的差异达到极显著水平,不同年份间群体籽粒硒含量无显著差异,根据方差估算出小麦籽粒硒含量广义遗传力为66%。
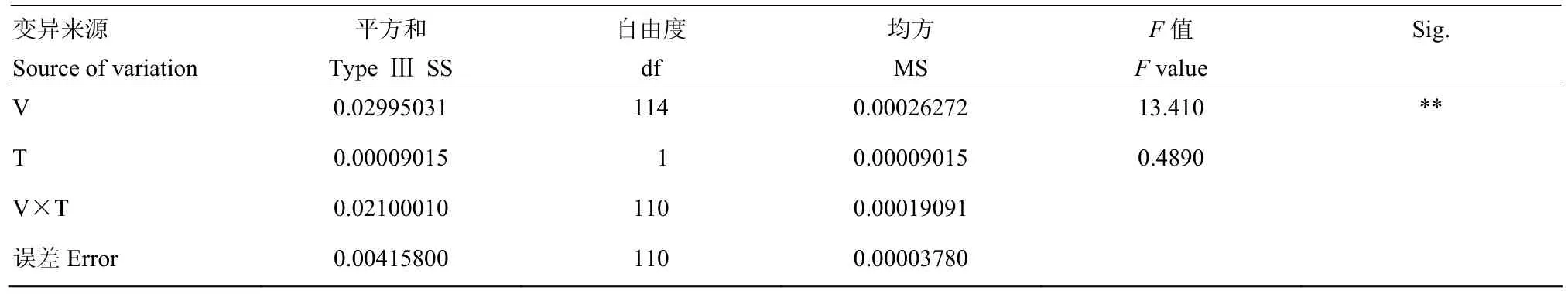
表1 群体籽粒硒含量方差分析Table 1 Variance analysis of RIL population selenium concentration
2.2 SNP 标记
通过对获得的多态性SNP标记进行偏分离筛选,去除偏分离后共获得142 430个SNP标记用于图谱构建。SNP标记和DArT标记以及SSR标记整合后的遗传图谱全长共17 889.62 cM,包含121 222个有效标记。基于前期定位结果,将控制硒含量的位点定位于3D、5A染色体上,由于3D染色体上标记密度不够,因此,本研究重点关注5A染色体上的信息。5A染色体上有7 207个标记,总长度为1 114.86 cM,密度为0.155 cM/Locus。
2.3 KASP 标记的开发
将重组自交系籽粒Se含量和整合后的5A染色体图谱进行计算,并将LOD阈值设为2,得到重组自交系在5A染色体上的QTL区域(表2)。
将得到的QTL与图谱进行对照,以获得一个更大的QTL区间,区间内的SNP作为初筛选标记。根据SNP分型结果与籽粒硒含量数据进行比对再筛选(图1),总共分为3种,A型、B型和缺失。理想中的标记应该为A型和B型分离,并以某个籽粒硒含量的材料为界限,完全分布于两侧,但完全符合的标记基本不存在,因此,要从初筛选的标记中做二次筛选,只需选出基因型聚类较好的标记即可,最终选出5个标记用于开发籽粒硒含量相关的KASP分子标记(表3)。根据5个标记设计引物(表4),其中如AX-1引物包括2条等位基因特异性正向引物AL1和AL2,一条共同的反向引物R。
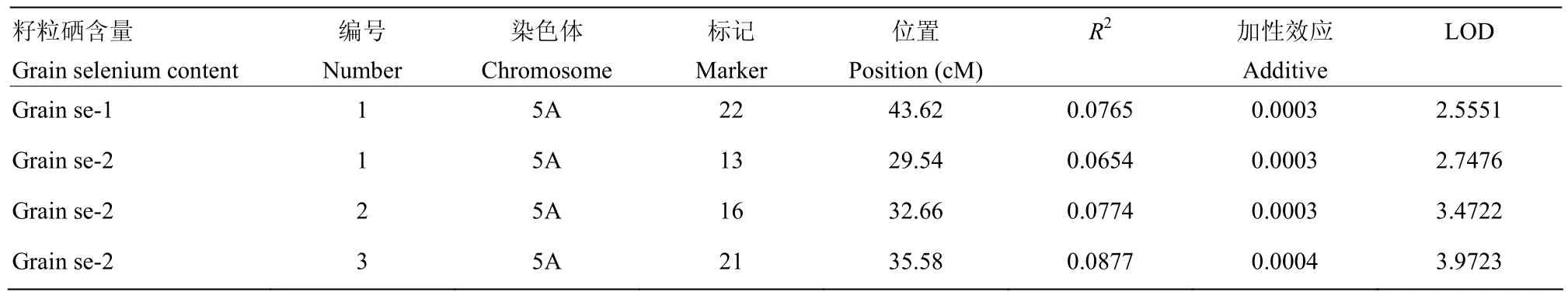
表2 筛选过LOD值后的QTL结果Table 2 QTL results after screening LOD values
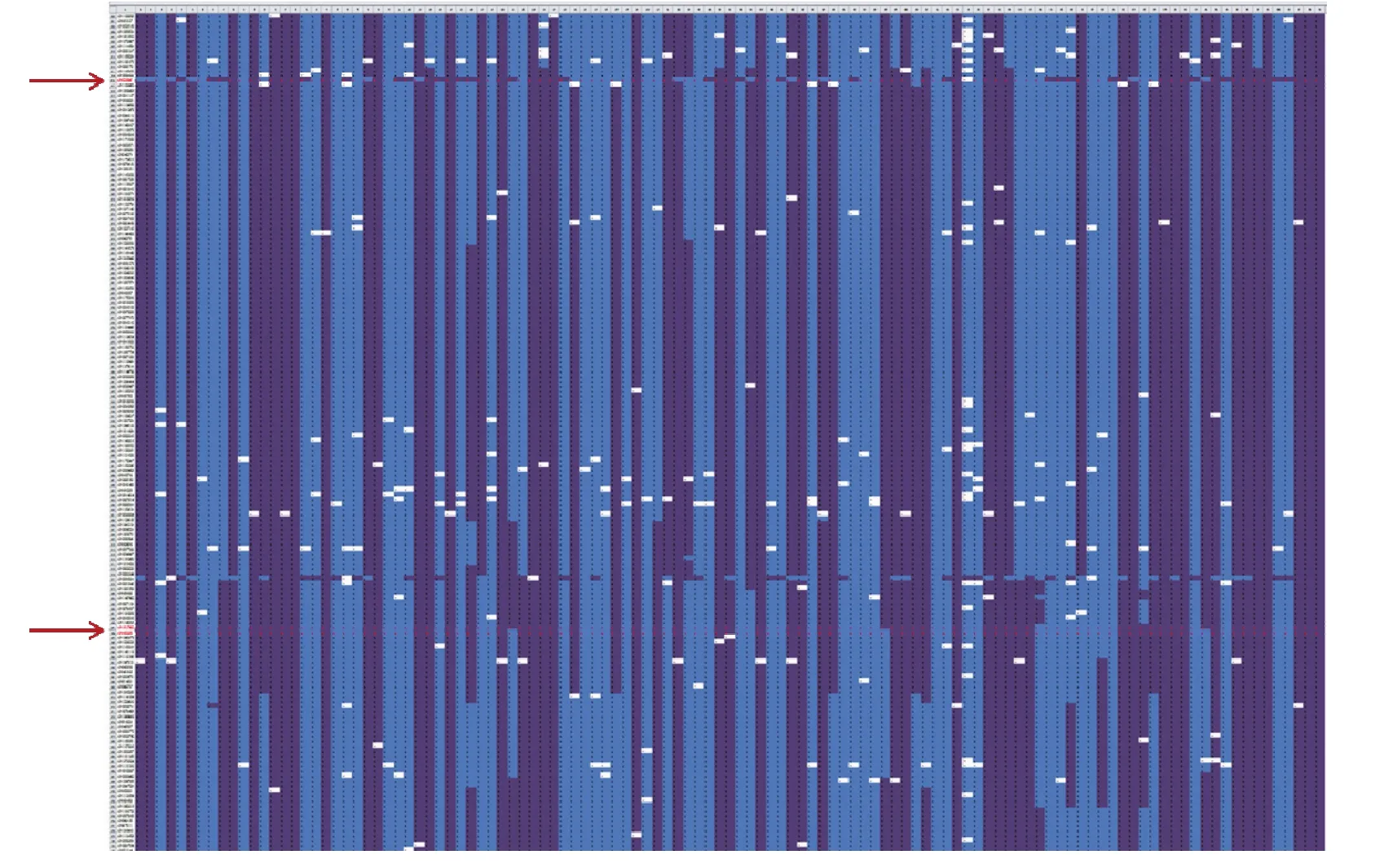
图1 SNP分型与籽粒硒含量比对结果Fig. 1 SNP comparison of genotyping and grain selenium content

表3 所用SNP标记Table 3 SNP markers used in this study

表4 KASP引物及序列Table 4 KASP primers and sequences
2.4 KASP标记的初验证
针对5个标记分别进行KASP-SNP分型测试(图2),其中2个标记能够将2种基因型样本区分开,另外3个标记无法区分亲本基因型,因此剔除。通过测试的2个标记用于后续详细的测试。
2.5 标记AX-1、AX-2的KASP-SNP分型详细结果
在 SNP荧光信号二维图(图 3)中可以看到,2种基因型之间的夹角较大,且各信号点的荧光信号值也比较高,因此分型效果较好。其中,代表亲本人工合成小麦SHW-L1都是聚合在X轴的橙色信号点,亲本川麦32都是聚合在Y轴的蓝色信号点。利用基因型对材料进行分类,将对应的样本与其已经测出的硒含量进行比对(图 4),其中 AX-1标记所对应 118个材料中鉴定为基因型低硒的为54个,平均籽粒硒含量为 0.0145 mg·kg-1,相对应的表现型中,50个材料为低硒,4个材料为高硒(>0.0300 mg·kg-1),对低硒材料的选择效率为92.6%;群体中利用AX-1标记鉴定为基因型高硒的有64个,但其中47个材料表现型为低硒,17个为高硒,平均籽粒硒含量为 0.0295 mg·kg-1,对高硒材料的选择效率为 26.6%,2种基因型的材料籽粒硒含量存在显著差异(F=4.84,P<0.05)。AX-2标记所对应118个材料中鉴定为基因型低硒的为56个,平均籽粒硒含量为0.0141 mg·kg-1,其中52个材料表现为低硒,4个材料表现为高硒,对低硒材料的选择效率为 92.9%;利用标记鉴定为基因型高硒的有62个,其中表现型中有45个为低硒,17个材料表现为高硒,平均籽粒硒含量为 0.0303 mg·kg-1,对高硒材料的选择效率为 28.4%,2种基因型的材料籽粒硒含量存在显著差异(F=5.43,P<0.05)。
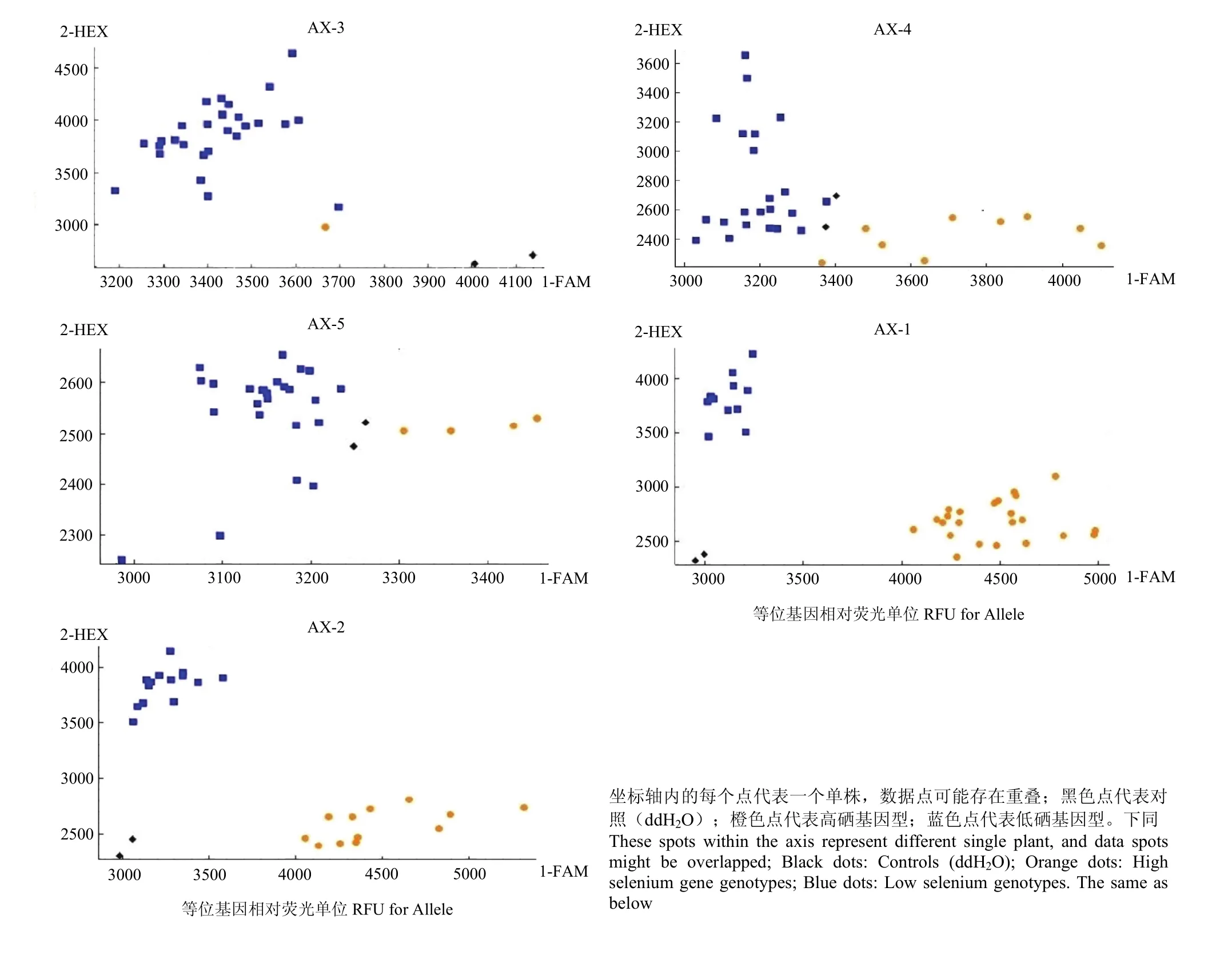
图2 分子标记对不同籽粒硒含量样本的初次KASP-SNP分型检测Fig. 2 Initial KASP-SNP typing of selenium content samples from different grains by molecular markers
按照 0.0400 mg·kg-1的标准对群体表现型进行划分,其中118个材料中仅有21份材料硒含量表现为高硒,表现型比例严重偏离1∶1,也不符合数量性状的正态分布。其中不论AX-1标记还是AX-2标记对应高硒表现型材料均为17个,即表明高硒基因型和高硒表现型的匹配度达到81%。可见,在利用标记剔除低硒基因型后的剩余高硒基因型材料中,再利用标记进行筛选时效率会更高。
2.6 KASP 标记的检验
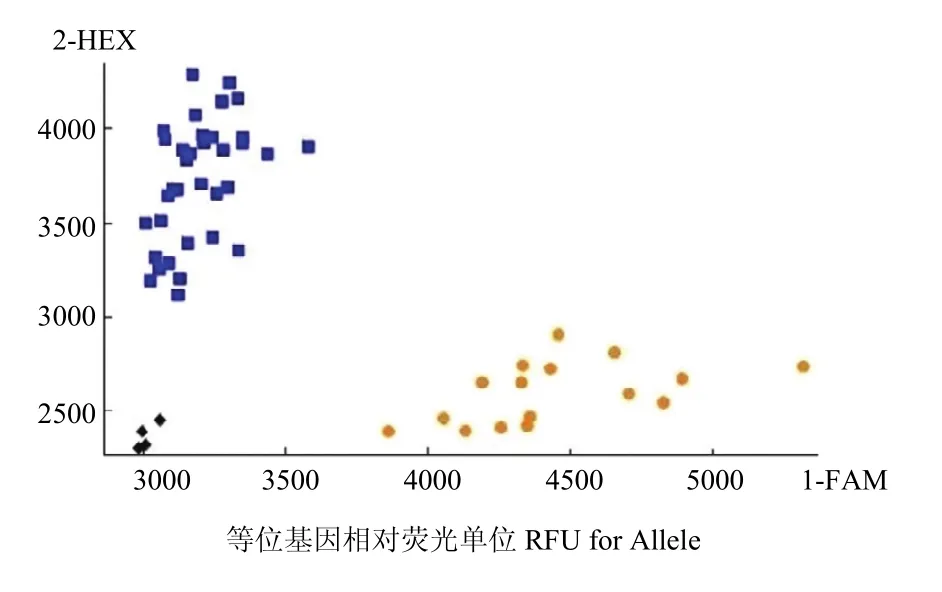
图3 分子标记对Rils138群体籽粒硒含量的KASP-SNP分型Fig. 3 KASP-SNP typing of selenium content in grain of RILs 138 population by molecular markers
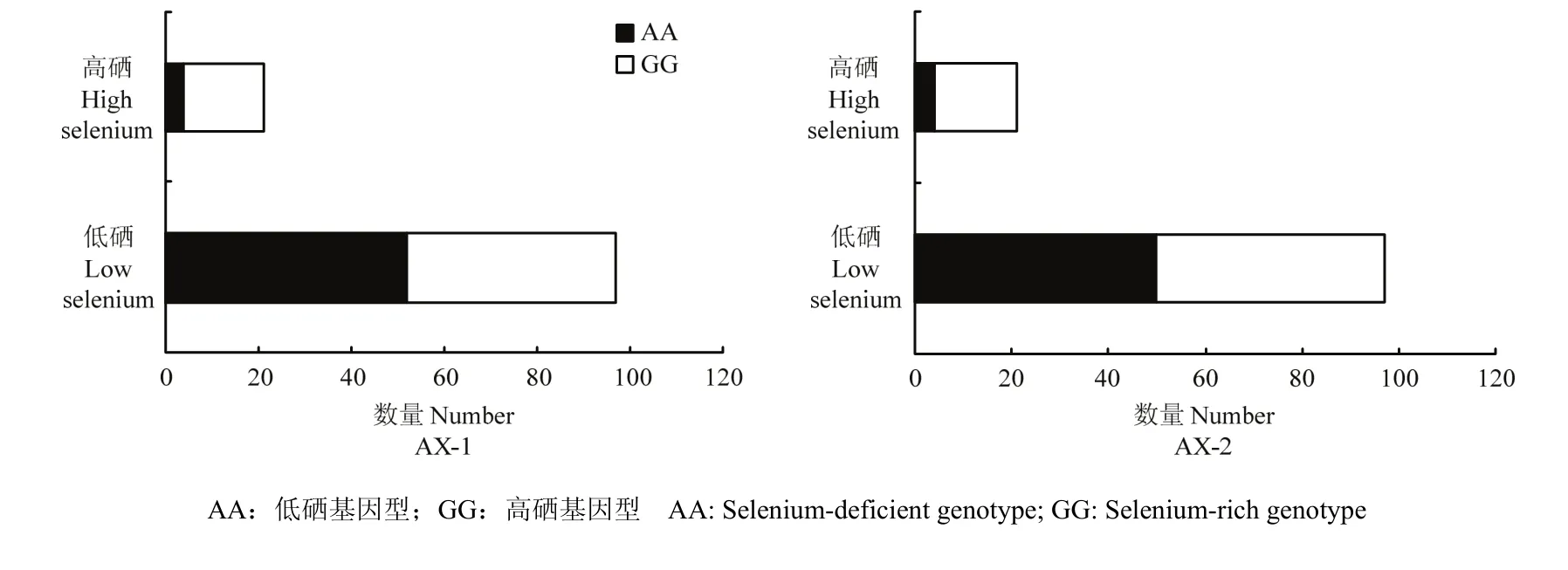
图4 KASP标记AX-1和AX-2不同等位变异在118份材料中的分布Fig. 4 Distribution of KASP-labeled AX-1 and AX-2 alleles in 118 materials
为了验证AX-1和AX-2能否用于其他相关高硒小麦的筛选,选取14个由SHW-L1衍生育成的材料测试籽粒含量,按照群体当年籽粒硒含量平均值(0.0130 mg·kg-1)进行了 KASP-SNP 分型测试,图5为部分品种(系)硒含量结果。结果表明,标记能很好地区分高硒和低硒籽粒样品,通过与籽粒硒含量表型数据对比(表 5),可以看出,各验证材料的基因型与表型结果基本一致,可以认为开发出的2个标记对于利用人工合成小麦SHW-L1衍生出的小麦品种(系)均有筛选籽粒硒含量相对高低的作用。
3 讨论
3.1 高硒KASP标记的开发利用
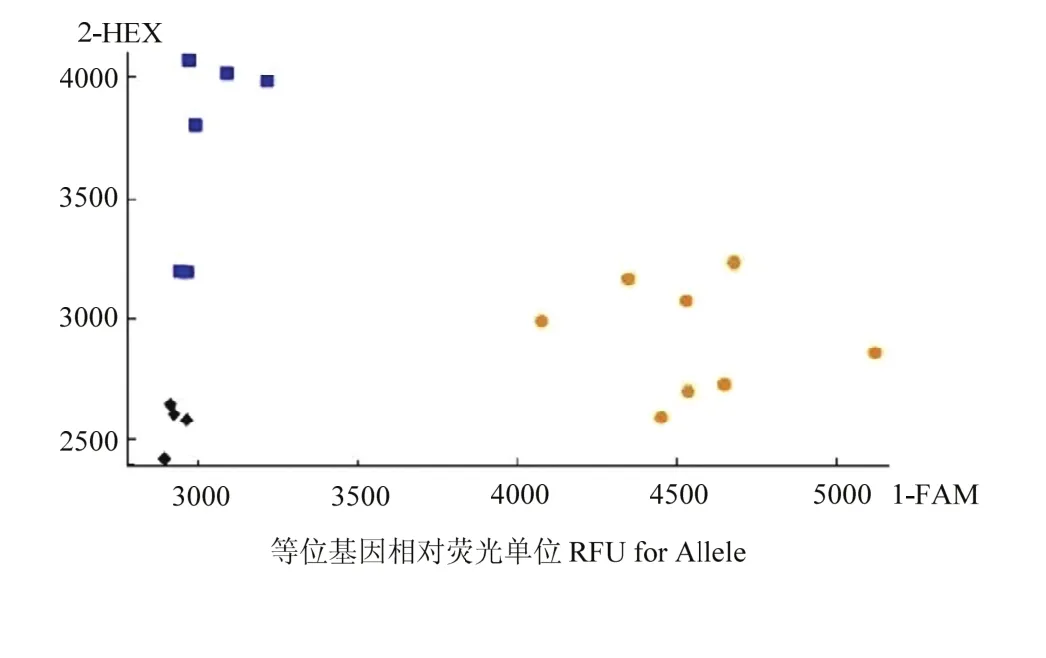
图5 分子标记对不同验证样本籽粒硒含量的定性检测Fig. 5 Qualitative detection of selenium content in grain of different validation samples by molecular markers
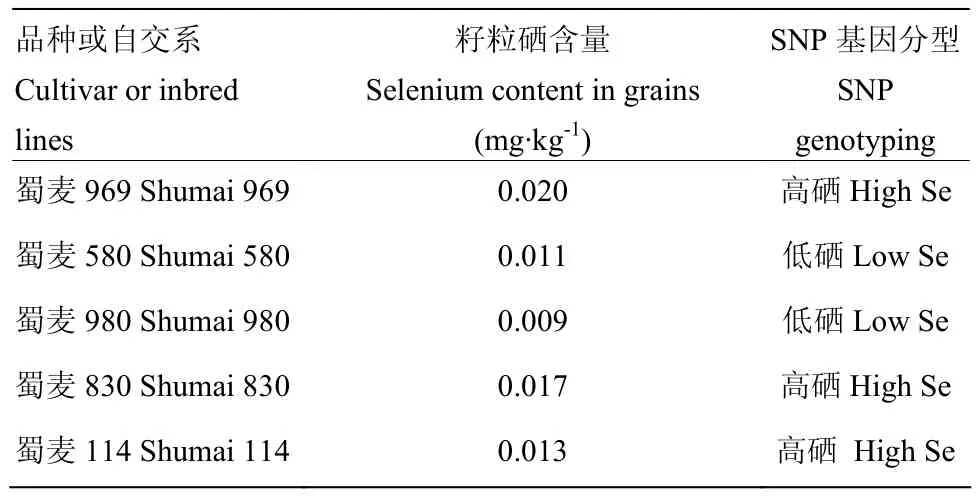
表5 部分供试材料分型检验结果与表型数据对比表Table 5 Comparison of typing test results and phenotypic data
硒是小麦籽粒中的微量元素,受基因型和环境的共同影响。在检测手段不能普及的前提下,培育高硒品种存在测试手段和技术上的瓶颈,开发简单、易操作分子标记用于快速筛选高硒小麦材料有助于高硒小麦品种的选育,本研究开发的标记将有助于育种人员开展高硒品种选育工作。
分子标记辅助育种如DArT标记、SSR标记已经广泛应用于小麦育种上,苟璐璐等[29]利用231个小麦产量与品质相关性状的一致性QTL区段中的SSR标记,通过关联分析揭示四川地方品种产量和品质相关性状的遗传特征,这些SSR标记位点和区段为通过分子标记辅助选择手段利用和发掘四川小麦地方品种产量和品质优异相关基因或区段提供了理论指导。之后基于SNP芯片开发的KASP标记也被用于对抗逆性、种质资源和种子纯度等性状的直接选育,如GmSNAP11- 5149分子标记应用于辅助抗大豆胞囊线虫品种选育和抗病种质资源鉴定[30];张利莎等[31]研究表明SNP标记能够有效鉴定混杂度低至5%的麦芽样品,且基于KASP技术的SNP标记可以满足麦芽纯度的快速定量检测需要。可见SNP标记作为第三代分子标记,随着其标记水平的提升和成本的降低,应用也越来越广泛,用于构建遗传图谱和遗传多样性分析等,但在分子标记辅助选择育种中的应用还不够普遍化,在小麦品质育种上的应用更少,尤其是针对籽粒中含量很少的微量元素。
近年来,对于硒含量相关基因的定位还多停留在对QTL位点发掘阶段,性状的复杂性和分子标记实用性使高硒小麦育种进展缓慢。由于SNP技术的发展,本研究在前期研究的基础上进一步深入,将前期定位于5A上的新QTL位点的区间进一步缩小,开发出基于SNP位点的KASP标记。本研究开发的2个KASP标记均来源于人工合成小麦SHW-L1,不仅能在人工合成小麦群体中起到鉴定籽粒硒含量相关基因型的作用,在以人工合成小麦为亲本的其他后代材料中,也能有效区分高硒和贫硒材料。SHW-L1作为亲本具有很好的配合力,衍生了一大批材料,本研究选择的14个高代品种(系)验证材料中,其中5个材料(文中列出的仅为审定或者即将审定的高代材料)能够利用本标记进行有效区分高硒材料和低硒材料,且表型和基因型一致,可见该标记也可用于SHW-L1后代的筛选,快速鉴定其后代育种材料中籽粒硒含量的高低。随着对人工合成小麦的研究越来越深入[32-34],发现人工合成小麦的后代如川麦42,蜀麦969等具有氮素利用效率高等特点,人工合成小麦是否具有其他元素高效利用的特点还需要进一步关注,同时本研究也为元素高效利用的SNP标记开发提供了参考。
值得注意的是,在本研究中,无论是AX-1还是AX-2标记,将供试材料可以按照基因型分为2类,即高硒和低硒材料,AX-1标记高硒基因型与贫硒基因型比例为50∶54=1∶1.18,AX-2标记基因型比例为52∶56=1∶1.10,等位基因符合1∶1的分离比例。但按照表现型来划分,高硒材料∶低硒材料=21∶97,低硒材料的数目远远多于高硒材料数目,表型严重偏离了基因型,即通过KASP标记无法直接筛选出所有的贫硒材料,或者只筛选出高硒材料,需要根据标记不同等位变异在群体中的分布来考虑筛选方法以提高筛选效率。因此可通过反向操作,直接筛选去掉贫硒基因型材料,即可以筛选一半表现型为贫硒的材料,这样只会筛选掉极少部分高硒材料,以此来提升一倍的选择效率。对于剩下的高硒基因型,由于其对高硒材料选择效率不高,应当采取传统育种方法,结合表型筛选。但同时需要明确的是,具有高硒含量的表现型材料中,有81%的材料具有高硒的基因型,也表明了试验所得标记的可靠性。
高硒基因型的材料表现为低硒的表现型,即基因分型结果和表现型不匹配的现象在本研究中比较常见,可能有以下几种原因:一是植物籽粒从土壤中获取营养元素有3个步骤,吸收、转运以及物质在各个器官的再分配。但由于土壤中硒浓度太低(土壤含硒量为 0.2600 μg·g-1),造成了材料吸收效率较低,进而引起籽粒硒积累量较低,但不排除这些具备高硒基因型的材料拥有高效吸收或者转运的潜力,在土壤硒充足时,具备高硒基因型的材料的籽粒硒积累量可能会更高。由于各个高硒基因型材料间也存在吸收转运能力的差异,因此高硒基因型中仍然会有高积累和低积累的材料存在;二是小麦籽粒硒含量是由多基因控制的数量性状,位于5A的位点差异并不能完全覆盖材料间硒含量的差异。本文推测这是基因型和表现型之间存在偏差的主要原因。
3.2 KASP标记的其他用途
现有研究表明,植物中硒元素不仅对植物生长有利,还能降低镉等重金属的吸收,因此开发高硒的KASP标记不仅在于小麦籽粒硒含量的提高,还可以起到“一因多效”的作用,即用于小麦低积累镉和汞品种和品系的筛选。现有研究表明单施Se可对Cd[35]、Hg[36]等重金属起到钝化作用,减少水稻对重金属的积累,能有效降低水稻吸收Cd,阻控Cd向地上部以及籽实中的转运。小麦中硒对镉的抑制主要原因是硒能促进茎和根的生长,降低茎中镉的浓度[37],从而降低小麦籽粒中的镉含量。另外在水稻中已有通过QTL聚合筛选高硒低镉材料的报道[38-39],这也为小麦富硒低镉材料的选育提供了思路和成功范例,希望本研究开发的高硒KASP标记能成为小麦富硒低镉品种选育的开端,为解决中国现存的部分土壤问题中镉含量较高现实情况前提下提供小麦安全生产的新思路。
4 结论
开发的KASP标记AX-1和AX-2能够区分来源于人工合成小麦群体以及人工合成小麦衍生品种或自交系籽粒硒含量基因型,并有效鉴定其籽粒硒含量的相对高低,可用于高硒小麦材料的筛选。

