离子极化对化合物性质的影响*
王福海,覃 松
(内江师范学院化学化学化工学院,四川 内江 641112)
在元素部分的教学中,同类型化合物或同族元素组成同类型化合物的物理性质的差异经常是学生讨论的焦点。物质的化学键类型,物质的颜色等的差异是教学中的难点,本文结合以前的教学经验,并参考大量文献书籍对此类化合物性质差异的成因进行分析讨论。
物质的性质主要取决于分子的性质,而组成分子的原子之间靠化学键结合。离子键、共价键、金属键是三种典型的化学键。离子键的本质是静电作用力,共价键和金属键的本质是原子轨道或者电子云的重叠。实验研究表明,离子键和共价键其实是共存的,离子键中有共价键成分,共价键中有离子键成分。例如最典型的离子化合物氟化铯(CsF)中,静电作用力导致的能量下降,只占总能量下降值的92%。而氟离子电子云与铯离子电子云之间的重叠导致的体系能量下降占总能量下降值的8%。所以,氟化铯的化学键中离子性为92%,共价性为8%[1]。再如氢分子的共价键中,共价性为95%,离子性为5%[2]。化学键中离子性和供价性的大小取决化学键中成键元素电负性差值的大小,差值越大,电子云的重叠越小,离子性越大,反之共价性越大。从共价键到离子键,电子云重叠的成分减少,静电作用的成分增多。从离子键到共价键,静电作用的成分减少,电子云重叠的成分增多。离子键和供价键之间存在一个过渡,这个过渡导致了物质之间很多性质的变化。而离子极化正是离子键向共价键过渡的主要原因。
1 离子极化
1.1 离子的极化作用和变形性
阴阳离子相互靠近时,由于自身的电场作用,一种离子使另一种异号电荷离子的原子核和核外电子发生位移,使正负电荷中心不重合,从而产生偶极,这个变化的过程叫离子的极化。一种离子使异号离子极化而变形的作用叫极化作用。被异号离子极化而发生电子云变形的性能叫变形性。离子极化作用有赖于离子的电场强度,电场强度越大,极化能力越强。离子的变形性有赖于离子的体积,体积越大,越有利于变形。
1.2 离子极化作用和变形性强弱的规律
离子极化作用有赖于离子的电场强度,离子的变形性有赖于离子的体积。阴、阳离子的极化作用和变形性存在以下规律:
1.2.1 阳离子
(1)离子形式电荷越大,半径越小,极化作用越强。
(2)阳离子有效正电荷对应了阳离子的有效核电荷,而阳离子的有效核电荷与阳离子的价电子构型有关。因此,不同价电子构型的阳离子极化作用的强弱依次为:
18或18+2电子构型的离子>9-17电子构型的离子>8电子构型的离子
(3)对于相同电子层结构的离子而言,离子半径越小,极化作用越强,半径越大,变形性越大。
(4)18、18+2和9-17电子层的离子,有较大的变形性。这在于d电子云结构弥散,相对易于变形。
1.2.2 阴离子
(1)电子层结构相同的阴离子负电荷越大,变形性越大;半径越大,变形性越大。
(2)一些复杂的无机阴离子,如酸根,极化作用、变形性都不显著。且复杂阴离子中心离子(即成酸元素)氧化数越高,变形性越小。
常见阴离子变形性顺序:
1.3 离子极化对化学键的影响
离子极化使得离子电子云发生变形,进而部分重叠,这就使得离子键中有了共价键的成分。极化作用越显著,电子云重叠程度越大,共价键的成分越大。当共价键成分超过离子键成分时,离子键就过渡到了共价键,例如:AgF(离子型)、AgCl(过渡型)、AgBr(过渡型)、AgI(共价型)。
就卤化银而言,Ag+离子是18电子构型,具有很强的极化能力,同时也有很强的变形性,卤素离子具有变形性,所以银离子和卤素离子之间有极化作用。并且,随着X-离子变形性的递变,Ag+离子与X-离子之间的极化作用也会发生相应的递变。
X-离子的体积递变:
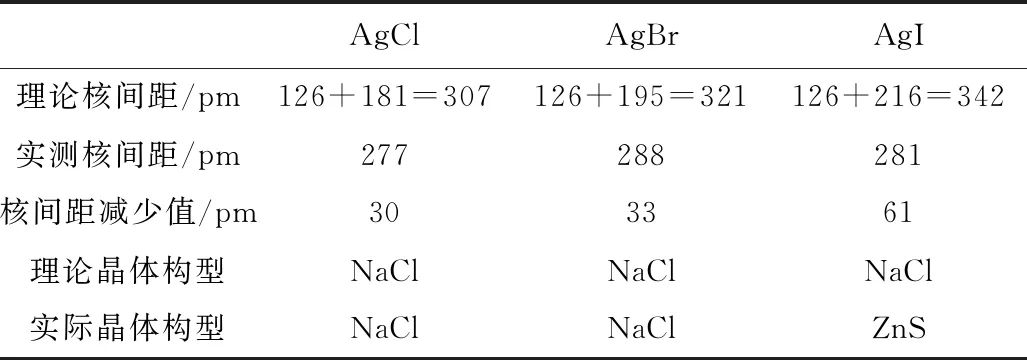
F- X-离子变形性递变: F- Ag+离子与X-离子之间的极化作用递变: AgF Ag+离子与X-离子化学键中共价键成分的递变: AgF 离子极化导致离子型化合物向共价化合物过渡,必然带来一些物理性质的改变。 1.4.1 离子极化使化合物的溶解度降低 水分子是极性分子,因此,水是极性溶剂。根据相似相溶原理,极性溶质在水中溶解度更大。离子型化合物的极性显著大于共价型化合物,因此,离子型化合物在水中溶解度更大。离子极化使导致离子型化合物向成共价化合物过渡,键的极性减弱,必然导致溶解度降低。例如下列化合物溶解度递变顺序: AgF>AgCl>AgBr>AgI CuF>CuCl>CuBr>CuI ZnS>CdS>HgS As2S3>Sb2S3>Bi2S3 1.4.2 离子极化导致物质的颜色加深 极化使阴、阳离子的原子轨道发生重叠,导致阴离子原子轨道上的电子吸收可见光向阳离子的原子轨道发生跃迁。极化越显著,原子轨道发生重叠程度越大,阴阳离子原子轨道能量差越小,电子跃迁吸收可见光能量越小,化合物颜色越深。这种由于极化作用导致的显色被称为电荷迁移,阴离子的电子吸收可见光迁移到阳离子的空轨道上去。如下列化合物颜色递变: AgF(白)、AgCl(白)、AgBr(浅黄)、AgI(黄) CuF2(白)、CuCl2(浅绿)、CuBr2(深棕) ZnS(白)、CdS(白)、HgS(黑) As2S3(黄)、Sb2S3(橙红)、Bi2S3(棕黑) TiO2(白)、V2O5(橙)、CrO3(暗红)、Mn2O7(绿紫)[3] 1.4.3 离子极化导致晶体晶格的变化 离子键的主要特征是没有方向性、没有饱和性,共价键的特征是有饱和性和方向性。离子极化使核间距减小,意味着阴阳离子半径的减下,使离子键向共价键过渡,导致化学键特征发生变化,从而影响了物质的晶体结构,如表1所示[4]。 表1 卤化银的性质 1.4.4 离子极化对化物的熔沸点的影响 由于离子型化合物对应的离子晶体质点间作用力离子键显著的强于共价型化合物对应的分子晶体质点间作用力分子间力,因此,极化导致离子键向共价键过渡,会导致离子晶体向分子晶体转变,由此引起物理性质的变化,导致熔沸点的降低。 如氯化亚铜和氯化钠的熔点,如果从晶格能考虑,两者阴离子相同,阳离子电荷相同,离子半径相似(Na+离子半径为95 pm,Cu+离子半径为96 pm),应该有相近的熔点,但实际上,氯化亚铜熔点是699 K,氯化钠熔点是1074 K。显然,从晶格能的角度不能解释。而从离子极化作用能够很好解释这种差异,Cu+离子为18电子构型的的离子,极化能力和变形性都很强,氯化亚铜存在显著的离子极化作用,导致氯化亚铜成为共价化合物,熔点显著降低。而Na+离子为8电子构型的离子,极化能力弱,氯化钠的离子极化作用程度很小,由极化导致的熔点降低很小[5]。 1.4.5 离子极化对含氧酸酸盐热解的影响 含氧酸盐的热稳定性受其酸根离子的中心原子的极化作用和金属离子的极化作用的影响。中心原子的极化能力越强,酸根离子越稳定。金属离子的极化能力越强,电荷越高、半径越小,有效正电荷越强,越容易夺取酸根离子的O原子,热稳定性越差,热分解温度越低。由于金属离子电子构型影响金属离子有效正电荷,因此,金属离子电子构型与热稳定性的关系是,8电子构型含氧酸盐热稳定性>(9~17)电子构型含氧酸盐热稳定性>18和(18+2)电子构型含氧酸盐热稳定性。例如含氧酸盐热稳定性: BeCO3 碱金属>碱土金属>d区、ds区、p区[6] 离子极化在解释离子型化合物物理性质上有许多应用,除了s区元素(碱金属和碱土金属)的离子型化合物物理性质主要由晶格能决定之外,p区、d区和ds区元素的离子型化合物的物理性质都与离子极化有关。但是离子极化的应用也有明显的不足,离子的极化能力和变形性没有明确的标度,应用时有例外,因此,离子极化一般只针对同系列化合物的性质作出定性的解释。1.4 离子极化对化合物性质的影响
2 结 语

