HR-MRI对颅内未破裂动脉瘤的风险评估价值分析
南阳市中心医院神经内科
(河南 南阳 473000)
张雪芳 邢英瀛 程 曼 潘 燕 张小林
颅内动脉瘤(IA)是指发生于颅内动脉管壁上的异常膨出,发生率可高达10%[1],若其破裂,可造成蛛网膜下腔出血,使得多数患者残疾或死亡,给患者家庭及社会带来严重负担。根据IA是否破裂可将其分为颅内破裂动脉瘤和颅内未破裂动脉瘤(UIA),其中UIA总体破裂可能性不足2%,若盲目采取预防性手术,易增加患者死亡和残疾风险[2-3]。因此,需对UIA破裂风险进行准确评估,提高其诊疗效果。随着高场强MRI扫描技术的不断提升,高分辨磁共振(HR-MRI)在心脑血管疾病中的应用也越来越广泛。本次研究探讨HR-MRI对UIA发生破裂的风险评估价值,以期为临床诊疗提供依据。
1 资料与方法
1.1 一般资料选择2017年1月至2018年12月我院收治的58例IA患者为研究对象,收集其临床资料,所有患者诊断均符合2010版《中国脑血管病防治指南》中诊断标准,且经DSA检查确诊为IA。58例患者中男35例,女23例,年龄31~78岁,平均(55.37±12.49)岁。DSA检查显示,58例患者共65个动脉瘤,根据动脉瘤是否破裂分为破裂IA组(n=6)和UIA组(n=59),以及根据HR-MRI管壁成像情况分为瘤壁强化组(n=26)和瘤壁未强化组(n=39)。
1.2 方法HR-MRI检查:仪器为美国GE 3.0T超导磁共振扫描仪,8通道头部线圈,患者取仰卧位,先以时间飞跃法(T O F)定位扫描,扫描参数:TR/TE29ms/3.4~9.6ms,层厚1.2mm,FOV24mm×12.6mm,矩阵384×192。多序列横断位、矢状位扫描动脉瘤部位,自旋回波序列T2WI:TR/TE2884ms/51ms,层厚/层间距1.5 m m/0.3 m m,FOV100mm×100mm,矩阵320×256,NEX=6;反转恢复序列STIR:TR/TE 3700ms/51ms,层厚/层间距1.5 m m/0.3 m m,FOV100mm×100mm,矩阵288×192,NEX=4;自旋回波序列T1WI:TR/TE581ms/20ms,层厚/层间距1.5 m m/0.3 m m,FOV100mm×100mm,矩阵320×256,NEX=4。静脉注射对比剂Gd-DTPA进行增强自旋回波序列T1WI+C扫描,扫描参数与T1WI相同。
1.3 图像分析及指标观察图像采集结束后,由GE ADW 4.4后处理工作站Function6.3.1e软件对图像进行处理,所有图像均由2名工作经验丰富的影像科医师独立阅片,观察动脉瘤分布位置、瘤体长度、是否为宽颈动脉瘤、有无子囊、体颈比(AR)、瘤体体率(SR)等。
1.4 统计学方法将数据录入SPSS20.0软件分析,计数资料为n(%),组间比较进行χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 破裂IA组与UIA组强化率比较破裂IA组动脉瘤强化率显著高于UIA组(P<0.05),见表1。
2.2 破裂IA组与UIA组形态学特征比较破裂IA组各形态学特征与UIA组差异均无统计学意义(P>0.05),见表2。
2.3 瘤壁强化组和瘤壁未强化组病变特征比较瘤壁强化组动脉瘤分布位置、瘤体长度、宽颈动脉瘤、AR与瘤壁未强化组差异均无统计学意义(P>0.05),子囊、SR与瘤壁未强化组差异有统计学意义(P<0.05),见表3。

表1 破裂IA组与UIA组强化率比较

表2 破裂IA组与UIA组形态学特征比较
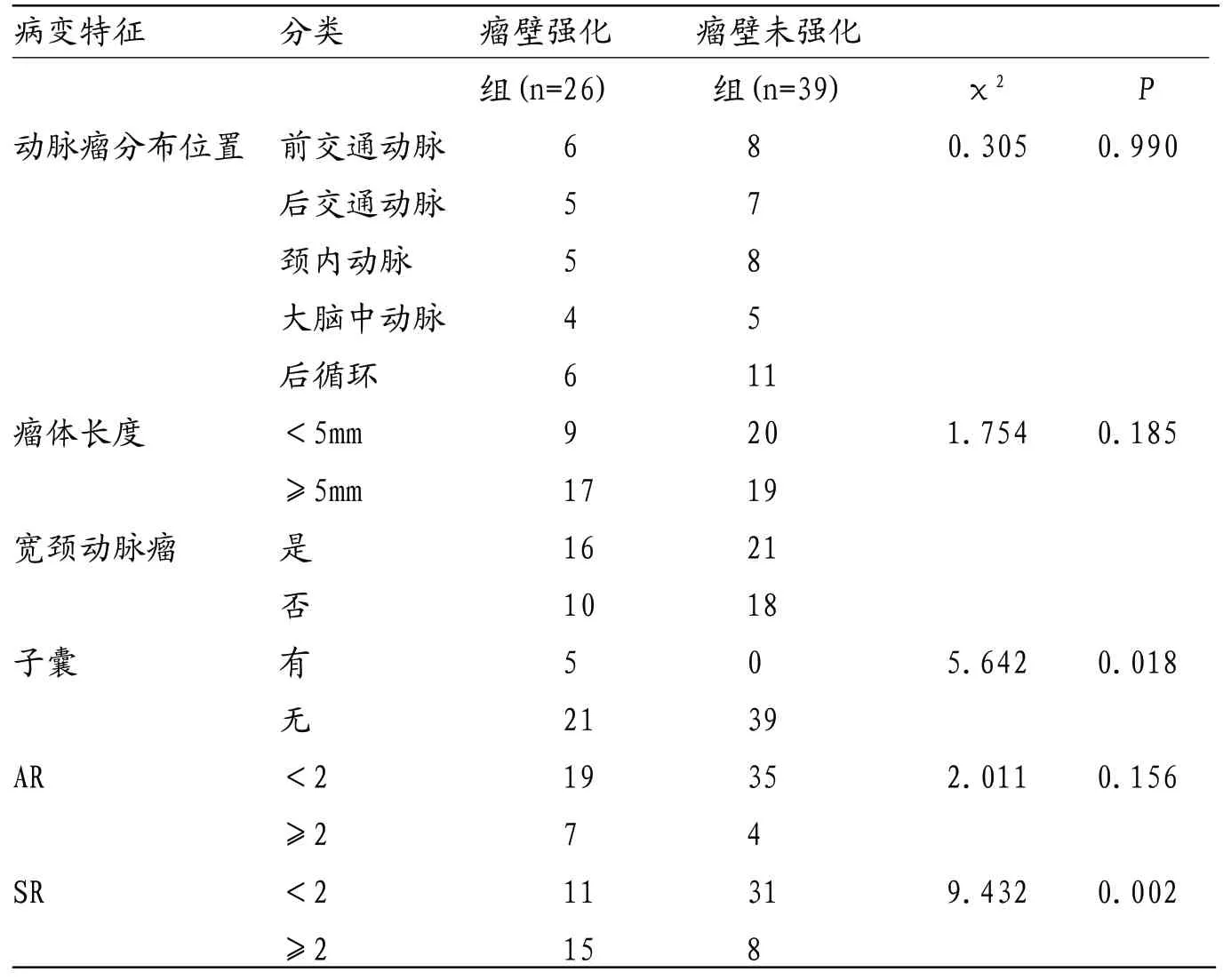
表3 瘤壁强化组和瘤壁未强化组形态学特征比较
3 讨 论
IA是致残率和死亡率最高的脑血管病之一,调查显示,对于IA破裂患者,残疾率和死亡率约为60%~80%[4]。但在全体IA患者中,动脉瘤破裂比率极小,大部分UIA患者无需进行手术。研究显示,对危险性不高的UIA患者进行手术,手术产生的风险对比动脉瘤自然破裂的风险显著较高,且盲目手术会浪费医疗资源[5-6]。因此,对高危UIA患者予以筛查,再给予有效治疗,是防治动脉瘤破裂的重要基础,可减少动脉瘤破裂出血发生,降低患者死亡率和残疾率。如何评估UIA发生破裂的危险性,是患者治疗方案决策的关键点。当前对于其风险预测主要依据UIA流行病学调查,内容包括UIA大小、家族遗传等,但受到纳入病例的选择偏倚影响,结果多存在争议。有研究指出,对于缺血性脑卒中UIA患者,前循环<7mm的UIA发生破裂的比率在0.5%以下[7]。但我国临床实践中发生破裂的小型和微型UIA比例并不低,甚至高于中大型动脉瘤,且不同个体差异较大,故而种族和个体差异限制了流行病学对UIA破裂危险评估的准确性。
研究表明,血流动力学对血管壁的影响、血管壁本身结构强度是决定UIA是否发生破裂的重要原因,前者是诱发UIA破裂的关键,而后者对UIA具有保护作用[8-9]。国外学者对IA瘤壁形态进行研究,发现薄壁及去细胞化IA破裂可能性为100%[10]。这是因为动脉瘤壁病理改变会引起血管渗透性改变,加之血流动力学对血管壁的作用力增强,当其超过一定水平时,动脉瘤发生破裂出血。HR-MRI扫描快速准确,无电离辐射损害,可通过TOF“亮血”及“黑血”技术对病变血管进行定位,能减少流动造成的伪影,准确显示管壁、管腔及血液情况,在脑血管动脉粥样硬化狭窄鉴别诊断、斑块成分检测等方面均有较高应用价值[11-12],但其在IA中的应用并不多见。作为当前唯一可在体行颅内血管管壁成像的影像学方法,本次研究分析HRMRI管壁成像检测动脉瘤瘤壁强化和UIA破裂风险关系,结果显示,破裂IA组动脉瘤强化率显著高于UIA组(P<0.05)。而管壁强化机制可能与炎症有关,资料显示,炎症反应在IA发生及生长中具有重要作用,是IA形成的重要病理基础,研究显示,炎症反应较强的动脉瘤壁强化明显,瘤体破裂风险更高[13]。分析可能影响强化的因素,显示瘤壁强化组动脉瘤分布位置、瘤体长度、宽颈动脉瘤、AR与瘤壁未强化组差异均无统计学意义(P>0.05),子囊、SR与瘤壁未强化组差异有统计学意义(P<0.05),与相关研究[14]结果一致。分析原因,子囊形成会使管壁切应力下降,而管壁切应力下降后无法有效阻止子囊生长,导致子囊越来越大,SR也越来越高,最终造成动脉瘤破裂。
综上,HR-MRI成像结果显示UIA破裂风险与瘤壁强化有关,子囊和SR是影响瘤壁强化的主要因素。

