激活JNK后对神经胶质瘤抑瘤效果的探究
姜瑞芬,谭拥军,黄明敏
(湖南大学生物学院,长沙 410082)
c-jun氨基末端激酶(c-jun N-terminal kinase,JNK)是一种Ser/Thr蛋白激酶,属于丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族。JNK激酶家族包括3种蛋白质(JNK1、JNK2和JNK3),JNK蛋白行使功能必须要处于激活的磷酸化状态[6]。当细胞受到药物、细胞因子或其他外界应激的刺激后,JNK蛋白会被磷酸化。激活后的JNK磷酸化特定底物上的丝氨酸和苏氨酸残基,引起细胞功能发生改变,包括对细胞增殖、凋亡、炎症等的影响[7]。而JNK的核底物中大部分为转录因子,JNK可以直接结合到下游转录因子的启动子区域改变其转录活性,或直接磷酸化修饰该因子,引起其下游基因的表达变化[8]。JNK是调节许多生理过程的主要蛋白激酶,包括炎症反应、形态发生、细胞增殖、分化、存活和凋亡等方面[9]。另外,JNK的持续活化与癌症的发生发展有关。已有文献表明,JNK在肝癌、皮肤癌、乳腺癌中发挥重要作用[10-12],因此可以作为治疗某些疾病的靶点。
茴香霉素(anisomycin,ANS)是JNK的经典激动剂,可诱导多种细胞内JNK的磷酸化,使其转化为活性状态[13-14]。本文通过使用JNK激动剂的方式,对神经胶质瘤U251细胞中的磷酸化JNK(phospho-JNK,P-JNK)进行有效的调节,探究JNK激活后对神经胶质瘤的发生发展是否起到关键作用。
1 材料与方法
1.1 主要材料与仪器
神经胶质瘤细胞U251来源于中南大学湘雅附属医院神经退行性疾病实验室;Dulbecco改良Eagle培养基(Dulbecco’s modified eagle medium,DMEM)以及胎牛血清(fetal bovine serum,FBS)购买自美国GIBCO公司;ANS购买自中国碧云天公司;P-JNK抗体购自美国CST公司,JNK和β-actin抗体购买于英国abcam公司,Rabbit和mouse二抗购买于中国碧云天公司;反转录PCR(reverse transcription-polymerase chain reaction,RT-PCR)引物由长沙擎科公司合成;RNA提取试剂盒购自美国OMEGA公司,逆转录试剂盒来自美国Thermo Fisher公司。
CO2细胞培养箱购买于美国Thermo公司;倒置荧光显微镜购买自日本Nikon公司;凝胶成像分析系统购自上海天能公司;实时荧光定量PCR仪购自美国Applied Biosystems 公司;微孔板检测仪(酶标仪)购自上海美谷分子仪器有限公司;流式细胞仪购自于美国Beckman公司。
1.2 方法
1.2.1 细胞培养
人源神经胶质瘤细胞U251为贴壁生长的细胞,培养于含有10% FBS的DMEM培养基中,在37℃、5% CO2浓度培养条件的培养箱中培养,当细胞密度达到80%以上时,按照1:3的比例进行传代,或者加茴香霉素进行药物处理。
建立健全国有施工企业的财务管理制度,是加强企业财务管理工作的重要前提,也是能够保障财务管理有效进行的保障。只有建立了严格的规章制度,才能使企业的财务管理有章可循,进而推动企业的可持续发展。规章制度的建立一定要对企业的整体负责,具有全面性,让企业所有的财会工作都变得有据可依。不仅要制定规章制度,制度还需要强有力的执行力,要对员工进行培训,使其深入了解每一项制度,提高其遵守制度的自觉性,并且依靠员工之间的竞争心理,使其在日常工作中做到相互监督,管理人员也要遵章守法,提高自控力,让自己的一言一行都能对其他人起到良好的榜样作用。共同促进公司又好又快发展。
1.2.2 在线网站筛选有JNK表达差异性的肿瘤模型
UALCAN(http://ualcan.path.uab.edu/index.html)是一个有效的癌症数据在线分析和挖掘的网站,主要是基于TCGA数据库中的相关癌症数据进行分析。我们进入TCGA analysis界面,输入要搜索的基因MAPK8(JNK1),分别与下面TCGA dataset中不同的肿瘤类型进行相关性和生存分析的筛选,找到最合适的肿瘤模型。
1.2.3 CCK-8检测
将U251细胞接种于96孔板中,每个孔接种量约4 000个细胞。细胞培养12.0 h并完全贴壁后,在试验组中加不同质量浓度的茴香霉素,对照组中加相应等体积的二甲基亚砜(dimethyl sulfoxide,DMSO)作为对照,设置5组平行。48.0 h后将原培养基吸掉,每孔加入含10% CCK-8的新鲜培养基100μL,37℃培养箱中孵育1.0 h,在酶标仪中进行测值,计算细胞存活率。
1.2.4 细胞计数
将U251细胞接种于24孔板中,确保每个孔细胞数相同且密度小于10%。待细胞完全贴壁后,试验组分别加入质量浓度为1.0μg/mL和3.0μg/mL的茴香霉素,对照组加入同等体积的DMSO作为对照,每组设置3组平行。分别在0、24.0、48.0、72.0 h时对每个孔进行台盼蓝染色并对活细胞进行细胞计数,从而观察加药后茴香霉素对细胞增殖的影响。
1.2.5 细胞周期检测
将U251细胞接种于2个6 cm培养皿中,确保密度相同且待完全贴壁后,其中一皿用1.0μg/mL茴香霉素处理8.0 h作为试验组,另一皿加相同体积的DMSO处理相同的时间作为对照组。将药物处理后的2皿细胞消化下来制成单细胞悬液,进行碘化丙啶(propidium iodide,PI)染色,室温避光孵育30 min;将染色完成的细胞吸打混匀,用筛网过滤到流式管内,再在流式细胞仪中进行上机检测,得到的数据用flowjo软件进行分析,从而得到细胞各周期变化的结果。
1.2.6 划痕试验
将细胞以50%以上密度接种于12孔板,每孔接种细胞数相等,培养12.0 h待细胞完全贴壁且铺满整个孔底后,将培养基吸掉并将12孔板倒置过来,在每个孔底平行的划3条线。然后将12孔板正放,用无菌的200μL枪头沿着孔底的横线划痕。用磷酸缓冲盐溶液(phosphate buffer saline,PBS)将细胞冲洗2遍后加入新鲜培养基,试验组同时加入1.0μg/mL的茴香霉素于37℃培养箱中进行培养。在加药0 h和24.0 h后拍照,比较对照组和试验组的伤口愈合能力。
1.2.7 蛋白质印迹法(Western blot)
未经任何处理的U251细胞为对照组,1.0μg/mL茴香霉素分别处理0、4.0、8.0、12.0 h的U251细胞为试验组。把对照组和试验组的细胞消化下来提取总蛋白,将处理好的样品以每孔80μg的上样量进行胶浓度为12%的聚丙烯酰胺凝胶电泳(SDS polyacrylamide gel electrophoresis,SDS-PAGE),再湿转到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上;将其置于室温下5%的脱脂奶粉封闭2.0 h左右,在稀释好的一抗中进行4℃孵育过夜;用含吐温的Tris盐缓冲液(tris buffered saline tween,TBST)洗膜6次,每次5 min;再在对应的二抗中室温孵育2.0 h,TBST洗膜6次,每次5 min;最后将洗好的膜放在凝胶成像仪上,滴加显色液后进行显影曝光并拍照。
1.2.8 RT-PCR
未经任何处理的U251细胞为对照组,1.0μg/mL茴香霉素分别处理0、4.0、8.0、12.0 h的U251细胞为试验组。将对照组和试验组的细胞加入Trizol后,用RNA提取试剂盒按照其说明书上的步骤进行RNA的提取,再用逆转录试剂盒将得到的RNA逆转录成cDNA。设计相关基因的反转录引物,10μL体系加样,进行RT-PCR,以GAPDH基因的循环数作为内参。RT-PCR仪程序设置为三步法扩增程序(95℃5 min ;95℃ 15 s、55℃ 30 s、72℃ 30 s,40 个循环 ;95℃ 15 s、60℃ 60 s、95℃ 15 s,1 个循环)。相关基因的引物设计见表1。

表1 相关基因的qRT-PCR引物Tab.1 The qRT-PCR primers of related genes
1.2.9 转录组测序分析
将U251细胞接种于2个6 cm培养皿中,确保密度相同且待完全贴壁后,其中一皿用1μg/mL茴香霉素处理8.0 h后作为试验组,另一皿加相同体积的DMSO处理相同的时间为对照组。在2个培养皿中加入1.5 mL Trizol直接裂解细胞,吹打均匀至无粘稠后加入经去RNA酶处理的EP(eppendorf)管中,冻于-80℃冰箱。将样品寄送至上海美吉生物公司,进行RNA的抽提以及转录组测序(RNA sequencing,RNA-seq)的分析。
2 结果与分析
2.1 在线网站分析JNK与神经胶质瘤的发生发展之间具有很强的相关性
UALCAN是一个基于TCGA数据库中的相关癌症数据进行分析的在线网站。我们对JNK和不同肿瘤模型进行了相关性和生存分析比对,发现JNK1(MAPK8)基因与神经胶质瘤中的胶质母细胞瘤(glioblastoma multiforme,GBM)之间的相关性最高(图1a),并且JNK1与神经胶质瘤的预后有关(图1b)。因此,我们选择了神经胶质瘤细胞U251作为试验开展的细胞模型。

图1 在线网站分析JNK与神经胶质瘤之间的相关性Fig.1 Analysis of the correlation between JNK and gliomas via an online website
2.2 JNK被激活的最适条件探究
将U251细胞传代至6 cm培养皿中,保证每皿细胞密度相同。待细胞完全贴壁后,在4皿细胞中分别加入不同质量浓度(0.5、1.0、1.5、2.0μg/mL)的茴香霉素作为试验组,另一皿空白细胞中加入DMSO作为对照组。培养箱放置1 h后,收集蛋白,做Western blot检测,试验结果表明茴香霉素质量浓度为1.0μg/mL时激活JNK效果最好,具体结果如图2a所示。同样的方法传代细胞,DMSO处理的为对照组,1μg/mL的茴香霉素分别处理不同时间(0.5、1.0、1.5 h)的细胞为试验组。将蛋白收集,做Western blot检测,发现茴香霉素处理细胞的时间为1.0 h时JNK的激活效果最好,结果如图2b所示。因此可以得出结论,质量浓度为1μg/mL、处理时间为1.0 h的茴香霉素激活U251细胞中JNK的效果最好。

图2 Western blot试验探究激活JNK的最适条件Fig.2 Western blot experiments explore optimal conditions for activating JNK
2.3 激活JNK后能够抑制U251的细胞增殖
取一皿密度较高的U251细胞,用1.0μg/mL的茴香霉素进行处理,分别在0 h(图3a1)、24.0 h(图3a2)、48.0 h(图3a3)、72.0 h(图3a4)时于显微镜下进行细胞形态学观察并拍照。发现随着茴香霉素处理时间的增加,原本呈长梭形的U251细胞逐渐皱缩变圆,且细胞间的连接增多,如图3a所示。将U251细胞铺96孔板后用不同质量浓度的茴香霉素处理,进行CCK-8检测,发现在一定的范围内,随着茴香霉素质量浓度的增加,U251细胞的活力逐渐减弱,如图3b所示。将U251细胞铺24孔板,分别用1.0μg/mL、3.0μg/mL的茴香霉素处理细胞不同时间进行细胞计数检测,发现随着处理时间的增加,细胞增殖数逐渐降低,且3.0μg/mL处理的细胞比1.0μg/mL处理的细胞增殖数更低,如图3c所示。1.0μg/mL茴香霉素分别处理1.0、8.0、12.0、24.0 h的U251细胞,分别提取RNA后逆转录成cDNA,进行qRT-PCR,发现随着处理时间的增加,与增殖相关的增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、Polo 样激酶1(Polo-like kinase 1,PLK1)基因的mRNA表达量逐渐降低,如图3d所示,且差异均具有统计学意义(P<0.05)。同时,Western blot检测发现PCNA、PLK1基因的蛋白表达量也逐渐降低,结果如图3e所示。以上结果均说明了茴香霉素通过激活JNK有效抑制了U251细胞的细胞增殖。
2.4 激活JNK后能够抑制U251细胞的迁移能力
将U251细胞铺12孔板,待细胞密度达到100%时,进行划痕试验来分析细胞的运动能力。用DMSO处理的为对照组(图4a1、4a2),用同体积1.0μg/mL茴香霉素处理的孔为试验组(图4a3、4a4),分别在0 h(图4a1、4a3)、24.0 h(图4a2、4a4)时观察划痕宽度的变化并拍照。试验发现24.0 h后对照组细胞划痕被分裂增殖的细胞愈合,宽度明显变窄,而试验组细胞划痕宽度未出现任何变化(图4a)。上述试验结果表明,细胞内源JNK活性被激活后,U251细胞的迁移能力受到了显著抑制。为了进一步揭示细胞迁移能力的变化,采用qRT-PCR分析了E-钙黏蛋白(E-cadherin,E-cad)的表达水平。E-cad是人黏附因子,其表达水平与细胞的迁移能力呈负相关[15]。试验结果显示,当JNK被激活后,E-cad基因的表达量随之上升(图4b),且差异均具有统计学意义(P<0.05)。Western blot检测,E-cad蛋白的表达量也呈现相同的趋势(图4c)。上述试验说明在U251细胞中依靠药物活化的JNK,抑制了U251细胞的迁移能力。
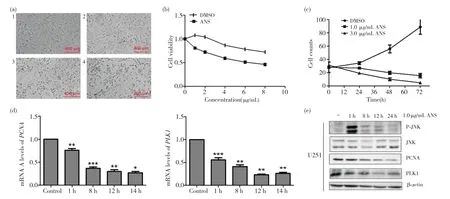
图3 激活JNK后能够抑制U251的细胞增殖Fig.3 Activated JNK can inhibits U251 cell proliferation
2.5 激活JNK后能够引起U251细胞周期的阻滞
为了进一步分析激活后的JNK对于神经胶质瘤细胞U251的影响,接下来进行了细胞周期分析。将茴香霉素处理8.0 h和DMSO处理8.0 h的U251细胞收集下来,滤网过滤后上流式细胞仪,进行细胞周期检测,并将所得数据用flowjo软件进行分析。试验结果发现,茴香霉素处理后的U251细胞 G0/G1期细胞比率增加,G2/M 期细胞比率减少,而S期细胞比率变化不明显,如图5a、5b所示。上述结果表明,在JNK被激活的条件下,U251细胞的周期被阻滞在G0/G1期。

图4 激活JNK后能够抑制U251细胞的迁移Fig.4 Activated JNK can inhibits U251 cell migration
2.6 RNA-seq分析寻找受JNK调节的下游转录因子
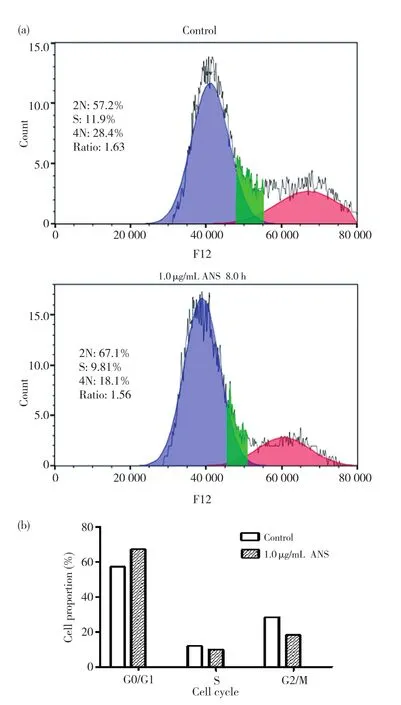
图5 激活JNK后能够引起U251细胞周期的阻滞Fig.5 Activated JNK can cause U251 cell cycle arrest
为了进一步探究JNK是如何引起U251细胞的功能发生变化,寻找受JNK调节的靶作用因子,揭示激活后的JNK对于神经胶质瘤起到抑瘤效果的分子机制,我们进行了RNA-seq分析。我们将严格按照要求处理的细胞送至上海美吉生物公司,进行RNA的抽提以及RNA-seq分析。得到的数据通过R studio软件进行基因集富集分析(gene set enrichment analysis,GSEA),富集到的P53和转化生长因子-β(transforming growth factor-β,TGF-β)通路,恰好是已有文献表明为JNK下游的通路,结果如图6a、6b所示。可见RNA-seq得到的数据是可靠的。通过转录因子预测平台,在对照组与试验组中筛选出的有表达差异的转录因子中,挑选了常见的且与肿瘤相关的P53和 Fox head家族进行比对,发现P53家族的得分最高,如图6c所示,因此我们推测受JNK调节的关键转录因子为P53。
3 讨论
目前在所有的脑肿瘤中,神经胶质瘤的发病率占第一位,并且其发病率高,术后复发快且预后差,严重威胁着人类健康。由于传统治疗方式如手术、化疗、放疗等的治疗效果难以使人满意[16],近年来研究者们对神经胶质瘤的研究逐渐趋向于不同通路的靶点治疗,这使得人类从分子水平调控神经胶质瘤的发生、发展成为可能[17]。
JNK蛋白作为能够调节细胞许多生理过程的主要蛋白激酶,在肿瘤的发生发展中起着至关重要的作用。但在不同类型的癌症中,JNK行使的功能也不同。有文献报道,JNK可以通过增强肝细胞增殖和促进新生血管形成而在肝癌中起到促癌作用,JNK途径还可抑制乳腺癌的发展[18-19]。而对于神经胶质瘤来说,有研究表明,JNK与胶质母细胞瘤的干性相关[20],并且JNK通路与神经胶质瘤的细胞凋亡也有关[21-22]。但具体JNK是否会对神经胶质瘤的发生发展产生影响,以及有怎样的影响,这是本课题接下来将要开展的研究内容。
本文通过生物信息数据分析得出JNK与神经胶质瘤的发生和发展存在很强的相关性,通过使用茴香霉素实现对细胞内P-JNK水平的有效调节,利用Western blot试验探究其发挥作用的最适条件是质量浓度为1.0μg/mL、时间为1.0 h。在此基础上用茴香霉素处理U251细胞,通过CCK-8检测、细胞计数、细胞划痕和流式细胞检测等试验,发现激活JNK后能够引起U251细胞的细胞增殖和迁移的抑制以及细胞周期的阻滞,从而达到抑瘤效果。本文通过激活JNK发现其能够对神经胶质瘤产生抑瘤效果,为JNK可作为神经胶质瘤的治疗靶点提供了依据;通过RNA-seq分析找到关键转录因子P53,为进一步探究JNK影响神经胶质瘤发生发展的调节机制提供了方向。
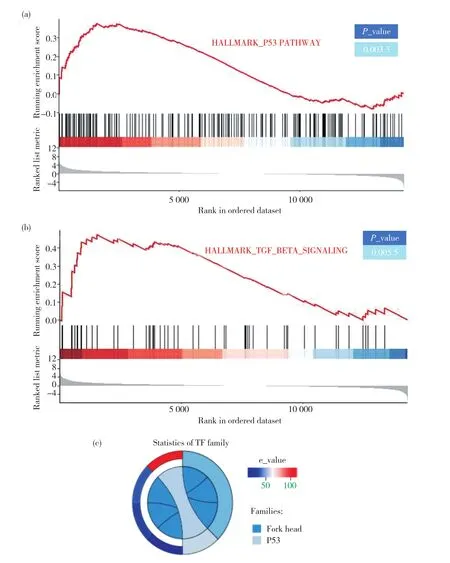
图6 RNA-seq分析寻找受JNK调节的下游转录因子Fig.6 RNA-seq analysis to find downstream transcription factors regulated by activated JNK

