TBX3通过Wnt/β-catenin信号通路影响胃癌细胞增殖、侵袭和迁移①
王红山 解寒冰 余江涛
(郑州人民医院普通外科,郑州 450000)
随着生活水平的提高,胃癌发病率呈上升趋势,虽然医疗水平不断提高,但胃癌的死亡率仍居高不下,对患者的健康造成严重威胁。除手术治疗、放化疗等传统疗法外,分子靶向治疗逐渐受到重视。胃癌的发生机制复杂,发病过程中伴随癌基因的激活或抑癌基因的失活,以及各组信号通路的紊乱。TBX3是T-box转录因子家族成员,在胚胎发育中发挥重要作用,可通过Wnt等信号通路发挥作用[1]。TBX3在恶性肿瘤的发生发展中也发挥重要作用,在多种恶性肿瘤中高表达,扮演癌基因角色,参与恶性肿瘤的发生发展过程[2]。TBX3可通过Wnt信号通路发挥作用,Wnt信号通路在胃癌的增殖、侵袭及迁移过程中发挥重要作用[3,4]。因此本文对胃癌细胞中TBX3表达及沉默TBX3表达对胃癌细胞增殖、侵袭、迁移及Wnt/β-catenin信号通路的影响进行研究,探讨TBX3在胃癌中的可能作用机制。
1 材料与方法
1.1材料
1.1.1细胞系 胃癌细胞系MGC-803、正常胃黏膜细胞系GES-1购自美国ATCC公司。
1.1.2试剂和仪器 Lipofectamine 2000试剂盒(美国Santa Cruz公司),TBX3 siRNA及阴性对照siRNA(德国Qigen公司),TBX3的shRNA引物序列:F:5′-CCGGGCTGATGACTGTCGTTATAAACTCGAGTTTATAACGACAGTCATCAGCTTTTTG-3′,R:5′-AATTCAAAAAGCTGATGACTGTCGTTATAAACTCG-AGTTTATAACGACAGTCATCAGC-3′,逆转录试剂盒、PCR试剂盒、Trizol试剂、结晶紫、ECL化学发光试剂盒(美国Sigma公司),CCK8试剂、Wnt/β-catenin信号通路抑制剂XAV939、DMEM培养基、胰蛋白酶(美国BPB公司),兔抗人TBX3单克隆抗体、兔抗人神经-钙黏蛋白(N-cadherin)单克隆抗体、兔抗人上皮-钙黏蛋白(E-cadherin)单克隆抗体、兔抗人Snail单克隆抗体、兔抗人Wnt3α单克隆抗体、兔抗人β-catenin单克隆抗体、兔抗人C-myc单克隆抗体(美国Invitrogen公司)。Transwell小室(美国TaKaRa公司),酶标仪及流式细胞仪(美国Bio-Rad公司),PCR扩增仪(美国Gibco公司)等。
1.2方法
1.2.1Western blot检测MGC-803细胞和GES-1细胞中TBX3蛋白水平 取对数生长的MGC-803细胞和GES-1细胞,加入RIPA裂解液裂解细胞,12 000 g 离心15 min,取上清,Bradford法测定MGC-803细胞和GES-1细胞蛋白浓度,取30 μg蛋白加入SDS-PAGE凝胶电泳,湿法转膜、脱脂牛奶封闭,加入兔抗人TBX3单克隆抗体(1∶1 000)孵育过夜,加入二抗(1∶3 000)孵育1 h,经显影、曝光、扫描图像,Image J分析蛋白条带灰度值。每组设7个复孔,以β-actin为内参。TBX3蛋白水平以TBX3蛋白条带灰度值/β-actin条带灰度值表示。
1.2.2RT-PCR测定MGC-803细胞和GES-1细胞中TBX3 mRNA水平 取MGC-803细胞和GES-1细胞细胞加入Trizol裂解液,提取总RNA,逆转录为cDNA,PCR法测定TBX3 mRNA水平TBX3 F:5′-TTTGAAGACCATGGAGCCCG-3′,R:5′-ACATTCGCCTTCCCGACTTG-3′。PCR反应条件:95℃ 30 s,95℃ 10 s,56℃ 30 s,72℃ 30 s,共38个循环。每组设7个复孔。以β-actin为内参。TBX3 mRNA水平以2-ΔΔCt表示。
1.2.3细胞分组和转染 取对数生长期MGC-803细胞分为空白对照组(BC组)、阴性对照组(NC组)、siR-TBX3组和siR-TBX3+XAV939组,接种于6孔板(5×105个/孔),待细胞生长至85%以上融合时进行转染,按照Lipofectamine 2000试剂盒说明书进行。NC组细胞转染阴性对照siRNA,siR-TBX3组细胞转染TBX3-siRNAsiR-TBX3+XAV939,细胞转染TBX3-siRNA的同时加入Wnt/β-catenin信号通路抑制剂XAV939(4 μmol/L),BC组细胞不转染[5]。转染48 h后采用Western blot和RT-PCR测定细胞中TBX3蛋白和mRNA水平,方法同1.2.1和1.2.2。
1.2.4CCK8测定MGC-803细胞增殖 将转染48 h 后各组MGC-803细胞接种于96孔板(1×103个/孔),分别于培养24、48、72 h加入10 μl CCK8,每组设7个复孔,加入CCK8后培养2 h,酶标仪测定各孔吸光度。
1.2.5Transwell实验检测MGC-803细胞侵袭和迁移能力 将转染48 h后的MGC-803细胞用无血清培养基重悬,稀释至5×105个/ml,取200 μl加入Transwell小室上室,下室加入含血清培养基,培养24 h取出小室,多聚甲醛固定30 min,棉签擦去上室细胞,结晶紫染色30 min,镜下拍照计算迁移细胞数。侵袭实验在实验前用100 μl Matrigel胶包被小室上室,其余步骤与迁移实验相同。
1.2.6Western blot检测MGC-803细胞N-cadherin、E-cadherin、Snail、Wnt3α、β-catenin、C-myc蛋白水平 取各组转染48 h MGC-803细胞加入蛋白裂解液提取总蛋白,Western blot测定MGC-803细胞各蛋白水平。方法同1.2.1。

2 结果
2.1胃癌细胞MGC-803中TBX3表达情况 胃癌细胞MGC-803中TBX3蛋白和mRNA水平高于正常胃黏膜细胞GES-1(P<0.05)。见表1、图1。

图1 Western blot测定 MGC-803细胞和GES-1细胞中TBX3蛋白水平Fig.1 Western blot analysis of TBX3 protein levels in MGC-803 cells and GES-1 cells

表1 MGC-803细胞和GES-1细胞中TBX3蛋白及mRNA水平Tab.1 TBX3 protein and mRNA levels in MGC-803 cells and GES-1
2.2转染后各组MGC-803细胞中TBX3蛋白和mRNA水平比较 与BC组和NC组相比,siR-TBX3组MGC-803细胞中TBX3蛋白和mRNA水平降低(P<0.05),BC组和NC组MGC-803细胞中TBX3蛋白和mRNA水平差异无统计学意义(P>0.05)。见表2、图2。

图2 Western blot测定MGC-803细胞和GES-1细胞中TBX3蛋白水平Fig.2 Western blot analysis of TBX3 protein levels in MGC-803 cells and GES-1 cells
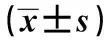
表2 各组MGC-803细胞中TBX3蛋白和mRNA水平Tab.2 TBX3 protein and mRNA levels in each group of MGC-803
2.3各组MGC-803细胞增殖能力比较 24 h时,各组MGC-803细胞增殖能力差异无统计学意义(P>0.05);42、72 h时,与BC组和NC组相比,siR-TBX3组和siR-TBX3+XAV939组MGC-803细胞增殖能力降低(P<0.05),与siR-TBX3组相比,siR-TBX3+XAV939组MGC-803细胞增殖能力降低(P<0.05),BC组和NC组MGC-803细胞增殖能力差异无统计学意义(P>0.05)。见图3。
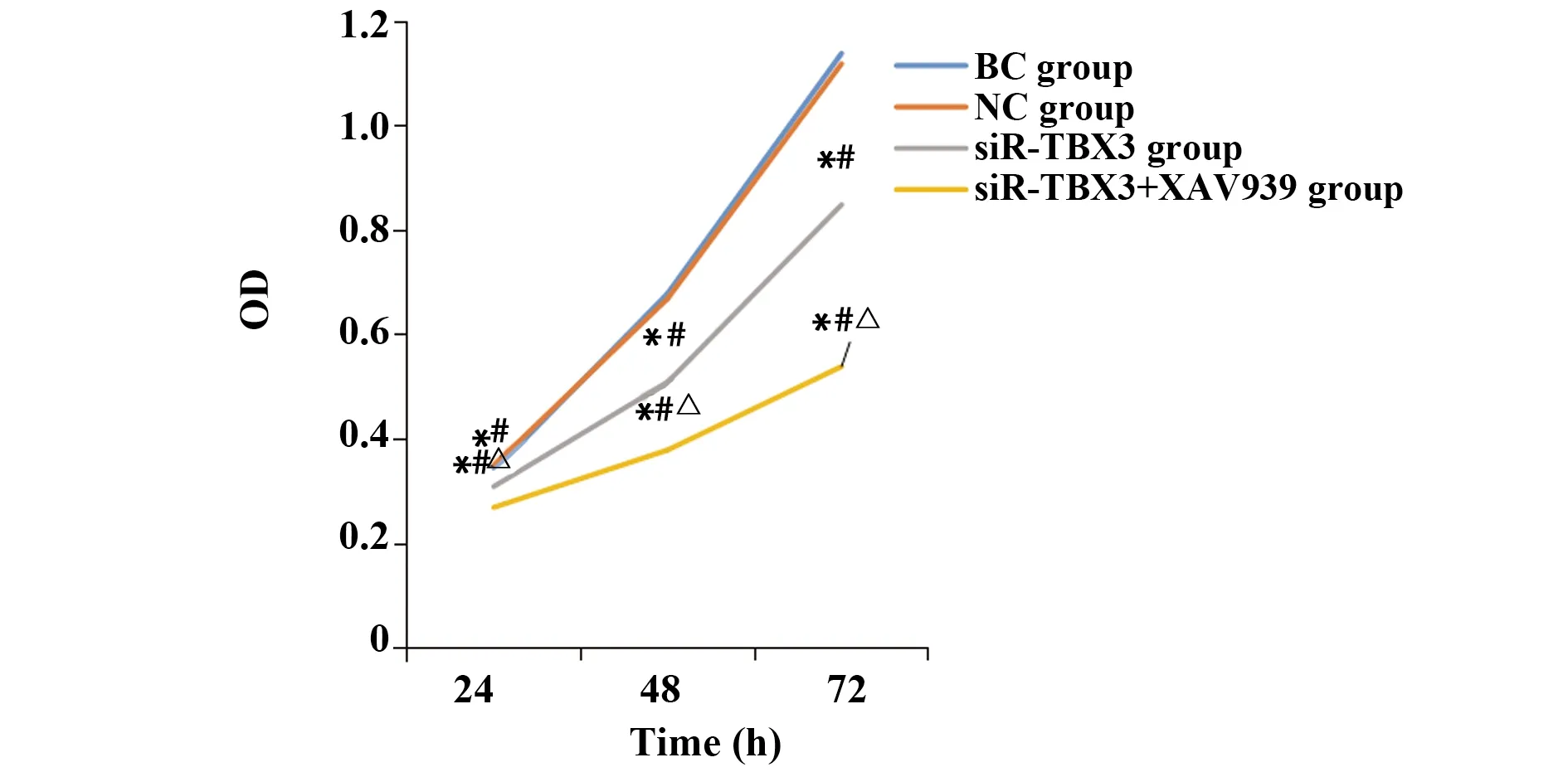
图3 各组MGC-803细胞增殖能力Fig.3 Proliferation ability of each group of MGC-803 cellsNote:Compared with BC group,*.P<0.05;compared with NC group,#.P<0.05;compared with siR-TBX3 group,△.P<0.05.
2.4各组MGC-803细胞侵袭和迁移能力比较 与BC组和NC组相比,siR-TBX3组和siR-TBX3+XAV939组MGC-803细胞侵袭细胞数和迁移细胞数减少(P<0.05),与siR-TBX3组相比,siR-TBX3+XAV939组MGC-803细胞侵袭细胞数和迁移细胞数减少(P<0.05),BC组和NC组MGC-803细胞侵袭细胞数和迁移细胞数差异无统计学意义(P>0.05)。见图4。
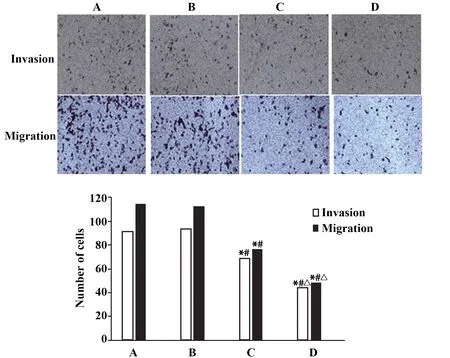
图4 各组MGC-803细胞侵袭和迁移细胞数比较Fig.4 Comparison of number of invasion and migration cells of each group of MGC-803 cellsNote:A.BC group;B.NC group;C.siR-TBX3 group;D.siR-TBX3+XAV939 group.Compared with BC group,*.P<0.05;compared with NC group,#.P<0.05;compared with siR-TBX3 group,△.P<0.05.
2.5各组MGC-803细胞上皮间质转化情况比较 与BC组和NC组相比,siR-TBX3组和siR-TBX3+XAV939组MGC-803细胞N-cadherin、Snail蛋白水平降低(P<0.05),E-cadherin蛋白水平升高(P<0.05);与siR-TBX3组相比,siR-TBX3+XAV939组MGC-803细胞N-cadherin、Snail蛋白水平降低(P<0.05),E-cadherin蛋白水平升高(P<0.05),BC组和NC组MGC-803细胞N-cadherin、E-cadherin、Snail蛋白水平差异无统计学意义(P>0.05)。见图5。

图5 Western blot测定各组MGC-803细胞N-cadherin、E-cadherin、Snail蛋白水平Fig.5 Western blot analysis of N-cadherin,E-cadherin and Snail protein levels in each group of MGC-803 cellsNote:A.BC group;B.NC group;C.siR-TBX3 group;D.siR-TBX3+XAV939 group.Compared with BC group,*.P<0.05;compared with NC group,#.P<0.05;compared with siR-TBX3 group,△.P<0.05.
2.6各组MGC-803细胞Wnt/β-catenin信号通路比较 与BC组和NC组相比,siR-TBX3组和siR-TBX3+XAV939组MGC-803细胞Wnt3α、β-catenin、C-myc蛋白水平降低(P<0.05),与siR-TBX3组相比,siR-TBX3+XAV939组MGC-803细胞Wnt3α、β-catenin、C-myc蛋白水平降低(P<0.05),BC组和NC组MGC-803细胞Wnt3α、β-catenin、C-myc蛋白水平差异无统计学意义(P>0.05)。见图6。

图6 Western blot测定各组MGC-803细胞Wnt3α、β-catenin、C-myc蛋白水平Fig.6 Western blot analysis of Wnt3α,β-catenin and C-myc protein levels in each group of MGC-803 cellsNote:A.BC group;B.NC group;C.siR-TBX3 group;D.siR-TBX3+XAV939 group.Compared with BC group,*.P<0.05;compared with NC group,#.P<0.05;compared with siR-TBX3 group,△.P<0.05.
3 讨论
T-box基因在多细胞生物的胚胎发育中发挥重要作用,可通过与DNA结合参与并调节胚胎组织和形态发育。TBX3是T-box家族成员之一,在胚胎发育、肝细胞和恶性肿瘤发展中发挥重要作用,TBX3缺失可诱导胚胎干细胞分化,可通过Wnt 信号通路调控肝细胞分化,TBX3通过对胚胎干细胞的调控作用促进肝脏、心脏、四肢及乳腺等发育[6]。TBX3在恶性肿瘤的发生发展中也发挥重要作用[7]。如TBX3参与乳腺癌的发生发展,可促进非侵袭性乳腺癌向浸润性乳腺癌进展,在肾癌组织中高表达,与肾癌的淋巴结转移、远处转移和TNM分期有关,参与肾癌的发生和转移过程,在非小细胞肺癌中高表达,与非小细胞肺癌的预后不良有关[8-11]。本文对胃癌MGC-803细胞中TBX3水平进行研究,发现胃癌MGC-803细胞中TBX3蛋白和mRNA水平升高,沉默TBX3表达可抑制胃癌细胞的增殖、侵袭和迁移,表明TBX3可能参与胃癌的发生发展过程。
上皮间质转化可提高恶性肿瘤细胞的抗凋亡能力,促进肿瘤干细胞形成,降解细胞外基质,在恶性肿瘤的发生发展及恶性转化中发挥重要作用,赋予恶性肿瘤细胞侵袭和迁移潜能[12,13]。N-cadherin为间质性蛋白,E-cadherin为上皮标志蛋白,N-cadherin表达水平升高的同时E-cadherin表达下降或缺失为上皮间质转化的标志[14,15]。Snail为上皮间质转化进程的重要转录因子,可抑制E-cadherin基因转录,降低细胞间的黏附作用,从而调控上皮间质转化过程[16]。本研究发现沉默胃癌细胞中TBX3可降低细胞中N-cadherin、Snail蛋白水平,上调细胞中E-cadherin蛋白水平。表明沉默TBX3可通过抑制上皮间质转化抑制胃癌细胞的侵袭和迁移。
Wnt/β-catenin信号通路为恶性肿瘤增殖、侵袭和迁移的关键通路,在胃癌的上皮间质转化中发挥关键作用,抑制该信号通路可逆转上皮间质转化进程[17]。Wnt/β-catenin信号通路关闭时,β-catenin与丝苏氨酸蛋白激酶3、腺瘤结肠息肉蛋白和轴蛋白及细胞周期蛋白依赖性激酶抑制因子形成降解复合物,通过诱导β-catenin泛素化修饰终止信号通路传导,激活Wnt/β-catenin信号通路,β-catenin大量累积并转运至细胞核内,与T细胞因子/淋巴增强因子形成转录复合物,启动下游C-myc、CyclinD1等靶基因转录,并调控上皮间质转化基因转录,从而促进胃癌的增殖和侵袭迁移过程[18-20]。C-myc和肿瘤细胞的增殖关系密切,可促进细胞分裂,导致细胞无限增殖。TBX3可通过Wnt信号通路发挥作用,在S期发挥重要作用,通过C-myc调节细胞生长过程[21]。本文沉默胃癌细胞TBX3表达,可抑制细胞中Wnt3α、β-catenin、C-myc蛋白水平;给予Wnt/β-catenin信号通路抑制剂也可抑制胃癌细胞增殖、侵袭迁移,并降低细胞中N-cadherin、Snail、Wnt3α、β-catenin、C-myc蛋白水平,升高细胞中E-cadherin蛋白水平,提示沉默细胞TBX3及给予Wnt/β-catenin信号通路抑制剂均可调节Wnt/β-catenin信号通路,抑制胃癌细胞增殖、侵袭和迁移,抑制细胞上皮间质转化,表明沉默TBX3可能通过Wnt/β-catenin信号通路抑制胃癌细胞增殖和侵袭迁移。
综上所述,胃癌MGC-803细胞中TBX3水平升高,沉默TBX3可通过抑制Wnt/β-catenin信号通路抑制上皮间质转化,从而抑制胃癌细胞的生长和侵袭迁移,有望成为胃癌治疗的潜在靶点。

