下调TACC2表达抑制胃癌细胞增殖及上皮间充质转化①
欧阳德亮 刘龙飞 王丽萍 黄明明 肖建虹
(南华大学附属第三医院普外科,衡阳 421000)
胃癌是全球常见恶性肿瘤之一,在全球癌症死亡率中位居第二[1]。胃癌发病较为隐匿且早期症状不明显,仅出现上腹不适、食欲不振等非特异性症状,因此容易被忽略而错失最佳治疗时间[2]。随着医疗水平不断提高,手术及辅助疗法有所改进,但胃癌的防治仍然困难重重[3]。胃癌的发病机制较为复杂,且涉及多种相关基因的调控[4]。因此明确胃癌发病的分子机制对于其有效防治意义重大。
TACC蛋白作为中心体和微管结合蛋白,能够在细胞有丝分裂过程中稳定纺锤体并促进微管蛋白形成,进而维持染色体功能[5]。研究表明,TACC蛋白表达异常会影响染色质重构复合物的相互作用,从而降低基因稳定性导致肿瘤形成[6]。研究报道,TACC2在乳腺癌和前列腺癌中均呈高表达,促进肿瘤发生发展[7,8]。而在直肠癌细胞中抑制TACC2表达可显著抑制癌细胞增殖[9]。尽管已有研究证实TACC2在不同肿瘤中的重要作用,但其在胃癌中的表达及对胃癌发生发展的影响及作用机制尚未明确。本文通过研究TACC2在胃癌组织及细胞株中的表达情况,探讨其对胃癌细胞增殖及上皮间充质转化(epithelial mesenchymal transformation,EMT)的影响,以期为胃癌有效预防提供实验依据。
1 材料与方法
1.1材料 胃癌细胞株MGC-803、MKN-28、SGC-7901、ASG及正常胃黏膜上皮细胞GES-1购自中科院细胞库;TRIzol试剂盒、逆转录试剂盒购自美国Invitrogen公司;pcDNA3.0-TACC2、shTACC2载体由上海吉凯基因构建;CCK-8试剂购自北京索莱宝科技有限公司;兔抗N-cadherin、vimentin、E-cadherin、p-PI3K、p-Akt、p-p65、β-actin一抗购自CST公司;HRP标记羊抗兔 IgG、LY294002购自碧云天生物公司;细胞培养试剂购自上海生物工程股份有限公司。
1.2方法
1.2.1胃癌组织样本收集 收集我院2017年6月~2017年12月行根治手术的胃癌患者的石蜡标本15例,并取距肿瘤组织大于5 cm的癌旁组织及正常胃组织。标本切除后立即进行组织RNA提取或保存至液氮中待用,所有病例均经病理检查确诊为胃癌。
1.2.2细胞培养以及处理 MGC-803、MKN-28、SGC-7901、ASG及GES-1细胞均培养于含10%胎牛血清的RPMI1640培养基中,培养条件为37℃、5% CO2。将生长良好的细胞分别接种至24孔板,待细胞生长至80%融合度时,将shTACC2、pcDNA3.0-TACC2转染至MGC-803细胞,并分别于0、24、48、72 h收集细胞。用10 μmol/L PI3K/Akt抑制剂LY294002处理pcDNA3.0-TACC2转染的MGC-803细胞,于0、24、48、72 h收集细胞。
1.2.3转染 调整MGC-803细胞浓度为1×105/ml,接种至6孔板,1 ml/孔。加入稀释好的shTACC2及pcDNA3.0-TACC2载体,培养20 h后弃培养基,加入新的完全培养基继续培养72 h后传代。转染完成后RT-PCR检测细胞内TACC2 mRNA水平,评估不同载体的转染效果。
1.2.4qRT-PCR检测TACC2 mRNA水平 TRIzol试剂盒提取胃癌组织及胃癌细胞株总RNA,纯化后逆转录为cDNA,进行PCR扩增。2-ΔΔCt法计算胃癌组织及各胃癌细胞中TACC2 mRNA相对表达。引物设计如下:TACC2 F:5′-CTGCTGTTCCTCC-AGTTCCA-3′,R:5′-GGAACTCTGAGGTCAACTTGC-T-3′,β-actin F:5′-CCTGGGCATGGAGTCCTGTG-3′,R:5′-TCTTCATTGTGCTGGGTGCC-3′。
1.2.5CCK-8法检测细胞增殖 将转染shTACC2、pcDNA3.0-TACC2载体的MGC-803细胞稀释至1×104/ml后加入至96孔板,100 μl/孔,分别在培养0、24、48、72 h后,10 μl/孔加入CCK-8溶液(5 mg/ml),继续培养4 h。取出96孔板,轻轻摇晃30 s混匀。酶标仪450 nm处测定各孔吸光度。
1.2.6Western blot检测蛋白表达水平 收集上述处理后的细胞,加入裂解液收集细胞总蛋白。检测蛋白浓度后行SDS-PAGE电泳,置于转膜仪转膜。转膜后分别孵育N-cadherin、vimentin、E-cadherin、p-PI3K、p-Akt、p-p65一抗抗体,4℃反应过夜。洗膜后加入稀释的二抗,37℃反应2 h。抗体孵育完成后,显影仪显影。以β-actin为内参,Image J2X软件进行灰度值扫描,计算相对表达量。

2 结果
2.1TACC2在胃癌组织与胃癌细胞中的表达 胃癌组织中TACC2相对表达显著高于癌旁组织及正常胃组织(P<0.01)。胃癌细胞株MGC-803、MKN-28、SGC-7901及ASG中TACC2表达显著高于正常胃黏膜上皮细胞GES-1(P<0.05)。见图1。
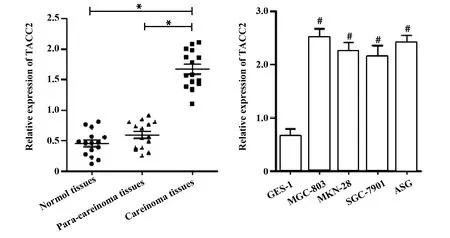
图1 TACC2在胃癌组织与胃癌细胞系中的表达Fig.1 Expressions of TACC2 in gastric cancer tissues and cell linesNote: *.P<0.05;#.P<0.05 vs GES-1 cells.
2.2下调TACC2表达抑制胃癌细胞增殖 shTACC2载体转染后细胞内TACC2表达显著降低。转染后24、48、72 h MGC-803细胞增殖水平均低于shCtrl组(P<0.05)。见图2。
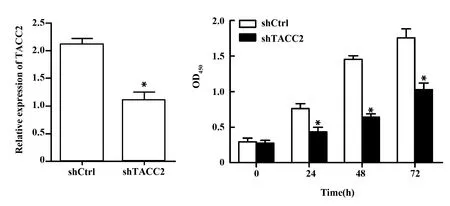
图2 下调TACC2表达对MGC-803细胞增殖的影响Fig.2 Effect of down-regulating TACC2 expression on cell proliferation of MGC-803 cellNote: *.P<0.05 vs shCtrl.
2.3下调TACC2表达抑制胃癌细胞EMT 转染shTACC2载体后MGC-803细胞内N-cadherin及vimentin表达水平显著下降,而E-cadherin表达显著上升(P<0.05,图3)。
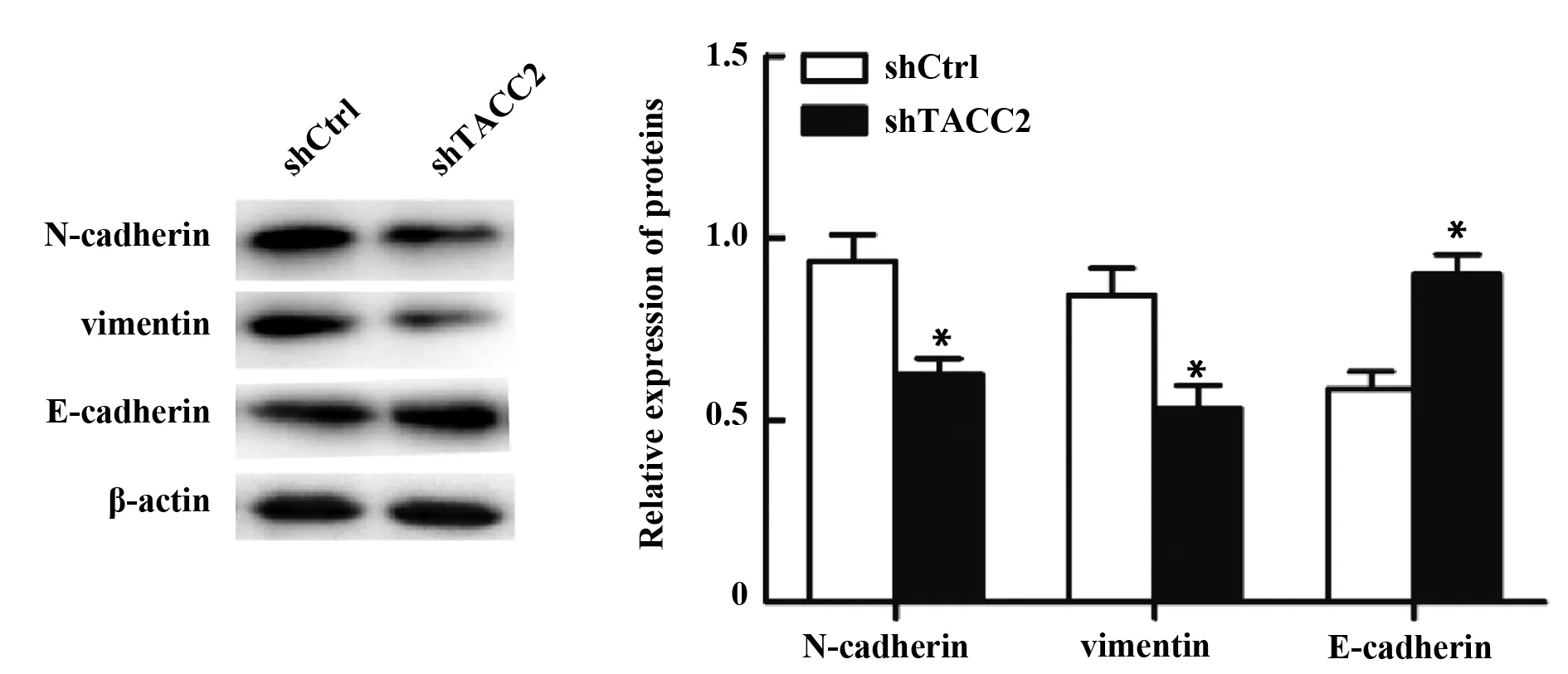
图3 下调TACC2表达对MGC-803细胞EMT的影响Fig.3 Effect of down-regulating TACC2 expression on EMT of MGC-803 cellNote: *.P<0.05 vs shCtrl.
2.4下调TACC2表达抑制PI3K/Akt/NF-κB信号通路 Western blot结果显示,shCtrl组细胞内p-PI3K、p-Akt及p-p65表达水平较高,而转染了shTACC2载体的MGC803细胞内,p-PI3K、p-Akt及p-p65水平显著降低(P<0.05,图4)。
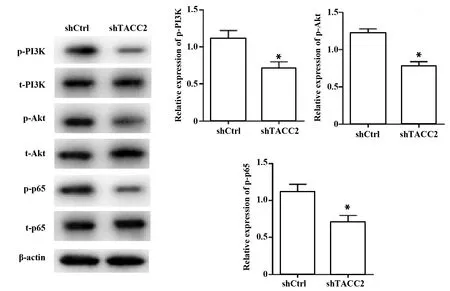
图4 下调TACC2表达对PI3K/Akt/NF-κB信号通路的影响Fig.4 Effect of of down-regulating TACC2 expression on PI3K/Akt/NF-κB signaling pathway Note: *.P<0.05 vs shCtrl.
2.5抑制PI3K/Akt通路对过表达TACC2所致胃癌细胞增殖及EMT的影响 pcDNA3.0-TACC2转染MGC-803细胞后,TACC2表达显著上升。采用PI3K/Akt抑制剂LY294002处理转染的MGC-803细胞后,其增殖水平显著低于TACC2转染组,但仍高于pcDNA3.0组及pcDNA3.0+LY294002组(P<0.05,图5);抑制剂处理后MGC-803细胞内N-cadherin及vimentin表达显著降低,E-cadherin表达显著上升(P<0.05),但pcDNA3.0组与pcDNA3.0+LY294002组间差异无统计学意义。见图6。
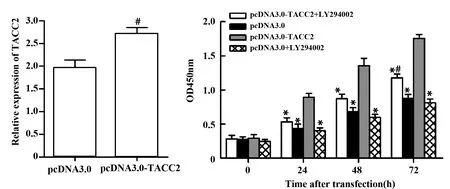
图5 PI3K/Akt/NF-κB信号通路对MGC-803细胞增殖的影响Fig.5 Effect of PI3K/Akt/NF-κB signaling pathway on cell proliferation of MGC-803 cellNote: *.P<0.05 vs pcDNA3.0-TACC2 group;#.P<0.05 vs pcDNA3.0 group.
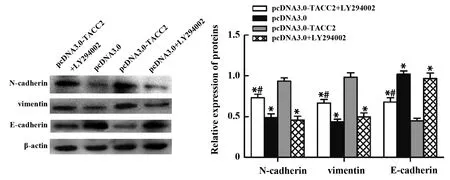
图6 PI3K/Akt/NF-κB信号通对MGC-803细胞EMT的影响Fig.6 Effect of PI3K/Akt/NF-κB signaling pathway on EMT of MGC-803 cellNote: *.P<0.05 vs pcDNA3.0-TACC2 group;#.P<0.05 vs pcDNA3.0 group.
3 讨论
胃癌是常见消化道恶性肿瘤,随生活水平提高,其发病率逐年上升,已成为影响人类生命健康的重要因素[10]。目前胃癌的治疗方法主要包括手术切除、化疗等,虽然可一定程度上改善胃癌患者症状,但治疗效果并不理想[11]。基因靶向治疗是近年肿瘤治疗的热门方法,可针对性杀伤癌细胞,对正常细胞损伤较小。但考虑到胃癌的发展过程涉及多种基因的调控,因此,明确促进胃癌形成的基因靶点对于胃癌防治意义重大。
TACC家族主要包括TACC1、TACC2及TACC3。TAAC2是位于中心体上的调节蛋白,对于维持基因稳定表达具有重要意义[12]。研究表明TACC2在不同类型的癌症中均呈高表达[13]。TACC2在前列腺癌细胞中呈高表达,可促进雄激素介导的细胞增殖[8]。最新研究发现,TACC2在直肠癌细胞中同样高表达,提示其可能作为原癌基因导致结直肠癌发生[9]。本研究分别检测了胃癌组织及胃癌细胞中TACC2的表达水平,结果显示其在胃癌组织及细胞中均呈高表达。采用shRNA下调细胞内TACC2表达,其增殖水平受到明显抑制,与群体研究结论相符。
EMT是上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程[14]。研究表明,EMT直接参与胚胎发育、组织再生、伤口愈合,与肿瘤发生密切相关。EMT参与的肿瘤发生过程主要包括细胞黏附性降低、细胞极性和细胞骨架改变、细胞迁移、侵袭等[15]。EMT的主要特征为细胞黏附分子E-cadherin表达降低及间充质细胞标志物N-cadherin、vimentin表达上升,是肿瘤细胞具有高侵袭与高转移性的主要机制[16]。研究表明,通过EMT上皮细胞会失去细胞极性,进而失去与基底膜的连接,增强细胞活性,并获得促进细胞增殖及抗细胞凋亡的能力[17]。本研究发现转染shTACC2载体后MGC-803细胞内EMT水平受到明显抑制,而转染shTACC2同样可抑制MGC-803细胞增殖,提示下调TACC2表达可能通过抑制胃癌细胞EMT进而抑制胃癌细胞增殖。
PI3K/Akt是重要的细胞内信号通路,其在调节细胞周期、增殖、凋亡及维持细胞外基质和细胞黏附功能等方面发挥重要作用[18]。研究表明,PI3K/Akt激活可能与恶性肿瘤发生相关[19]。NF-κB是Akt通路的下游的重要分子,能够调节多种基因表达并参与细胞增殖、凋亡等过程[20]。本研究在下调细胞内TACC2基因表达后,分别检测了细胞内p-PI3K、p-Akt及p-p65的磷酸化水平,结果显示,下调TACC2表达可明显抑制p-PI3K、p-Akt及p-p65的磷酸化水平,提示下调TACC2表达可抑制PI3K/Akt/NF-κB信号通路。采用PI3K/Akt抑制剂处理转染pcDNA3.0-TACC2的细胞,发现细胞增殖及EMT水平显著降低,与既往研究结论相符。
综上所述,本研究明确了TACC2在胃癌组织胃癌细胞中的表达情况,并初步证实了下调TACC2表达可通过抑制PI3K/Akt/NF-κB信号通路抑制胃癌细胞增殖及EMT。但由于影响胃癌发生的分子机制十分复杂,是否存在其他调控机制尚未明确,有待进一步研究。

