不同生育期卷丹百合的多酚积累特性及其抗氧化活性
王云霞,张萍,葛蓓蕾,雅蓉,张瑞军,靳磊
不同生育期卷丹百合的多酚积累特性及其抗氧化活性
王云霞,张萍,葛蓓蕾,雅蓉,张瑞军,靳磊*
(宁夏大学农学院,宁夏 银川 750021)
为探究不同生育期卷丹百合各器官中多酚类物质的积累规律及其抗氧化能力,分别采用福林-肖卡法、NaNO2-AlCl3法、香草醛比色法、pH示差法测定不同生育期(现蕾期、花期、半枯期、全枯期)卷丹百合各器官(基生根、鳞茎、茎生根、茎秆、叶片、株芽、花)中总酚、总黄酮、总黄烷醇和花色苷的含量,运用DPPH法、铜离子还原法和金属螯合能力、抑制脂质过氧化活性,分析其多酚提取物的抗氧化能力。结果表明:不同生育期卷丹百合各器官多酚类物质的含量及其抗氧化活性存在差异;卷丹百合植株在花期总酚含量最高,半枯期的次之,全枯期的最少;花期,花中总酚含量最高,达14.75 mg/g,叶片中的总酚含量次之,珠芽的最低,仅为3.12 mg/g;卷丹百合多酚提取液的抗氧化能力在花期最强,其次是半枯期;相关性分析表明,卷丹多酚类物质与抗氧化活性在各时期、各器官呈现出显著(<0.05)或极显著(<0.01)的相关性,相关系数为-1.00~1.00,其中,花期和半枯期卷丹多酚类物质与铜离子还原力基本呈显著或极显著正相关。
卷丹百合;生育期;器官;多酚积累;抗氧化活性
卷丹百合()又名虎皮百合、宜兴百合,为百合科百合属多年生草本植物。作为《中华人民共和国药典》入药的3种百合之一[1],其鳞茎和花器官中富含生物碱、皂甙、多糖和多酚等功能性次生代谢物,具有润肺止咳、清热安神[2-5]等营养保健功效。卷丹百合(以下简称卷丹)作为中国百合属广布种之一,不仅是百合药材的主要来源,也是三大食用百合之一,其综合抗性强,易繁殖,对土壤要求不严,是理想的药食兼用百合种质资源[6]。
近年来,由于卷丹中多酚类物质具有抗氧化、抗肿瘤、降血脂[7-10]等功能而受到消费者青睐。目前,国内外学者对卷丹多酚的研究主要集中在对其鳞茎、花等器官多酚组分和含量的测定,而对其他器官的研究极少。前人[11-15]研究了卷丹鳞茎中多酚类物质的组成及其抗氧化能力,发现其鳞茎中富含多酚类物质且具有良好的抗氧化能力;GUO等[16]从卷丹花瓣中鉴定出11种多酚单体化合物;并发现卷丹花瓣作为天然植物抗氧化剂资源具有较高的开发价值[17]。然而,以往研究仅分析了特定时期卷丹单个器官中的多酚含量及抗氧化活性,而对整个生育期卷丹不同器官的多酚类物质的积累规律及抗氧化活性的分析尚少见报道,缺乏对卷丹植株不同器官间的比较,无法掌握整个生育期多酚的积累规律,不利于对卷丹植株的充分开发和合理利用。鉴于此,本研究以卷丹植株为试材,测定不同时期(现蕾期、花期、半枯期和全枯期)卷丹不同器官(基生根、鳞茎、茎生根、叶片、茎秆、珠芽和花)中多酚类物质的含量,研究其多酚提取物的抗氧化活性(清除DPPH自由基活性、铜离子还原力、金属螯合能力和抑制脂质过氧化活性),通过对卷丹植株不同器官间的比较,探索整个生育期多酚的积累规律、植株最佳采收器官和采收期,旨在为卷丹种质资源品性分析、品质调控、农艺学改良与人工规模化栽培及综合利用提供参考。
1 材料与方法
1.1 试验材料
卷丹种球(周径12~15 cm)购自陕西岚皋。2017年12月29日,将种球种植于宁夏大学农科实训基地玻璃温室,出苗后进行常规管理(3~5 d浇水1次,整个测定期不施任何肥料)。分别于卷丹现蕾期(2018年4月25日)、花期(6月4日)、半枯期(6月24日)、全枯期(7月14日)采样。每次采6株。分别收集卷丹不同器官(基生根、鳞茎、茎生根、叶片、茎秆、珠芽和花),经自来水冲洗,烘干(50 ℃)后粉碎,过筛(孔径0.25 mm),备用。
1.2 主要仪器与试剂
主要试验仪器:UV-4803型紫外可见分光光度计(上海尤尼柯仪器有限公司生产);KQ-500DE型数控超声清洗器(昆山市超声仪器有限公司);HHS-8型水浴锅(南通三思机电科技有限公司);TGL-20M/TGL-20MC离心机(湖南湘鑫仪器仪表有限公司)。
主要试验试剂:福林酚试剂购自天津市大茂化学试剂厂;碳酸钠、没食子酸、氯化亚铁均购自天津博迪化工有限公司。
1.3 方法
1.3.1卷丹提取液的获取
称取4个生育期不同器官干粉各1.00 g,放入50 mL离心管中,加入15 mL甲醇溶液,封口后于50 ℃下超声提取30 min,于4 ℃离心10 min(12 000 r/min),收集上清液,避光保存至4 ℃冰箱,用于多酚类物质含量及抗氧化活性的测定。
1.3.2卷丹总酚类物质含量的测定
采用福林-肖卡法[18]测定总酚含量,结果以每克干粉中含有的没食子酸质量(mg)表示;采用NaNO2-AlCl3法[19]测定总黄酮含量,结果以每克干粉中含有的芦丁质量(mg)表示;采用香草醛比色法[20]测定总黄烷醇含量,结果以每克干粉中含有的儿茶素质量(mg)表示;花色苷含量采用pH示差法测定[21],结果用每克干粉中含有的矢车菊素-3-葡萄糖苷质量(mg)表示。
1.3.3抗氧化指标的测定
参考BRAND-WILLIAMS等[22]的方法测定清除DPPH自由基的活性,结果以每克干粉中所含水溶性维生素E的量(µmol)表示;参考APAK等[23]的方法测定铜离子还原能力(CUPRAC),结果以每克干粉中所含水溶性维生素E的量(µmol)表示;参考 GULCIN等[24]的方法测定金属螯合能力(MCC),结果以螯合铁离子的质量分数表示;参考TSUDA等[25]的方法测定抑制脂质过氧化活性(TBARS),结果以脂质过氧化抑制率表示。
1.4 数据处理与分析
所有试验重复3次,结果以“平均值±标准差”表示。采用Excel 2010绘图;运用SPSS 19.0进行相关性分析、方差分析和均值比较。
2 结果与分析
2.1 不同生育期卷丹各器官中总酚、总黄酮、总黄烷醇和花色苷的积累
不同生育期卷丹各器官中的总酚、总黄酮、总黄烷醇和花色苷含量存在差异。基生根、茎生根、茎秆中的含量在全枯期达最大值;叶片和花中的含量在花期达最大值;鳞茎和珠芽中的含量在半枯期达最大值。
如图1所示,现蕾期,卷丹不同器官中总酚含量为1.26~8.09 mg/g,其中基生根中的总酚含量是珠芽的6.42倍。花期不同器官中总酚含量为3.12~14.75 mg/g,除基生根外,其他器官总酚含量均上升(为现蕾期的1.15~2.50倍),而基生根的总酚含量在花期较现蕾期的下降了7.79%。半枯期卷丹不同器官中总酚含量为3.01~12.34 mg/g,除鳞茎外,其他器官的总酚含量均下降(较花期下降了0.13%~36.83%),而鳞茎中总酚含量上升至最大值(4.07 mg/g),较花期的提高了2.01%。全枯期卷丹不同器官中总酚含量在2.41 ~7.65 mg/g之间,除基生根外,其他器官中总酚含量均下降(较现蕾期下降了22.75%~33.01%),基生根的总酚含量较半枯期的提高了2.68%。卷丹植株在整个生育期,花期总酚含量积累最多,为55.56 mg/g;其次是半枯期,为46.37 mg/g。花器官中所含总酚最多,叶片中的次之,珠芽中的最少。

不同小写字母表示同一生育期不同器官中的含量在0.05水平差异显著。
由图2可知,现蕾期,卷丹不同器官中总黄酮含量为0.75~10.65 mg/g,叶片中的总黄酮含量显著高于珠芽的,是珠芽的14.20倍。花期,卷丹不同器官总黄酮含量为2.05~18.18 mg/g,基生根、鳞茎、茎生根、叶片、珠芽和花中的总黄酮含量均表现为上升趋势,是现蕾期的1.02~7.34倍。半枯期,不同器官中总黄酮含量为2.44~16.74 mg/g,其中茎秆、基生根、珠芽和花中的总黄酮含量呈上升趋势,较花期的提高了14.44%~31.71%;鳞茎、茎生根和叶片的总黄酮含量呈下降趋势,较花期的显著下降了3.54%~45.09%。全枯期,卷丹不同器官中总黄酮含量为1.67~15.32 mg/g,茎生根、茎秆和基生根的总黄酮含量表现为上升趋势,是半枯期的1.10~2.93倍,鳞茎、叶片和珠芽的总黄酮含量呈下降趋势,较半枯期显著下降了21.62%~556.02%。综上所述,卷丹植株在花期总黄酮含量积累最多,为47.40 mg/g,其次是半枯期,为46.39 mg/g。叶片中的总黄酮含量最多,花中的次之,珠芽的最少。
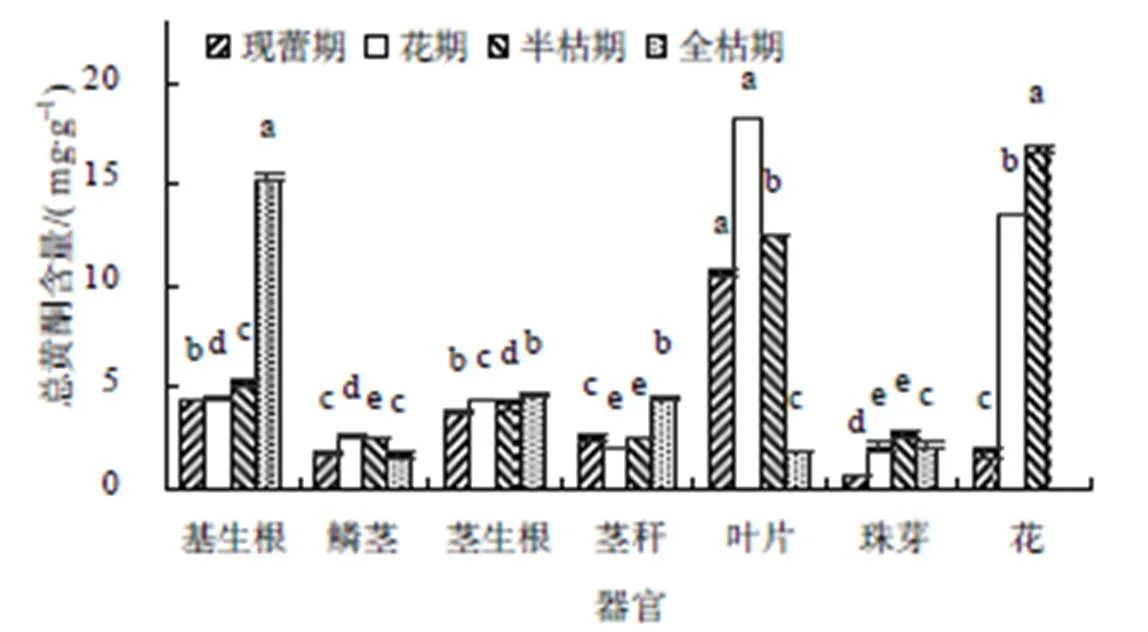
不同小写字母表示同一生育期不同器官中的含量在0.05水平差异显著。
从图3可以看出,现蕾期,卷丹不同器官中黄烷醇含量为0.04~3.42 mg/g,叶片中黄烷醇含量是珠芽的85.50倍。花期,卷丹不同器官中黄烷醇含量为0.13~6.06 mg/g,鳞茎、茎秆、叶片、基生根、珠芽和花的黄烷醇含量均明显高于现蕾期的,是现蕾期的1.12~12.00倍。半枯期,不同器官中黄烷醇含量为0.44~5.68 mg/g,其中鳞茎、茎生根、茎秆、基生根和珠芽的黄烷醇含量较花期的升高,是花期的1.10~3.38倍;叶片中黄烷醇含量在花期和半枯期差异不显著。全枯期,不同器官中黄烷醇含量为0.18~2.35 mg/g,其中,基生根的黄烷醇含量上升至最大值(2.35 mg/g),是半枯期的5.11倍,鳞茎、茎生根、茎秆、叶和珠芽的黄烷醇含量均呈下降趋势,较半枯期的下降了30.19%~88.18%。由此可知,卷丹植株中黄烷醇含量在半枯期积累最多,为12.50 mg/g,其次是花期,为12.16 mg/g。各器官中,花中的黄烷醇含量最多,叶片中的次之,鳞茎中的最少。

不同小写字母表示同一生育期不同器官中的含量在0.05水平差异显著。
从图4可以看出,现蕾期,卷丹不同器官中花色苷含量为0.19~4.29 mg/g,其中叶片中花色苷含量为珠芽的22.58倍,而基生根中未检测到花色苷。花期,不同器官中花色苷含量为0.89~8.01 mg/g,其中,基生根、鳞茎、茎秆、珠芽和花中花色苷含量增加,是现蕾期的2.15~8.17倍,而茎生根和叶片中花色苷含量较现蕾期的分别降低53.9%和46.9%。半枯期,花色苷含量为1.00~9.10 mg/g,叶片、珠芽和花器官中花色苷含量上升,是花期的1.10~3.00倍,而鳞茎、茎秆和基生根的花色苷含量均呈下降趋势,较花期的下降了7.00%~53.00%,茎生根中未检测到花色苷。全枯期,不同器官中花色苷含量为0.40~2.40 mg/g,其中茎生根和茎秆中花色苷含量显著升高,而鳞茎、叶和珠芽的花色苷含量均显著下降,较半枯期降低了41.98%~91.80%,基生根的花色苷含量在半枯期和全枯期无显著差异。

不同小写字母表示同一生育期不同器官的含量在0.05水平差异显著。
综上所述,在卷丹植株的整个生育期,半枯期花色苷积累最多,为23.17 mg/g,其次是花期,为19.62 mg/g。花中的花色苷最多,叶片中的次之,茎生根的最少。
2.2 不同生育期卷丹各器官多酚提取液的抗氧化活性
不同生育期卷丹各器官多酚提取液均具有一定的抗氧化能力。其中,基生根、鳞茎、茎生根在半枯期达最大值,叶片、珠芽和花在花期达最大值,茎秆在全枯期达最大值。
如图5所示,现蕾期,不同器官总酚提取液对DPPH的清除力为20.84~23.91 µmol/g,其中花对DPPH的清除力是珠芽的1.15倍。花期,不同器官总酚提取液对DPPH的清除力为21.15~21.95 µmol/g,除花外,其他器官对DPPH的清除力均有所提高,较现蕾期的提高了0.64%~2.71%,而花对DPPH的清除力较现蕾期的显著下降了10.37%。半枯期,不同器官对DPPH的清除力为21.07~22.05 µmol/g,其中叶片、基生根和花的清除力升高,较花期的提高了0.14%~0.46%,鳞茎、茎生根、茎秆和珠芽的较花期的下降了0.04%~1.92%。全枯期,卷丹不同器官对DPPH的清除力为20.93~21.97 µmol/g,其中茎生根、茎秆和珠芽对DPPH的清除力提升,较半枯期的提高了0.33%~2.00%,鳞茎、基生根、叶片和花在全枯期对DPPH的清除力较半枯期的下降了0.05%~3.22%。

不同小写字母表示同一生育期各器官对DPPH的清除力在0.05水平差异显著。
由图6可知,现蕾期,卷丹不同器官还原铜离子的能力为0.64~4.63 µmol/g,其中叶片还原铜离子的能力是珠芽的7.23倍。花期,不同器官对铜离子的还原力为1.60~14.19 µmol/g,除基生根外,其他器官对铜离子的还原力均有所提高,是现蕾期的1.10~3.45倍,而基生根对铜离子的还原力较现蕾期的下降了18.11%。半枯期,不同器官对铜离子的还原力为1.46~7.17 µmol/g,鳞茎和基生根对铜离子的还原力升高,较花期的分别提高了12.89%和23.08%,茎生根、茎秆、叶、珠芽和花对铜离子的还原力均下降,较现蕾期的下降了1.99%~49.47%。全枯期,不同器官对铜离子的还原力为1.26~4.10 mol/g,除茎秆外,其他器官对铜离子的还原力均下降,较半枯期的下降了11.72%~72.33%,而茎秆对铜离子的还原力是半枯期的2.08倍。
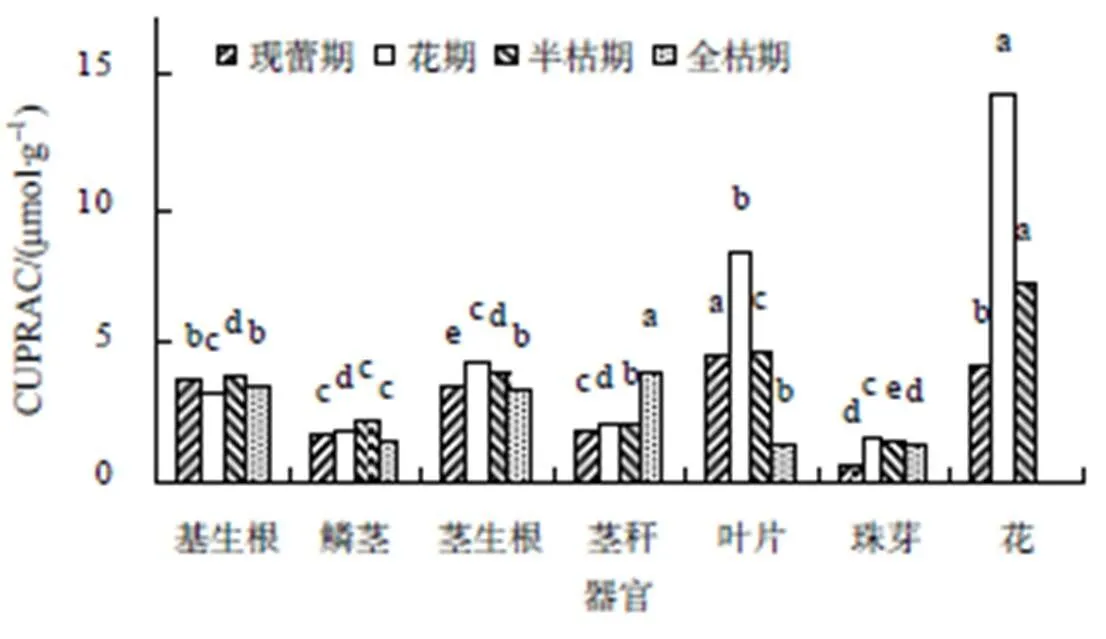
不同小写字母表示同一生育期不同器官的还原力在0.05水平差异显著。
由图7可知,现蕾期,不同器官的金属螯合能力为24.67%~57.84%,其中花的金属螯合能力是基生根的2.34倍。花期,不同器官的金属螯合能力为22.58%~54.33%,其中茎生根和珠芽的金属螯合能力上升,较现蕾期的提高了47.19%和101.52%,鳞茎、茎秆、叶、基生根和花的金属螯合能力下降,较现蕾期的下降了1.58%~31.66%。半枯期,不同器官的金属螯合能力为30.27%~54.40%,基生根、鳞茎、茎生根和茎秆的金属螯合能力升高,较花期的提高了27.81%~ 111.82%,叶、珠芽和花的金属螯合能力呈下降趋势,较花期的下降了10.04%~ 23.40%。全枯期,不同器官的金属螯合能力为27.44%~56.49%,其中鳞茎和茎秆的金属螯合能力升高,较半枯期的提高了3.84%和12.36%,而茎生根、叶、基生根和珠芽的金属螯合能力下降,较现蕾期的下降了9.35%~ 25.97%。

不同小写字母表示同一生育期不同器官的金属螯合能力在0.05水平差异显著。
如图8所示,现蕾期,卷丹不同器官抑制脂质过氧化能力为45.74%~80.64%,茎秆抑制脂质过氧化能力是叶片的1.76倍。花期,不同器官抑制脂质过氧化能力为64.21%~81.64%,其中,基生根、鳞茎、叶、珠芽和花抑制脂质过氧化能力升高,较现蕾期的提高了0.55%~60.80%,茎生根和茎秆抑制脂质过氧化能力下降,较现蕾期的下降了8.52%和8.23%。半枯期,不同器官抑制脂质过氧化能力为51.04%~75.86%,其中,鳞茎和叶片抑制脂质过氧化能力升高,较花期的分别提高了10.20%和3.14%,基生根、茎生根、茎秆、珠芽和花的均下降,较花期的下降了4.36%~31.03%。全枯期,卷丹不同器官抑制脂质过氧化能力为58.34%~77.64%,基生根、茎生根、茎秆和叶抑制脂质过氧化能力均上升,较半枯期的提高了1.54%~52.12%,鳞茎和珠芽的均下降,较现蕾期的下降了21.43%和6.15%。综上所述,卷丹植株的抗氧化能力在花期最强,其次是半枯期;花的抗氧化能力最强,鳞茎的次之,珠芽的最差。

不同小写字母表示同一生育期不同器官的抑制脂质过氧化活性在0.05水平差异显著。
2.3 卷丹多酚类物质与抗氧化活性的相关性
如表1所示,卷丹不同器官多酚类物质含量与抗氧化活性之间存在相关性,其中基生根中总花色苷、茎秆中总酚和珠芽中总黄烷醇与抗氧化活性之间存在显著相关性(<0.05);花中的总黄烷醇和珠芽中的总酚与抗氧化活性之间存在极显著相关性(<0.01),相关系数分别达到-1.00和1.00;鳞茎、茎生根和叶片中多酚类物质含量与抗氧化活性之间的相关性均未达到显著水平。

表1 卷丹不同器官的多酚类物质与抗氧化能力的相关系数
“*”“**”分别表示显著相关(< 0.05)、极显著相关(< 0.01)。
通过对整个生育期卷丹多酚类物质与抗氧化活性的相关性(表2)进行分析可知,在现蕾期总酚含量与铜离子还原力呈显著正相关;花期和半枯期总酚含量与铜离子还原力呈极显著正相关,总黄酮和总花色苷与铜离子还原力则呈显著或极显著正相关;花期总黄烷醇与铜离子还原力呈显著正相关。全枯期各酚类物质与抗氧化活性的相关性均不显著。

表2 不同生育时期卷丹的多酚类物质与抗氧化能力的相关性
“*”“**”分别表示显著相关(< 0.05)、极显著相关(< 0.01)。
3 结论与讨论
本研究对卷丹发育过程中多酚积累规律及其抗氧化活性变化进行了研究。结果表明:多酚类物质分布于卷丹整个植株中,且不同生育期不同器官的多酚含量及其抗氧化能力差异显著;卷丹植株中除基生根以外,其他器官的多酚含量均在花期积累最多,半枯期多酚含量显著降低。究其原因可能与半枯期地上部各器官逐渐衰老、多酚类物质的合成减慢有关;另一方面,此时鳞茎处于充实期,可能存在活性成分向地下部鳞茎的运输。整个生育期卷丹不同器官总酚含量为1.26~14.75 mg/g,这表明多酚在不同器官的含量差异较大,这可能与各器官形成时期、体内运输方式及所处环境不同有关,其中花期花中总酚含量最多,高达14.75 mg/g,叶片次之,珠芽最少,这与陈越[26]的研究结果一致。本研究中,叶片中总黄酮含量最多,花中的次之,珠芽中的最少,与李章念[27]的研究结果有差异,可能是因为生长环境不同,卷丹各器官生育进程不一致,导致对黄酮物质的积累也不一致。
测定体外抗氧化能力的方法不同,其反应机理也不同[28]。为了评价体系的系统性、合理性和稳定性,本研究通过检测清除DPPH自由基活性、铜离子还原能力、金属螯合能力以及抑制脂质过氧化活性4个指标,对供试材料进行系统的抗氧化能力分析,发现4个检测指标均能证明卷丹各器官多酚提取物具有良好的抗氧化能力,但不同生育期卷丹不同器官的抗氧化能力略有不同,基生根、鳞茎、茎生根在半枯期达最大值,叶片、珠芽和花在花期达最大值,茎秆在全枯期达最大值。花的抗氧化能力最强,其次是鳞茎,珠芽最差,这一结果也更加证实了鳞茎和花作为药食兼用器官的准确性,同时也为卷丹植株的综合利用和优质栽培技术提供理论支撑。
相关性分析发现,卷丹在花期和半枯期,多酚类物质和抗氧化活性间存在显著或极显著的正相关,这表明卷丹植株在花期和半枯期抗氧化能力随着多酚类物质的积累而不断增强,其中总酚和总黄酮含量与铜离子还原能力达到极显著水平,这与阎林茂[29]的研究结果基本一致。
通过多酚类物质积累规律及抗氧化活性变化分析,卷丹的理论采收期为花期,此时多酚类物质积累最多,抗氧化能力最强。但此时的鳞茎质量较小,考虑到种植的经济效益,最适采收期应为半枯期,这与李红娟[6]研究的最适采收期为地上部完全枯黄有一定差距,主要原因是李红娟的研究对象只是鳞茎,在全枯期,地上部器官中活性成分回流,鳞茎营养物质增多。而本研究以卷丹植株为研究对象,目的是为了探索卷丹植株的综合利用;其次,卷丹栽培方式和生长环境不同,也是造成与前人研究差异的原因之一。
[1] 国家药典委员会.中国药典四部[M].北京:中国医药科技出版社,2015:70-180. CHINESE P C.Chinese Pharmacopoeia(Volume Ⅳ)[M]. Beijing:China Medical Science Press,2015:70-180.
[2] 赵秀玲.百合的营养成分与保健作用[J].中国野生植物资源,2010,29(1):44-46. ZHAO X L.The nutritive ingredients of lily and the function of health[J].Chinese Wild Plant Resources,2010,29(1):44-46.
[3] YOU X J,XIE C Y,LIU K L,et al.Isolation of non- starch polysaccharides from bulb of tiger lily(Thunb.) with fermentation of[J].Carbohydrate Polymers,2010,81(1):35-40.
[4] MIMAKI Y,SASHIDA Y.Steroidal saponins and alkaloids from the bulbs ofvar.[J]. Chemical & Pharmaceutical Bulletin,1990,38(11):3055-3059.
[5] 唐明.百合多糖的提取、纯化及抑菌活性研究[D].长沙:湖南农业大学,2010. TANG M.Research on extraction,purification and bacteriostatic activity of polysaccharides in[D]. Changsha:Hunan Agricultural University,2010.
[6] 李红娟.卷丹百合营养成分、活性物质及栽培特性的研究[D].杨凌:西北农林科技大学,2007. LI H J.Study on the nutrients,bioactive materials and cultivation characteristics ofThunb[D]. Yangling,China:Northwest A&F University,2007.
[7] 雷蒙蒙.卷丹百合的药理作用研究进展[J].职业与健康,2018,34(3):429-432. LEI M M.Research progress on pharmacological action ofThunb[J].Occupation and Health,2018,34(3):429-432.
[8] 刘春延,赵博,张国财,等.富硒黑木耳硒多糖超声-微波提取工艺优化及其抗氧化活性[J].湖南农业大学学报(自然科学版),2016,42(4):435-440. LIU C Y,ZHAO B,ZHANG G C,et al.Process optimization on extracting of selenium polysaccharides with ultrasonic and microwave method from selenium- enrichedand its antioxidant activity[J].Journal of Hunan Agricultural University (Natural Sciences),2016,42(4):435-440.
[9] 袁野,朱仕豪,凌志辉,等.瓜蒌皮多酚纯化工艺及抗氧化活性[J].湖南农业大学学报(自然科学版),2019,45(4):420-424. YUAN Y,ZHU S H,LING Z H,et al.The purification process and antioxidant activity of polyphenols from the pericarpium trichosanthis[J].Journal of Hunan Agricultural University(Natural Sciences),2019,45(4):420-424.
[10] 周丹蓉,方智振,叶新福,等.李果实中多酚含量及其抗氧化能力研究[J].园艺学报,2017,44(3):422-430. ZHOU D R,FANG Z Z,YE X F,et al.Concentration and antioxidant capacity of polyphenol from plum cultivars[J].Acta Horticulturae Sinica,2017,44(3):422-430.
[11] DHIMAN M R,PARKASH C,SINDHU S S,et al. Determination of total phenolics and antioxidant content in lily bulb extracts[J].Journal of Ornamental Horticulture,2017,20(1/2):80-85.
[12] JIN L,ZHANG Y L,YAN L M,et al.Phenolic compounds and antioxidant activity of bulb extracts of sixspecies native to China[J].Molecules,2012,17(8):9361-9378.
[13] 靳磊,张延龙,牛立新,等.3种百合鳞茎中多酚类物质的抗氧化活性分析[J].西北植物学报,2014,34(5):995-1001. JIN L,ZHANG Y L,NIU L X,et al.Antioxidant activity of polyphenolic compounds in bulbs of threespecies[J].Acta Botanica Boreali-Occidentalia Sinica,2014,34(5):995-1001.
[14] 靳磊,刘师源,张萍.秦巴山区野生百合体外抗氧化特性的研究[J].食品工业科技,2015,36(22):137-142. JIN L,LIU S Y,ZHANG P.Antioxidant property of wildspecies from Qin-ba mountain[J].Science and Technology of Food Industry,2015,36(22):137-142.
[15] JIN L,ZHANG Y L,LIANG Z X,et al.Phenolic compounds and antioxidant properties of bulb extracts of(Baker) Baker native to China[J]. Quality Assurance and Safety of Crops & Foods,2015,7(2):141-151.
[16] GUO H F,ZHANG Y L,NIU L X,et al.Phenolic Compounds and antioxidant property of petal extracts of sixspecies native to China[J].Asian Journal of Chemistry,2014,26(18):6167-6175.
[17] 郭鸿飞.野生百合花色素组成及酚类物质抗氧化能力研究[D].杨凌:西北农林科技大学,2014. GUO H F.Study on pigments composition of petals and phenolic compounds and antioxidant activity of petal extracts of wild[D].Yangling,China:Northwest A&F University,2014.
[18] SINGLETON V L,ORTHOFER R,LAMUELA- RAVENTÓS R M.Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagent[M]//Packer L.Oxidants and Antioxidants Part A.Amsterdam:Elsevier,1999:152-178.
[19] CHANG C C,YANG M H,WEN H M,et al. Estimation of total flavonoid content in propolis by two complementary colometric methods[J].Journal of Food and Drug Analysis,2002,10(3):178-182.
[20] ROCKENBACH I I,GONZAGA L V,RIZELIO V M,et al.Phenolic compounds and antioxidant activity of seed and skin extracts of red grape(and) pomace from Brazilian winemaking[J].Food Research International,2011,44(4):897-901.
[21] ORAK H H.Total antioxidant activities,phenolics,anthocyanins,polyphenoloxidase activities of selected red grape cultivars and their correlations[J].Scientia Horticulturae,2007,111(3):235-241.
[22] BRAND-WILLIAMS W,CUVELIER M E,BERSET C.Use of a free radical method to evaluate antioxidant activity[J].LWT-Food Science and Technology,1995,28(1):25-30.
[23] APAK R,GÜÇLÜ K,OZYÜREK M,et al.Novel total antioxidant capacity index for dietary polyphenols and vitamins C and E,using their cupric ion reducing capability in the presence of neocuproine:CUPRAC method[J].Journal of Agricultural and Food Chemistry,2004,52(26):7970-7981.
[24] GULCIN İ,BUYUKOKUROGLU M E,KUFREVIOGLU O I.Metal chelating and hydrogen peroxide scavenging effects of melatonin[J].Journal of Pineal Research,2003,34(4):278-281.
[25] TSUDA T,WATANABE M,OHSHIMA K,et al. Antioxidative activity of the anthocyanin pigments cyanidin 3-O-.beta.-D-glucoside and cyanidin[J]. Journal of Agricultural and Food Chemistry,1994,42(11):2407- 2410.
[26] 陈越.卷丹百合不同发育期活性物质含量变化规律的研究[D].长春:吉林农业大学,2016.CHEN Y.Research of the change law of bioactive materials content in different periods ofthunb[D].Changchun:Jilin Agricultural University,2016.
[27] 李章念.两种食用百合中黄酮类物质研究[D].杨凌:西北农林科技大学,2007. LI Z N.The study of flavone in two edible[D]. Yangling,China:Northwest A & F University,2007.
[28] KOMES D,ULRICH D,GANIC K K,et al.Study of phenolic and volatile composition of white wine during fermentation and a short time of storage[J].Vitis-Journal of Grapevine Research,2007,46(2):77-84.
[29] 阎林茂.东方百合施肥效应及其花瓣抗氧化性研究[D].杨凌:西北农林科技大学,2012. YAN L M.Research on the effect of fertilization on the oriental lily and antioxidant of extracts from the petals[D]. Yangling,China:Northwest A&F University,2012.
Polyphenol accumulation characteristics and antioxidant activity ofat different growth stages
WANG Yunxia, ZHANG Ping, GE Beilei, YA Rong, ZHANG Ruijun, JIN Lei*
(School of Agriculture, Ningxia University, Yinchuan, Ningxia 750021, China)
To study the polyphenol accumulation and its antioxidant ability in different organs during different growth period in, we employed a group of methods, including Foling Shoka method, NaNO2-AlCl3, vanillin colorimetric method and pH differential method have determined the polyphenol, flavonoids, flavonols, chromosides in different organs at different growing stage. The antioxidant capacity of total polyphenol extracts were analyzed by DPPH method, copper ion reduction method, metal chelating ability and inhibiting lipid peroxidation activity. The results showed that the content and antioxidant ability of polyphenols in various organs ofwere different (<0.05). In the flowering period, the total polyphenol content was at the peak, followed by the semi-dry season, with the lowest content in the total dry season. During flowering, the total phenolicl content reached 14.75 mg/g, and the leaf is 12.19 mg/g, and the lowest bud is only 3.12 mg/g. The antioxidant capacity of polyphenol extract was the largest in flowering period, followed by half-dry period. The correlation analysis showed that there was a significant or very significant positive or negative correlation between the polyphenols and their antioxidant activities in the studied organs and periods, with the correlation coefficient between -1.00 and 1.00. The results can provide the basis for high quality cultivation, timely harvest and reasonable utilization of
; growth stage; organ; total polyphenol accumulation; antioxidant activities
S682.1
A
1007-1032(2020)05-0565-09
王云霞,张萍,葛蓓蕾,雅蓉,张瑞军,靳磊.不同生育期卷丹百合的多酚积累特性及其抗氧化活性[J].湖南农业大学学报(自然科学版),2020,46(5):565-573.
WANG Y X, ZHANG P, GE B L, YA R, ZHANG R J, JIN L. Polyphenol accumulation characteristics and antioxidant activity ofat different growth stages[J]. Journal of Hunan Agricultural University(Natural Sciences), 2020, 46(5): 565-573.
http://xb.hunau.edu.cn

2019–10–08
2019–11–11
教育部春晖计划科研项目(2017)
王云霞(1995—),女,宁夏隆德人,硕士研究生,主要从事百合活性物质的研究,wyx102458@163.com;*通信作者,靳磊,博士,副教授,主要从事百合活性物质的研究,jinleinxu@163.com
责任编辑:毛友纯
英文编辑:柳正

