不同水分环境下玉米叶形相关性状与SSR标记的关联分析*
钟 源, 赵小强, 李文丽
不同水分环境下玉米叶形相关性状与SSR标记的关联分析*
钟 源, 赵小强**, 李文丽
(甘肃农业大学甘肃省干旱生境作物学重点实验室 兰州 730070)
玉米的叶形结构与其抗旱性紧密相关, 挖掘不同水分环境下调控玉米叶形相关性状的显著关联分子标记位点, 可为揭示玉米叶形结构的分子遗传机理、克隆相关调控基因并进行抗旱理想株型育种提供参考。本研究在不同水分环境下分析187份玉米自交系叶长、叶宽、叶夹角、叶向值、叶面积、叶形系数及叶片卷曲度等7个叶形相关性状的变化, 采用SSR标记对这些材料进行全基因组扫描并分析其遗传多样性, 采用一般线性模型(GLM)寻找不同水分环境下与玉米7个叶形相关性状关联的分子标记。结果表明: 1)干旱环境下187份玉米自交系的叶长、叶宽、叶夹角、叶面积均显著降低, 而叶向值、叶形系数及叶片卷曲度均明显升高, 且干旱环境下这7个叶形相关性状的变异比率为30.53%~198.31%。2)145对SSR标记共检测出652个等位变异, 变异范围在2~13个; 多态性信息量(PIC)变异范围为0.201~0.966, 平均0.478。采用UPGMA聚类及群体遗传结构分析均将供试材料分为旅大红骨(LRC)、唐四平头(TSPT)、兰卡斯特(Lan)、P及瑞德(Reid)等5大类群。3)采用GLM模型, 在不同水分环境下共检测到15个SSR标记与玉米的7个叶形相关性状在<0.01水平下关联, 各标记对表型的解释率为2.25%~27.30%, 72.97%的标记可在干旱环境下被检测到; 其中umc1124、umc2363、umc2214、umc1742、phi331888、umc1378、bnlg1863、umc2134和umc1345标记同时与不同水分环境下的多个叶形相关性状连锁, 表现出明显的“一因多效”现象。这些研究结果将为玉米叶形结构的遗传改良及抗旱理想株型分子标记辅助选择育种提供参考。
玉米; 叶形结构; 干旱; 遗传结构; 关联分析
玉米()是集粮食、饲料及生物质能源为一体的多用途C4作物, 其在稳定国家粮食安全、促进畜牧业发展及改善人民生活水平等方面扮演着重要角色。干旱是限制玉米增产、稳产最为重要的非生物逆境胁迫因素之一。Zhao等[1]报道, 近30 a来干旱导致全球玉米减产39.3%。因此, 提高玉米的抗旱性并培育优良抗旱新品种是解决玉米安全生产的有效育种策略。叶片不仅是玉米进行光合作用的重要组织源, 而且是玉米感知干旱、温度等外界压力信号及与环境进行水分、气体交换的重要器官[2-5], 与玉米的产量和品质紧密相关。叶长、叶宽、叶夹角、叶向值、叶面积、叶形系数及叶片卷曲度等玉米叶形结构是属于多个微效基因共同调控的典型数量遗传性状, 受环境效应的影响较大[6]。Zhao等[1]、Zhao等[2]、Ribaut等[7]、Bennetzen等[8]和赵小强等[9]研究揭示, 干旱缺水时不同株型玉米的叶形结构、气孔形态、叶片的各种生理代谢及光合特性均会发生适应性的改变, 其叶长、叶宽、叶夹角及叶面积均显著减小, 叶形系数和叶向值均会显著增大; 叶片上/下表皮气孔个数会增多, 气孔长度和宽度均会变小; 叶片的叶绿素a、b、a+b含量及叶绿素a/b会显著降低, 叶片的气孔导度、净光合速率、叶片温度、蒸腾速率和RuBPCase活性均会明显减小, 胞间CO2浓度会明显升高, 玉米的这些叶形结构的适应性变化共同构成了玉米的株型抗旱机制。
近年来, 数量遗传学家先后开发的加性-显性-母体遗传模型(additive-dominant-maternal effect genetic model, ADM)[3]、混合线性加显模型(mixed additive-dominance model, AD)[10]、主基因+多基因遗传模型(major genes plus polygenes genetic model, MG+PG)[11]、ABC法[10]、Geoffrey分析法[12]及世代分析法[13]等遗传模型与分析方法在玉米叶形相关性状遗传机理研究中得到了广泛应用, 为玉米叶形结构的遗传改良及理想株型育种奠定了坚实的基础。加之借助分子标记技术鉴定不同环境下调控玉米叶形相关性状的基因/QTL (quantitative trait locus)位点, 为深入解析其叶形结构的遗传机制提供了可行的手段。Mickelson等[14]利用B73×Mo17发展了1套RILs (recombinant inbred lines)群体, 通过CIM (composite interval mapping)法在不同生态环境下定位到了10个QTLs与叶夹角相关。Pan等[15]以20份叶形结构差异较大的自交系构建1套含有1 887份家系的ROAM (random-open-parent association mapping)群体, 对玉米的叶长、叶宽、叶夹角、穗上叶片数、穗下叶片数及总叶数等进行了QTL、QTL×E (QTL by environment interaction)及GWAS (genome-wide association study)分析。Ku等[5]通过Yu82×Shen137构建了1套F2∶3群体, 采用CIM法在两种生态环境下检测到了15个调控玉米叶长、叶宽、叶夹角及叶向值的QTLs位点。Zhao等[2]利用Langhuang×TS141和Chang7-2×TS141构建了2套F2和2套F2∶3群体, 采用CIM法在9种不同水分环境下共识别到了29个调控叶夹角、叶向值、叶长、叶宽、叶面积及叶形系数的sQTLs (stable QTLs), 并通过meta分析, 检测到了21个meta-QTLs (mQTLs)和24个调控玉米叶形结构发育的候选基因。甚至, Ku等[4]、郭书磊等[6]和Wang等[16]先后整合了多套不同遗传背景下检测到的玉米叶长、叶宽、叶夹角及叶向值QTLs信息, 通过meta分析分别识别到了17、73和12个相关mQTLs, 并预测到了15、44和7个与玉米叶片发育紧密关联的候选基因。从这些研究不难看出, 通过构建定位群体虽然可以找到一些重要QTLs/基因信息, 但是该方法不仅需要花费大量人力和时间, 且由于构建的定位群体所采用材料的遗传背景、群体结构与大小及QTL定位方法不同, 导致QTL定位结果不尽相同, 严重影响了相关性状的基因克隆及分子标记辅助选择(marker-assisted selection, MAS)育种的应用。
基于连锁不平衡作图(linkage disequilibrium, LD)的关联分析法(association analysis), 是通过对供试群体候选基因的分子标记进行扫描或检测, 进而确定相应群体不同遗传材料间所携带的等位基因位点信息并分析等位基因对目标性状贡献大小的一种方法[17]。该方法作为数量遗传性状研究中的重要补充方法, 已被广泛应用到玉米[18]、小麦()[19]及水稻()[20]等作物重要数量遗传性状等位基因位点挖掘中。基于以上考虑, 本研究采用SSR (simple sequence repeats)标记技术揭示了187份不同玉米自交系的遗传多样性, 在不同水分环境处理下通过对这些自交系的叶长、叶宽、叶夹角、叶向值、叶面积、叶形系数及叶片卷曲度等叶形相关性状进行了田间鉴定, 并采用关联分析法定位不同水分环境下与玉米叶形相关性状紧密连锁的SSR标记, 以期为玉米叶形相关抗旱优良新品种的MAS育种提供参考。
1 材料与方法
1.1 试验材料
以黄早四(来源于四平头杂株)、B73(来源于BSSSC5)、丹340(来源于旅9×有稃玉米的杂交)、齐319(选自美国杂交种P78799)、Mo17(来源于C103×C1187-2)、掖478(来源于沈5003×U8112)等6份玉米杂种优势划分标准测验种在内的84份国内核心玉米种质及本试验自育的103份玉米自交系为试材。这些材料均由甘肃省干旱生境作物学重点实验室-分子标记辅助选育实验室提供。
1.2 试验方法
1.2.1 田间玉米自交系叶形结构鉴定
试验于2017年4月中旬至9月下旬在甘肃省农业科学院黄羊麦类作物育种试验站(37.97ºN, 102.63ºE, 海拔1 508 m)进行。试验均设正常供水(CK, 玉米全生育期内只要降水不足就及时供水)及干旱胁迫处理(DS, 玉米大喇叭口前期至花期结束不供水, 其他生育时期每隔20 d供水1次)[21-23]。每一处理均采用完全随机区组设计, 3次重复。每一自交系设单行区, 行长5 m, 株距25 cm, 行距40 cm。播前于2017年3月统一整地、施肥并采用平膜覆盖试验地, 其他管理同一般大田。2017年该试验地玉米生育期(4—9月)内月平均气温为17.8 ℃, 总降水量为169.6 mm。花后第10 d从每一处理相应自交系中选择长势整体一致的10株, 并参照Zhao等[2]和赵小强等[24]方法测定其棒三叶的叶长(leaf length, LL; 叶基至叶顶端的长度)、叶宽(leaf width, LW; 叶片中间展开宽度)、叶夹角(leaf angle, LA; 叶片与茎秆的锐角角度), 并计算其叶面积(leaf size, LS)、叶向值(leaf orientation value, LOV)、叶形系数(leaf shape coefficient, LSC)及叶片卷曲度(leaf rolling index, LRI), 计算公式为:

[26](2)
[2](3)
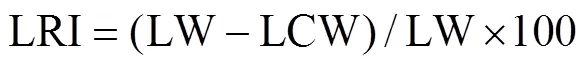
式中: LF (length from beginning of ligule to flagging point of leaf, 叶基至叶最高点的长度)为高点长; LCW (width of a leaf in the middle of natural curl)为叶片中间自然卷曲状态下的宽度;为3, 代表测定叶片数。
1.2.2 SSR标记分析
采用CTAB法[28]提取从田间剪取的五叶期玉米幼苗的全基因组DNA, 并用1%的琼脂糖凝胶电泳检测DNA质量, 紫外分光光度计检测DNA浓度并稀释至50 ng∙μL−1, −20 ℃低温保存备试验所需。从MaizeGDB (Maize Genome Database)数据库网站(http://www.maizegdb.org/)中选取均匀分布于玉米10个连锁群多态性较好的SSR标记145对, 并参照钟源等[28]的方法进行PCR扩增、聚丙烯酰胺凝胶电泳及银染。
1.3 数据统计分析
田间不同水分环境处理下测定的187份玉米自交系的叶形相关性状数据均采用统计软件IBM SPSS 19.0 (SPSS Inc., Chicago, IL, USA)进行描述性统计分析、联合方差分析及Pearson相关分析。SSR扩增产物构建0、1矩阵, 并以A、B、C等不同大写字母记录基因型。SSR位点的多态性信息量(polymorphism information content value, PIC)按以下公式计算:

2 结果与分析
2.1 不同水分环境下参试玉米自交系叶形相关性状的表型鉴定
在正常供水下, 187份玉米自交系的7个叶形相关性状的变异系数介于13.21%(叶宽)~59.23%(叶片卷曲度); 而干旱胁迫处理下, 这些玉米自交系的7个叶形相关性状的变异系数介于9.62%(叶长)~ 28.22%(叶夹角)(表1)。说明玉米自交系的7个叶形相关性状在不同水分处理下均存在丰富的遗传变异。方差分析表明, 187份玉米自交系的7个叶形相关性状在自交系间均达到<0.01或<0.05水平差异显著(表2)。说明玉米的这些叶形结构受自交系自身遗传特性的调控, 因此, 育种中可以重点改良玉米的这些叶形结构, 进而达到改良玉米株型的目的。这7个叶形相关性状在水分处理间及自交系与水分处理互作间差异均极显著(<0.01)或显著(<0.05), 且在干旱胁迫处理下, 这些玉米自交系的叶长、叶宽、叶夹角、叶面积均显著降低, 而叶向值、叶形系数及叶片卷曲度均显著增大, 且这7个叶形相关性状的变异比率介于30.53%(叶片卷曲度)~198.31%(叶夹角)(表1和表2)。表明玉米为了避免水分环境对其造成的伤害, 植株的叶长、叶宽、叶夹角、叶向值、叶面积、叶形系数及叶片卷曲度等叶形结构明显地发生适应性的改变, 且这些性状还显著受基因型与环境互作效应的共同调控。此外, 在两种水分环境下, 187份玉米自交系7个叶形相关性状的偏度和峰度均基本介于−1.0~1.0(表1)。表明玉米的这些叶形相关性状呈典型的数量遗传特性, 因此可以对其进行QTL定位或关联分析。
2.2 参试玉米自交系叶形相关性状的相关性分析
187份玉米自交系的7个叶形相关性状间Pearson相关分析结果(表3)表明, 叶长与叶面积、叶形系数及叶宽间均极显著正相关(<0.01), 与叶夹角、叶向值及叶片卷曲度间均显著负相关(<0.05); 叶宽与叶面积间极显著正相关, 与叶形系数、叶片卷曲度、叶夹角及叶向值间极显著(<0.01)或显著(<0.05)负相关; 叶夹角与叶向值、叶面积及叶形系数间均极显著(<0.01)或显著(<0.05)负相关; 叶向值与叶面积间极显著负相关(<0.01); 叶面积与叶形系数和叶片卷曲度间显著负相关; 叶形系数与叶片卷曲度间显著(<0.05)正相关(表3)。说明玉米的这些叶形相关性状间彼此关联, 其相互协同或抑制作用共同建成了不同玉米自交系特定的叶形结构。
2.3 参试玉米自交系的SSR标记遗传多样性分析
选择均匀分布于玉米10个连锁群的145对SSR标记对187份玉米自交系进行了全基因组扫描, 共检测出了652个等位基因, 每对SSR标记检测出了2~13个, 平均为4.50个, 其中位于Bin 3.05处的标记phi073的等位基因最多检测出了13个, 而等位基因变异最少的是位于Bin 1.05处的umc2025等13个标记, 均为2个等位基因(表4)。每对SSR标记的多态性信息量(PIC)的变异范围介于0.200~0.966, 平均为0.478。其中标记umc1278 (Bin 1.07)的PIC最大, 而标记bnlg1877 (Bin 10.07)的PIC最小(表4)。进一步利用遗传相似系数(GS)和UPGMA分析, 参试所有玉米自交系的GS变异范围为0.610~1.000, 并在GS在0.612时可将187份玉米自交系明显划分为5大类群, 即包含丹340等25份材料的旅大红骨类群(LRC)、黄早四为代表的唐四平头类群(TSPT)为34份材料、Mo17在内的28份兰卡斯特类群(Lan)材料、包括齐319等38份材料的P群(P)及B73与掖478等62份材料聚成的瑞德类群(Reid)材料(表5)。
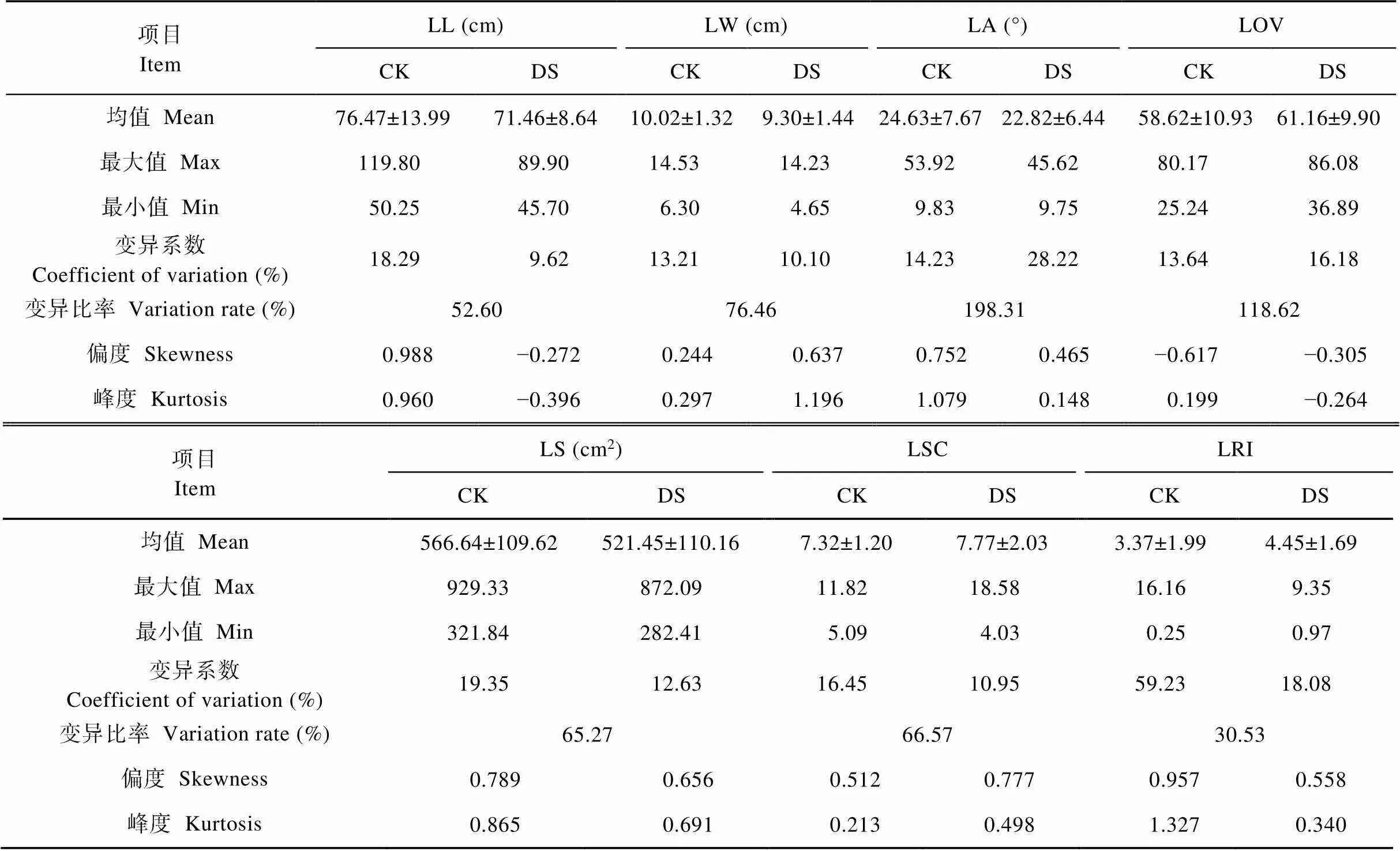
表1 不同水分环境下187份玉米自交系叶形相关性状的表型值
LL: 叶长; LW: 叶宽; LA: 叶夹角; LOV: 叶向值; LS: 叶面积; LSC: 叶形系数; LRI: 叶片卷曲度; CK: 正常供水处理; DS: 干旱胁迫处理。LL: leaf length; LW: leaf width; LA: leaf angle; LOV: leaf orientation value; LS: leaf size; LSC: leaf shape coefficient; LRI: leaf rolling index; CK: normal water treatment; DS: drought stress treatment.

表2 不同水分环境下187份玉米自交系叶形相关性状的方差分析(F值)
*或**分别代表<0.05或<0.01水平差异显著。LL: 叶长; LW: 叶宽; LA: 叶夹角; LOV: 叶向值; LS: 叶面积; LSC: 叶形系数; LRI: 叶片卷曲度。* or ** indicate significant difference at<0.05 or<0.01 levels, respectively. LL: leaf length; LW: leaf width; LA: leaf angle; LOV: leaf orientation value; LS: leaf size; LSC: leaf shape coefficient; LRI: leaf rolling index.

表3 187份玉米自交系叶形相关性状的相关分析
*或**分别代表<0.05或<0.01水平显著相关。LL: 叶长; LW: 叶宽; LA: 叶夹角; LOV: 叶向值; LS: 叶面积; LSC: 叶形系数; LRI: 叶片卷曲度。* or ** indicate significant correlation at<0.05 or<0.01 levels, respectively. LL: leaf length; LW: leaf width; LA: leaf angle; LOV: leaf orientation value; LS: leaf size; LSC: leaf shape coefficient; LRI: leaf rolling index.
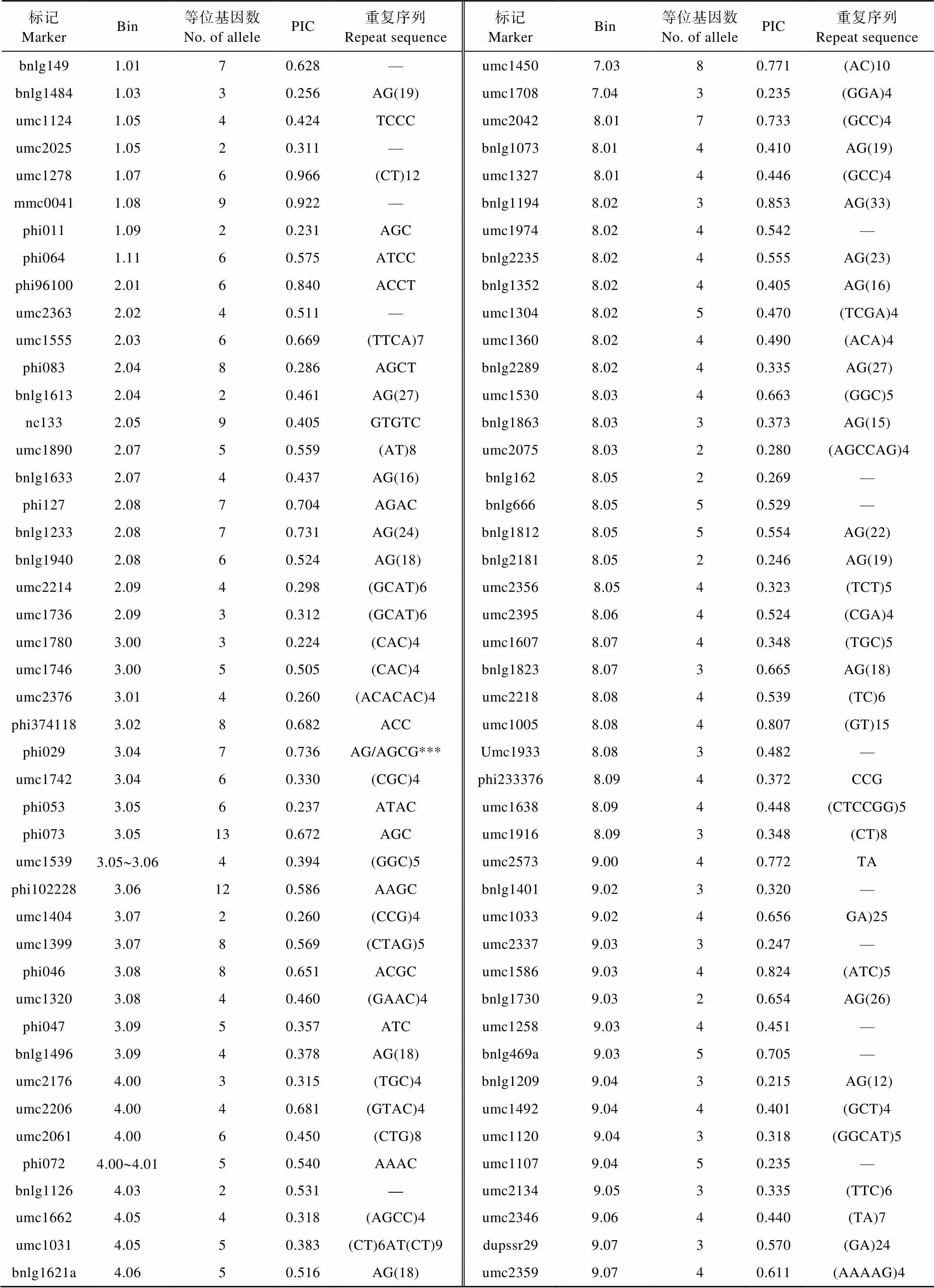
表4 145对SSR标记在187份玉米自交系中检测到的等位基因数及多态性信息量(PIC)
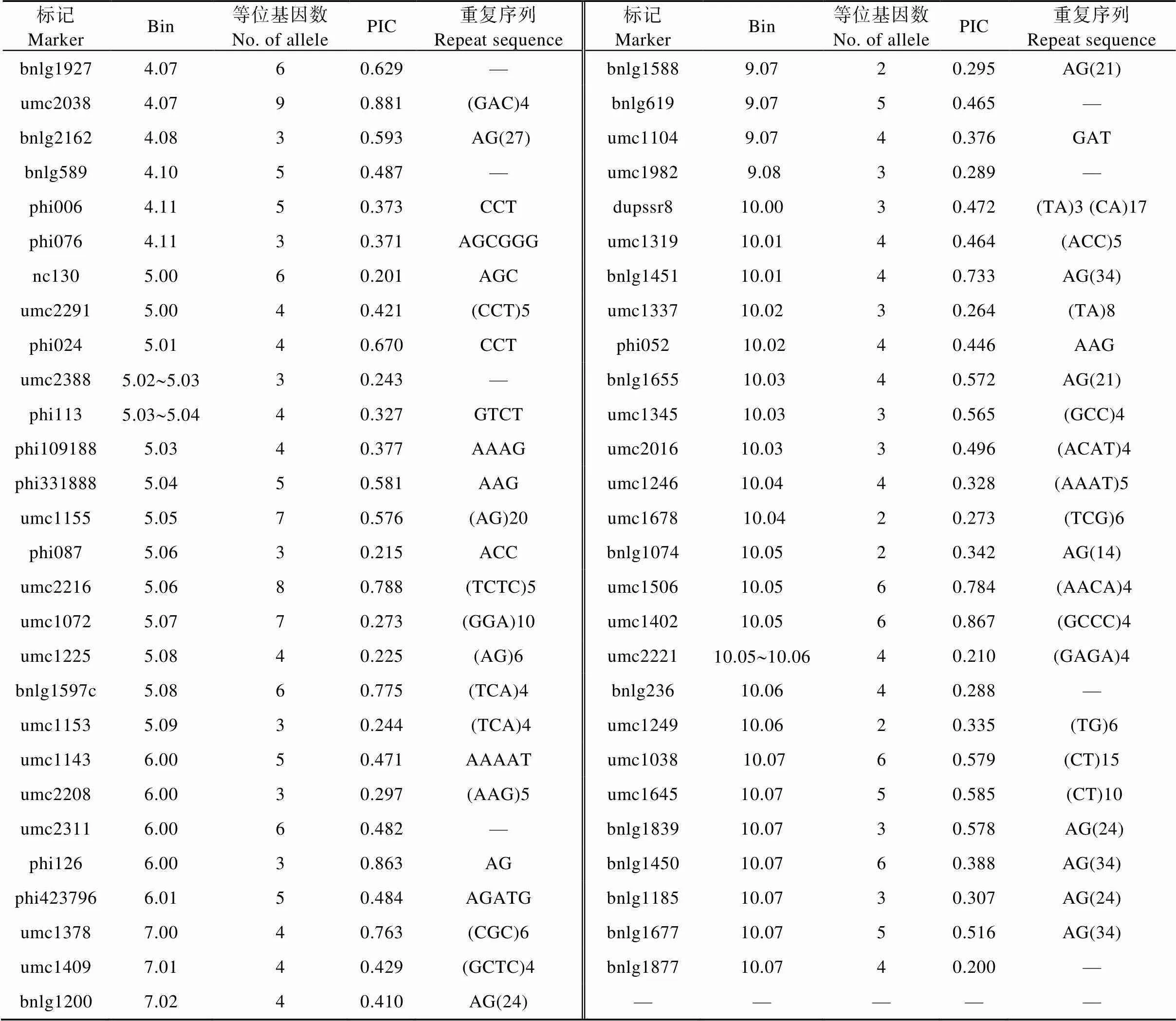
续表4
***为不确定碱基; —为缺失。*** means uncertain base; — means missing.
2.4 参试玉米自交系群体的遗传结构分析
利用Structure 2.3.1软件对187份玉米自交系进行群体遗传结构和模型聚类分析。结果表明当=1~10时, Δ在=5时出现明显峰值(图1), 因此可以判定187份玉米自交系可划分为5大类群。5大类群的遗传固定指数均>0.05。说明这5大类群均能独立成群。对照代表性自交系可知, 这5大类群分别为LRC(红色)、TSPT(绿色)、Lan(粉色)、P(黄色)及Reid(蓝色)类群等(图2)。这与UPGMA聚类分析大部分材料的分群结果基本一致。
2.5 不同水分环境下玉米叶形相关性状与SSR标记的关联分析
采用一般线性模型(GLM)对SSR标记位点与不同水分环境下玉米7个叶形相关性状进行了关联分析。结果(表6)表明, 共检测到15对SSR标记与不同水分环境下玉米的叶长、叶宽、叶夹角、叶向值、叶面积、叶形系数及叶片卷曲度等叶形相关性状在<0.01水平显著关联。表型变异的解释率介于2.25%(位于Bin 10.03处的标记umc1345与干旱胁迫下的叶形系数相关)~27.30%(位于Bin 1.01处的bnlg149位点与正常供水环境下的叶夹角连锁), 其主要位于第1、2、3、4、5、7、8、9及10号染色体上。除bnlg149 (Bin 1.01)与叶夹角、umc2376 (Bin 3.01)与叶片卷曲度、bnlg1621a (Bin 4.06)与叶宽、umc2356 (Bin 8.05)与叶面积、umc2218 (Bin 8.08)与叶宽及bnlg1451 (Bin 10.01)与叶向值等性状相关外, 其余9对SSR标记均与2~7个叶形相关性状间同时关联。
3 讨论
3.1 干旱胁迫对玉米叶形结构的影响
叶片是玉米进行生命活动的基础, 其主要参与玉米的光合作用、蒸腾作用及玉米对各种逆境胁迫的应答响应中, 最终影响玉米的产量和品质。Zhao等[2]以抗旱性差异较强的3份玉米自交系及其构建的2个F1杂交种、2套F2及2套F2∶3群体在9种不同水分环境下分析发现, 干旱胁迫时这些材料的叶长(2.8%~13.4%)、叶宽(11.0%~26.2%)、叶夹角(13.4%~26.3%)、叶面积(18.3%~36.3%)均显著降低, 而叶向值(4.2%~29.1%)和叶形系数(3.2%~25.1%)均显著升高。张振平等[29]通过对7份抗旱能力不同的玉米品种在中度水分胁迫下研究表明, 玉米的叶片卷曲度和叶片衰老指数与其抗旱性间均呈显著负相关, 叶向值和叶形系数与其抗旱性间达到了显著正相关; 进一步灰色关联度分析揭示, 与叶片卷曲度和叶片衰老指数相比, 叶形系数和叶向值在玉米抗旱性中发挥更为重要的作用。赵小强等[9]研究阐明, 干旱胁迫下玉米通过叶形结构发生的适应性改变, 调节影响叶片的气孔形态、各种生理代谢及光合特性, 以减少植株对太阳辐射的接收、降低植株的叶片温度及蒸腾散失, 提高植株的水分利用效率、改善植株的生理代谢, 最终达到改善玉米抗旱性的目的。本研究也得到了高度一致的结果, 即在花期干旱胁迫处理下, 187份玉米自交系的7个叶形相关性状在水分处理间差异均达极显著水平。说明不同水分环境均会显著影响玉米叶形结构的塑造, 进而影响后期玉米籽粒的发育及产量的形成。进一步分析发现, 与对照正常供水环境相比, 干旱胁迫后187份玉米自交系的叶长、叶宽、叶夹角、叶面积平均降低了6.56%、7.16%、7.32%和7.97%, 而叶向值、叶形系数及叶片卷曲度平均升高了4.34%、6.16%和32.16%, 且干旱胁迫下这7个叶形相关性状的变异比率为30.53%~198.31%。这与赵小强等[9]在玉米、Yang等[27]和Isidro等[30]在小麦、Sohrabi等[31]在水稻、张飞等[32]在高粱()、朱宗河等[33]在油菜()及Masarirambi等[34]在马铃薯()上的研究相类似。因此, 植物的叶形结构与其抗旱性紧密相关, 特别是在玉米上, 以上7个叶形相关性状均可作为玉米抗旱性鉴定的重要参考指标。
表5 187份玉米自交系UPGMA聚类分析
字体加粗的材料为相应杂种优势类群的标准测验种。The bolded materials are the standard test species for the corresponding heterosis groups.
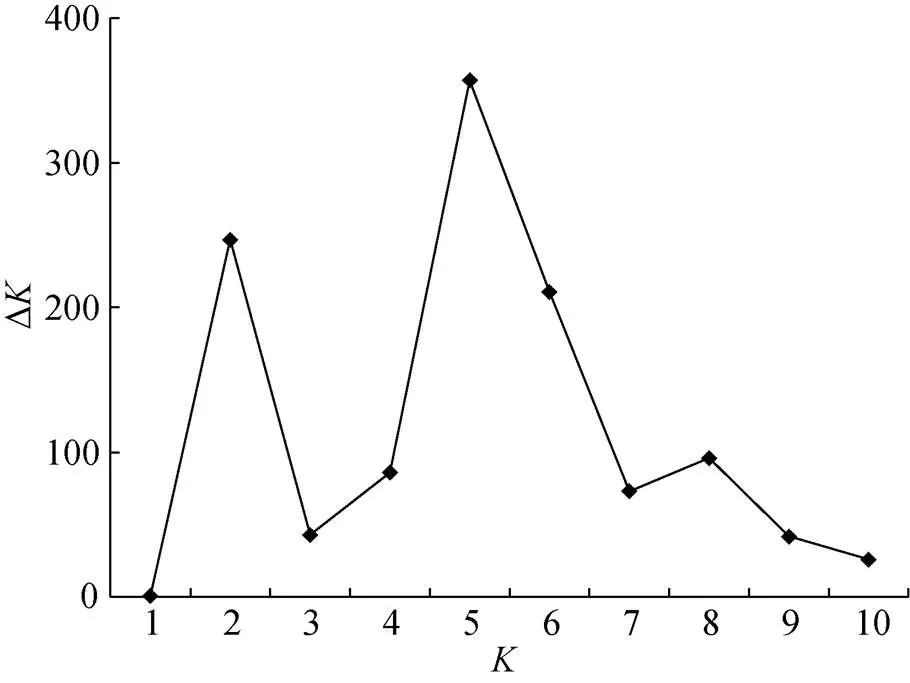
图1 187份玉米自交系的群体遗传结构分析的ΔK值随K值变化曲线
: 群体个数The number of population.

图2 基于SSR标记的187份玉米自交系群体遗传结构
LRC: 旅大红骨类群; TSPT: 唐四平头类群; Lan: 兰卡斯特类群; P: P群; Reid: 瑞德类群; 不同颜色代表不同类群, 颜色多少表示该类群的概率。LRC: luda red cob group; TSPT: tangsipingtou group; Lan: lancaster group; P: P group; Reid: Reid group; Different colors indicate the corresponding groups, areas of colors indicate probability of the corresponding groups.

表6 不同水分环境下与玉米叶形性状相关的SSR标记及其对表型变异的解释率(P<0.01)
LL: 叶长; LW: 叶宽; LA: 叶夹角; LOV: 叶向值; LS: 叶面积; LSC: 叶形系数; LRI: 叶片卷曲度。CK: 正常供水处理; DS: 干旱胁迫处理。LL: leaf length; LW: leaf width; LA: leaf angle; LOV: leaf orientation value; LS: leaf size; LSC: leaf shape coefficient; LRI: leaf rolling index. CK: normal water treatment; DS: drought stress treatment.
3.2 玉米自交系遗传多样性及其叶形相关性状间的变异分析
玉米自交系彼此间的遗传基础狭窄一直是困扰重大突破性玉米优良新品种选育的关键因素之一。因此, 从分子水平及表型上全面剖析玉米自交系间的遗传多样性, 并比较亲本自交系间的亲缘远近, 对于有目的地组配优良杂交组合及选育出优良新品种具有十分重要的指导意义。目前, 国内外学者已运用SSR标记技术对不同来源玉米自交系的遗传多样性及杂种优势类群进行了广泛研究, 认为SSR标记的遗传距离与杂种优势的表现呈显著正相关, 但由于自交系的类型及来源不同导致其杂种优势类群划分结果不尽一致[28,35]。本研究采用均匀分布于玉米10个连锁群的145对SSR标记对国内84份核心自交系及本课题组近年来自育的103份自交系总计187份材料进行了遗传多样性和遗传结构分析, 结果表明, 187份玉米自交系的GS介于0.610~1.000, 并采用UPGMA聚类法当GS在0.612时可将187份玉米自交系明显划分为LRC、TSPT、Lan、P及Reid等5大类群, 且这与本研究采用Structure 2.3.1软件群体遗传结构分析结果基本相一致。Wu等[36]采用MaizeSNP50 BeadChip芯片(包含56 110个SNP标记)也将367份中国玉米育种自交系划分成了LRC、TSPT、Lan、P及Reid等类群。此外, 本研究分析还表明, 187份玉米自交系在2种水分环境下7个叶形相关性状的变异系数介于9.62%~59.23%。说明玉米这187份自交系的遗传多样性较大, 在7个叶形相关性状间均存在丰富的遗传变异。
3.3 玉米自交系叶形相关性状与SSR标记的关联分析
Ingvarsson等[37]指出关联分析可根据作物自然群体(自交系)长期演化过程中积累的重组信息, 进而检测出群体内处于非随机状态的标记或候选基因的变异与目标性状显著性关联的频率, 并能对目标性状基因进行精细定位。与QTL定位相比, 该方法可有效避免作图群体构建过程中费时费力等缺点。因此, 本研究采用GLM模型对2种水分环境下187份玉米自交系的7个叶形相关性状进行了关联分析, 在叶长(5对)、叶宽(6对)、叶夹角(5对)、叶向值(5对)、叶面积(7对)、叶形系数(5对)及叶片卷曲度(4对)间检测到了15对关联的SSR标记, 其主要分布于除第6染色体以外的其余9号染色体上, 单个关联SSR标记的表型变异贡献率为2.25%~27.30%。在所有找到的关联SSR标记中, 大约72.97%的关联SSR标记可在干旱胁迫环境下被检测到。因此, 干旱胁迫下检测到的与玉米7个叶形相关性状相关的SSR标记为今后玉米叶形相关抗旱分子遗传机理的解析及抗旱MAS育种奠定基础。此外, Tuberosa等[38]认为由于不同性状间存在共同的遗传机制, 因此“一因多效”或是控制不同性状的基因普遍呈紧密连锁的现象, 而在本研究中总共检测到了9个SSR标记(umc1124、umc2363、umc2214、umc1742、phi331888、umc1378、bnlg1863、umc2134和umc1345)同时与多个玉米叶形相关性状连锁, 且这与本研究7个叶形相关性状间的Pearson相关分析的结果高度一致, 即单个叶形相关性状与其余4~6个叶形相关性状呈显著或极显著正/负相关。说明玉米染色体的这些SSR标记位点共同调控着玉米的7个叶形相关性状的遗传。
其中, 位于Bin 2.02处的umc2363同时与2种水分环境下的叶长、叶夹角、叶片卷曲度及正常供水环境下的叶面积间相关, 解释的表型变异为2.42%~4.11%。赵小强[10]采用2套F2∶3群体也在umc2363附近找到了多个干旱胁迫环境下调控叶夹角的主效QTL, 其受基因加性遗传效应的控制。于多个正常供水和干旱胁迫下, Zhao等[2]也在Bin 2.02的umc2363-umc2403区间也检测到了1个调控叶夹角的sQTL, 其可解释6.81%~19.53%的叶夹角变异。进一步采用mQTL分析, Zhao等[2]还在该区域的umc2363-umc1227区域内检测到了1个同时调控叶夹角、叶向值及叶宽的mQTL2-1和1个调控玉米叶耳和叶舌发育及叶片直立生长的()候选基因。标记umc2214(Bin 2.09)同时与2种水分环境下的叶长、叶宽、叶面积及叶形系数间相连锁, 表型变异的解释率为2.42%~3.41%。Zhao等[2]也在umc2184-umc2214区间内挖掘到了1个调控玉米叶长的mQTL2-3。Li等[39]还在此区域的233.55~236.61 Mb处预测到了1个调控叶长的()候选基因; 甚至, 采用图位克隆的方法, Bolduc等[40]证实了调控玉米叶片的形成。phi331888 (Bin 5.04)位点同时与2种水分环境下的叶长、叶宽、叶夹角、叶向值及正常供水环境下的叶面积、叶形系数、叶片卷曲度相连锁, 解释的表型变异为2.39%~4.52%。Ku等[5]也在Bin 5.04的bnlg1287附近同时定位到了1个同时调控叶夹角和叶向值的QTL, 受基因部分显性遗传效应的调控, 表型贡献率分别为9.7%和9.8%。同时刘鹏飞等[41]在Bin 5.04处的umc1171附近挖掘到1个调控叶夹角的QTL, 其受基因加性遗传效应的调控, 表型贡献率为7.4%。在Bin 7.00 (umc1378)处同时与2种水分环境下的叶长、叶夹角、叶向值、叶面积及正常供水环境下的叶宽相关, 解释的表型变异为2.53%~4.20%。刘鹏飞等[41]在umc1378-umc1545区间检测到了1个调控叶夹角的QTL, 其受基因部分显性遗传效应的调控, 可解释3.3%的叶夹角变异。在umc2177-umc378-umc1426 (Bin 7.00)区间Zhao等[2]在4套F2和F2∶3群体的6种不同水分环境下同时检测到1个调控叶夹角和叶向值的sQTL。甚至, 赵小强[10]对umc1378-umc2177区间同时调控玉米叶夹角和叶向值的主效QTL进行精细定位和亲本间Illumina HiSeq 2500重测序后, 最终在该主效QTL区间挖掘到了1个调控玉米叶片发育的()基因; 有趣的是, 郭书磊等[6]也在此区域检测到了1个调控叶宽的mQTL, 并找到了和候选基因, 其中是1个的基因并对叶片基部-末端轴向的形成中起调控作用[42], 而是1个基因, 该基因能够上调分生组织中家族基因的表达, 进而保持叶片细胞分裂活性和抑制叶片中和家族基因, 进而促进叶片近轴组织的分化发育[43]。bnlg1863 (Bin 8.03)位点同时与2种水分环境下的叶面积及干旱胁迫下的叶片卷曲度相关联, 解释的表型变异为9.44%~22.17%。在Bin 8.03~8.04的umc1904-umc1460区域刘鹏飞等[41]在1套F2群体上识别到了1个调控叶夹角的QTL, 其受基因加性遗传效应的调控, 解释的表型贡献率为7.1%。赵小强[10]在Bin 8.03处的umc1530-bnlg1863、bnlg1863-umc2075、umc2075-bnlg162区间分别检测到多个水分环境下同时调控玉米叶长、叶面积及叶向值的QTL/sQTL。甚至, Zhao等[2]还在bnlg1863-umc1302区间上检测到了1个同时调控叶夹角、叶长、叶面积及叶形系数的mQTL, 并挖掘到了1个负向调控叶原基发育的转录因子()[44]。umc2134 (Bin 9.05)标记同时与2种水分环境下的叶形系数及正常供水下的叶向值相关联, 解释的表型变异为3.18%~7.86%。Zhao等[2]在Bin 9.05 (bnlg1270a-umc1231)处识别到了1个同时调控叶宽、叶向值及叶面积的mQTL, 并挖掘出了()基因, 该基因作为一种ADP/ATP载体, 在玉米叶基部分生组织发育中积累。表明Bin 2.02、Bin 2.09、Bin 5.04、Bin 7.00、Bin 8.03及Bin 9.05等附近是调控玉米多个叶形相关性状的重要“一因多效”或富集位点, 且这些区域存在一些重要调控基因, 为不同水分环境下玉米叶片结构的塑造发挥重要的积极效应。此外, 本研究还找到了3个新的SSR标记位点与不同水分环境下的玉米的叶形相关性状在<0.01水平下关联, 分别是位于Bin 1.05 (umc1124)处同时与2种水分环境下的叶夹角及正常供水环境下的叶向值, 位于umc1742 (Bin 3.04)处同时与正常供水环境下的叶长、叶宽及叶形系数, 及位于umc1345 (Bin 10.03)位点与2种水分环境下的叶面积和叶形系数间相连锁SSR标记, 这3个连锁标记可为不同水分环境下调控玉米叶形相关性状QTL/基因挖掘提供新信息。
4 结论
干旱胁迫环境下不同玉米自交系的叶长、叶宽、叶夹角和叶面积显著降低, 而叶向值、叶形系数和叶片卷曲度明显升高, 且干旱胁迫后玉米自交系的叶长(52.60%)、叶宽(76.46%)、叶夹角(198.31%)、叶向值(118.62%)、叶面积(65.27%)、叶形系数(66.57%)及叶片卷曲度(30.53%)间的变异比率间差异显著, 这7个叶形性状与玉米的抗旱性紧密相关, 可作为玉米抗旱性鉴定的重要参考指标。采用均匀覆盖玉米全基因组的145对SSR标记可将供试玉米自交系划分为LRC、TSPT、Lan、P及Reid等5大类群, 其遗传多样性较大, PIC介于0.200~0.966。进一步通过GLM分析在2种水分环境下总共检测到了15个SSR标记与玉米的7个叶形性状相关联, 其中9个标记同时与2种水分环境下的多个叶形相关性状连锁, 表现出明显的“一因多效”现象。
[1] ZHAO X Q, ZHANG J W, FANG P, et al. Comparative QTL analysis for yield components and morphological traits in maize (L.) under water-stressed and well-watered conditions[J]. Breeding Science, 2019, 69(4): 621–632
[2] ZHAO X Q, FANG P, ZHANG J W, et al. QTL mapping for six ear leaf architecture traits under water-stressed and well-watered conditions in maize (L.)[J]. Plant Breeding, 2018, 137(1): 60–72
[3] 赵小强, 姬祥卓, 彭云玲. 花期玉米()穗三叶叶形结构的遗传效应及配合力分析[J]. 分子植物育种, 2020, 18(9): 3024–3031 ZHAO X Q, JI X Z, PENG Y L. Analysis of combining ability and genetic effect for leaf shape about the three-ear-leaves at flowering stage in[J]. Molecular Plant Breeding, 2020, 18(9): 3024–3031
[4] KU L X, ZHANG J, GUO S L, et al. Integrated multiple population analysis of leaf architecture traits in maize (L.)[J]. Journal of Experimental Botany, 2012, 63(1): 261–274
[5] KU L X, ZHAO W M, ZHANG J, et al. Quantitative trait loci mapping of leaf angle and leaf orientation value in maize (L.)[J]. Theoretical and Applied Genetics, 2010, 121(5): 951–959
[6] 郭书磊, 张君, 齐建双, 等. 玉米叶形相关性状的Meta-QTL及候选基因分析[J]. 植物学报, 2018, 53(4): 487–501 GUO S L, ZHANG J, QI J S, et al. Analysis of Meta- quantitative trait loci and their candidate genes related to leaf shape in maize[J]. Chinese Bulletin of Botany, 2018, 53(4): 487–501
[7] RIBAUT J M, BETRAN J, MONNEVEUX P, et al. Drought tolerance in maize[M]//BENNETZEN J L, HAKE S C. Handbook of Maize: Its Biology. New York: Springer, 2009: 311–344
[8] BENNETZEN J L, HAKE S C. Handbook of Maize: Its Biology[M]. New York: Springer, 2010: 324
[9] 赵小强, 陆晏天, 白明兴, 等. 不同株型玉米基因型对干旱胁迫的响应分析[J]. 草业学报, 2020, 29(2): 149–162 ZHAO X Q, LU Y T, BAI M X, et al. Response of maize genotypes with different plant architecture to drought stress[J]. Acta Prataculturae Sinica, 2020, 29(2): 149–162
[10] 赵小强. 玉米株型相关耐旱遗传机理研究[D]. 兰州: 甘肃农业大学, 2018 ZHAO X Q. Genetic mechanisms study of drought tolerance related to plant architecture in maize (L.)[D]. Lanzhou: Gansu Agricultural University, 2018
[11] 马娟, 王铁固, 张怀胜, 等. 玉米叶夹角、叶向值主基因+多基因遗传模型分析[J]. 河南农业科学, 2012, 41(5): 15–19 MA J, WANG T G, ZHANG H S, et al. The major genes plus polygenes genetic analysis on leaf angle and leaf orientation value in maize[J]. Journal of Henan Agricultural Sciences, 2012, 41(5): 15–19
[12] GRIFFING B. A generalised treatment of the use of diallel crosses in quantitative inheritance[J]. Heredity, 1956, 10(1): 31–50
[13] 陈宛秋, 张彪, 康继伟, 等. 几个常用玉米自交系株型性状的遗传及其在株型育种中的利用[J]. 四川农业大学学报, 1993, 11(4): 563–567 CHEN W Q, ZHANG B, KANG J W, et al. Inheritance of plant characters and yield of some corn inbred lines often used in breeding and its potential ultilization[J]. Journal of Sichuan Agricultural University, 1993, 11(4): 563–567
[14] MICKELSON S M, STUBER C S, SENIOR L, et al. Quantitative trait loci controlling leaf and tassel traits in a B73×Mo17 population of maize[J]. Crop Science, 2002, 42(6): 1902–1909
[15] PAN Q C, XU Y C, LI K, et al. The genetic basis of plant architecture in 10 maize recombinant inbred line populations[J]. Plant Physiology, 2017, 175(2): 858–873
[16] WANG Y J, XU J, DENG D X, et al. A comprehensive meta-analysis of plant morphology, yield, stay-green, and virus disease resistance QTL in maize (L.)[J]. Planta, 2016, 243(2): 459–471
[17] ZONDERVAN K T, CARDON L R. The complex interplay among factors that influence allelic association[J]. Nature Reviews Genetics, 2004, 5(2): 89–100
[18] DUCROCQ S, MADUR D, VEYRIERAS J B, et al. Key impact ofon flowering time adaptation in maize: Evidence from association mapping and ecogeographical information[J]. Genetics, 2008, 178(4): 2433–2437
[19] BRESEGHELLO F, SORRELLS M E. Association mapping of kernel size and milling quality in wheat (L.) cultivars[J]. Genetics, 2006, 172(2): 1165–1177
[20] EIZENGA G C, AGRAMA H A, LEE F N, et al. Identifying novel resistance genes in newly introduced blast resistant rice germplasm[J]. Crop Science, 2006, 46(5): 1870–1878
[21] ZHAO X Q, PENG Y L, ZHANG J W, et al. Identification of QTLs and meta-QTLs for seven agronomic traits in multiple maize populations under well-watered and water-stressed conditions[J]. Crop Science, 2018, 58(2): 507–520
[22] ZHAO X Q, PENG Y L, ZHANG J W, et al. Mapping QTLs and meta-QTLs for two inflorescence architecture traits in multiple maize populations under different watering environments[J]. Molecular Breeding, 2017, 37(7): 91
[23] 赵小强, 任斌, 彭云玲, 等. 8种水旱环境下2个玉米群体穗部性状QTL间的上位性及环境互作效应分析[J]. 作物学报, 2019, 45(6): 856–871 ZHAO X Q, REN B, PENG Y L, et al. Epistatic and QTL×environment interaction effects for ear related traits in two maize () populations under eight watering environments[J]. Acta Agronomica Sinica, 2019, 45(6): 856–871
[24] 赵小强, 方鹏, 彭云玲, 等. 基于两个相关群体的玉米7个主要农艺性状遗传分析和QTL定位[J]. 草业学报, 2018, 27(9): 152–165 ZHAO X Q, FANG P, PENG Y L, et al. Genetic analysis and QTL mapping for seven agronomic traits in maize () using two connected populations[J]. Acta Prataculturae Sinica, 2018, 27(9): 152–165
[25] PEPPER G E, PEARCE R B, MOCK J J. Leaf orientation and yield of maize[J]. Crop Science, 1977, 17(6): 883–886
[26] YANG G H, DONG Y B, LI Y L, et al. Integrative detection and verification of QTL for plant traits in two connected RIL populations of high-oil maize[J]. Euphytica, 2015, 206: 203–223
[27] YANG D L, LIU Y, CHANG H B, et al. Genetic dissection of flag leaf morphology in wheat (L.) under diverse water regimes[J]. BMC Genetics, 2016, 17(1): 94
[28] 赵小强, 方鹏, 彭云玲, 等. 基于两个相关群体的玉米6个穗部性状QTL定位[J]. 农业生物技术学报, 2018, 26(5): 729-742 ZHAO X Q, FANG P, PENG Y L, et al. QTL mapping for six ear-related traits based on two maize () related populations[J]. Journal of Agricultural Biotechnology, 2018, 26(5): 729-742
[29] 张振平, 孙世贤, 张悦, 等. 玉米叶部形态指标与抗旱性的关系研究[J]. 玉米科学, 2009, 17(3): 68–70 ZHANG Z P, SUN S X, ZHANG Y, et al. Study on the relations of leaf morphology indexes and drought resistance of maize[J]. Journal of Maize Sciences, 2009, 17(3): 68–70
[30] ISIDRO J, KNOX R, CLARKE F, et al. Quantitative genetic analysis and mapping of leaf angle in durum wheat[J]. Planta, 2012, 236(6): 1713–1723
[31] SOHRABI M, RAFII M Y, HANAFI M M, et al. Genetic diversity of upland rice germplasm in Malaysia based on quantitative traits[J]. The Scientific World Journal, 2012, 2012: 416291
[32] 张飞, 王艳秋, 朱凯, 等. 干旱胁迫下适宜机械化生产高粱品种株型变化及生理响应[J]. 江苏农业科学, 2018, 46(1): 49–51 ZHANG F, WANG Y Q, ZHU K, et al. Plant type changes and physiological characteristics of sorghum suitable to mechanization under drought stress[J]. Jiangsu Agricultural Sciences, 2018, 46(1): 49–51
[33] 朱宗河, 郑文寅, 张学昆. 甘蓝型油菜耐旱相关性状的主成分分析及综合评价[J]. 中国农业科学, 2011, 44(9): 1775–1787ZHU Z H, ZHENG W Y, ZHANG X K. Principal component analysis and comprehensive evaluation on morphological and agronomic traits of drought tolerance in rapeseed (L.)[J]. Scientia Agricultura Sinica, 2011, 44(9): 1775–1787
[34] MASARIRAMBI M T, MANDISODZA F C, MASHINGAIDZE A B, et al. Influence of plant population and seed tuber size on growth and yield components of potato ()[J]. International Journal of Agriculture and Biology, 2012, 14(4): 545–549
[35] SENIOR M L, MURPHY J P, GOODMAN M M, et al. Utility of SSRs for determining genetic similarities an relationship in maize using an agarose gel system[J]. Crop Science, 1998, 38(4): 1088–1098
[36] WU X, LI Y X, SHI Y S, et al. Fine genetic characterization of elite maize germplasm using high-throughput SNP genotyping[J]. Theoretical and Applied Genetics, 2014, 127(3): 621–631
[37] INGVARSSON P K, STREET N R. Association genetics of complex traits in plants[J]. New Phytologist, 2011, 189(4): 909–922
[38] TUBEROSA R, SALVI S, SANGUINETI M C, et al. Mapping QTLs regulating morpho-physiological traits and yield: Case studies, shortcomings and perspectives in drought-stressed maize[J]. Annals of Botany, 2002, 89(7): 941–963
[39] LI C H, LI Y X, SHI Y S, et al. Genetic control of the leaf angle and leaf orientation value as revealed by ultra-high density maps in three connected maize populations[J]. PLoS One, 2015, 10(3): e0121624
[40] BOLDUC N, HAKE S. The maize transcription factor KNOTTED1 directly regulates the gibberellin catabolism gene[J]. The Plant Cell, 2009, 21(6): 1647–1658
[41] 刘鹏飞, 蒋锋, 王汉宁, 等. 玉米叶夹角和叶向值的QTL定位[J]. 核农学报, 2012, 26(2): 231–237 LIU P F, JIANG F, WANG H N, et al. QTL mapping for leaf angle and leaf orientation in corn[J]. Journal of Nuclear Agricultural Sciences, 2012, 26(2): 231–237
[42] NAGASAKI H, SAKAMOTO T, SATO Y, et al. Functional analysis of the conserved domains of a rice KNOX homeodomain protein, OSH15[J]. The Plant Cell, 2001, 13(9): 2085–2098
[43] JUN S E, CHO K H, HWANG J Y, et al. Comparative analysis of the conserved functions of Arabidopsis DRL1 and yeast KTI12[J]. Molecular and Cells, 2015, 38(3): 243–250
[44] EFRONI I, HAN S K, KIM H J, et al. Regulation of leaf maturation by chromatin-mediated modulation of cytokinin responses[J]. Developmental Cell, 2013, 24(4): 438–445
Association analysis of SSR markers with leaf morphology in maize () under diverse watering regimes*
ZHONG Yuan, ZHAO Xiaoqiang**, LI Wenli
(Gansu Provincial Key Laboratory of Aridland Crop Science, Gansu Agricultural University, Lanzhou 730070, China)
The leaf morphology of maize () is closely related to its drought resistance. The molecular markers correlated with leaf morphology traits under different watering regimes may provide insights into the genetic mechanisms and identify the breeding varieties. In this study, changes in the leaf length (LL), leaf width (LW), leaf angle (LA), leaf orientation value (LOV), leaf size (LS), leaf shape coefficient (LSC), and leaf rolling index (LRI) of 187 maize inbred lines were analyzed under different watering regimes. A genome-wide scan and the genetic diversity were analyzed with simple-sequence repeat (SSR) markers, and the associations between the markers and the leaf morphological traits were assessed via a general linear model (GLM). The results showed that: 1) the coefficients of variation for the leaf morphological traits of the 187 inbred lines were 13.21%−59.23% and 9.62%−28.22% under normal water and dry conditions, respectively, indicating abundant genetic variation. There were significant differences in the seven leaf morphological traits, so the leaf morphology was adjusted by the hereditary character of the inbred line. LL, LW, LA, and LS decreased significantly under drought stress, whereas LOV, LSC, and LRI increased, and the variance rate of the seven traits was 30.53%−198.31%. 2) A total of 652 alleles were detected using 145 SSR markers. The polymorphism information content (PIC) ranged from 0.201 to 0.966, with an average of 0.478. The tested materials were divided into five groups based on unweighted pair group method with arithmetic mean clustering and population structure; the Luda red cob group, Tangsipingtou group, Lancaster group, P group, and Reid group. 3) A total of 15 SSR markers were associated with seven leaf morphologies under different watering regimes (GLM,<0.01), and the amount of explained phenotypic variance was 2.25%−27.30%. Approximately 72.97% of the SSR markers were detected under drought conditions. The umc1124, umc2363, umc1742, phi331888, umc1378, bnlg1863, umc2134, and umc1345 markers were simultaneously associated with multiple leaf morphologies under different watering regimes, indicating pleiotropy. These results provide useful information for the genetic improvement of leaf morphology and marker-assisted selection breeding programs for maize drought resistance and optimization.
Maize; Leaf morphology; Drought; Genetic structure; Association analysis
, E-mail: zhaoxq3324@163.com
Jun. 27, 2020;
Aug. 19, 2020
S513.035.2
10.13930/j.cnki.cjea.200507
钟源, 赵小强, 李文丽. 不同水分环境下玉米叶形相关性状与SSR标记的关联分析[J]. 中国生态农业学报(中英文), 2020, 28(11): 1726-1738
ZHONG Y, ZHAO X Q, LI W L. Association analysis of SSR markers with leaf morphology in maize () under diverse watering regimes[J]. Chinese Journal of Eco-Agriculture, 2020, 28(11): 1726-1738
* 甘肃农业大学甘肃省干旱生境作物学重点实验室开放基金(GSCS-2019-8, GSCS-2020-5)、甘肃农业大学科技创新基金-公招博士科研启动基金(GAU-KYQD-2018-19, GAU-KYQD-2018-12)、甘肃省高等学校创新能力提升项目(2019A-052, 2019A-054)、国家自然科学基金项目(32060486)和兰州青绿仪器技术有限公司横向项目(WT20191025)资助
赵小强, 主要研究方向为现代生物技术及其在作物遗传育种中的应用。E-mail: zhaoxq3324@163.com
钟源, 主要从事生物化学与分子生物学研究。E-mail: zhongy@gsau.edu.cn
2020-06-27
2020-08-19
* This study was supported by the Open Fund of Gansu Provincial Key Laboratory of Aridland Crop Science, Gansu Agricultural University, China (GSCS-2019-8, GSCS-2020-5), the Scientific Research Start-up Funds for Openly-recruited Doctors of Science and Technology Innovation Funds of Gansu Agricultural University, China (GAU-KYQD-2018-19, GAU-KYQD-2018-12), the Developmental Funds of Innovation Capacity in Higher Education of Gansu Province, China (2019A-052, 2019A-054), National Natural Science Foundation of China (32060486) and the Transverse Project of Lanzhou Qinglü Instrument and Technology Company, China (WT20191025).

