PLCE1基因多态性与广西壮族儿童PNS相关性研究
张研,林娜,刘运广
(1. 右江民族医学院,广西 百色 533000;2. 右江民族医学院附属医院儿科,广西 百色 533000)
肾病综合征(nephrotic syndrome,NS)是由于肾小球滤过膜对血浆蛋白的通透性增高、大量血浆蛋白从尿中丢失而导致一系列病理生理改变的一种临床综合征。儿童原发性肾病综合征(Primary Nephrotic Syndrome,PNS)占小儿时期NS总数的90%以上[1],是儿童最常见的且严重影响正常生长发育的免疫介导的肾小球疾病[2-3]。由于医学技术的进步及人类遗传变异数据库的更新[4],基因分析已成为一种更精确的诊断方法[5]。筛选PNS的发生发展中起关键作用的基因,并给予特异性干预,对治疗PNS具有重要意义。目前已报道的单基因突变可导致NS的基因已超过39个[2],磷脂酶CE1(Phospholipase CE1,PLCE1)属于其中之一。PLCE1 基因定位于人第10号染色体长臂23区(10q23),全长334.4 kb,共有34个外显子,编码PLCE1蛋白,该蛋白作为一种信号分子,分布在全身多个系统及器官中,参与多条信号转导通路,保证细胞的各种生命活动正常进行。目前就PLCE1基因导致儿童PNS的机制,大部分学者认为PLCE1是通过家族性常染色体隐性遗传导致儿童PNS的发生[6-7]。国内外对于PLCE1多态性的研究现多集中在消化系统及癌症相关性疾病,如其多态性可增加食管鳞癌[8]、结直肠癌[9]、胃癌[10-11]、胆囊癌[12]等的易感性,但对PLCE1多态性与儿童PNS的发生及其易感性是否有关的研究甚少。本研究采用目标基因捕获结合第二代测序技术,对108例壮族PNS患儿及100例壮族健康儿童血液进行全DNA测序,旨在分析PLCE1多态性与壮族儿童PNS的相关性,对PNS的诊治提供进一步的理论和实验依据。
1 材料与方法
1.1 研究对象 收集2015年7月—2017年9月在右江民族医学院附属医院进行体检的健康壮族儿童100例,及同时期住院的壮族PNS儿童108例,诊断符合儿童PNS诊断标准[13],即①大量蛋白尿:24 h尿蛋白定量≥50 mg/kg,随机或晨尿蛋白/肌酐(mg/mg)≥2.0,1周内3次尿蛋白定性(3+~ 4+);②低蛋白血症:血浆白蛋白< 25 g/L;③高脂血症:血浆胆固醇高于5.7 mmol/L;④不同程度水肿;⑤排除继发性因素[14]。以上①和②是诊断的必要条件。两组研究对象三代均为壮族,相互之间无血缘关系,家族中无肾脏疾病患者。在年龄及性别组成上两组差异无统计学意义(P>0.05)。根据知情同意原则,告知患儿家长研究目的及风险等,取得同意并签署知情同意书,本研究经过右江民族医学院伦理委员会批准。
1.2 基因组 DNA 的提取 按照使用说明利用DNeasy血液和组织DNA提取试剂盒(QIAGEN,Hilden,德国) 提取DNA。计算260 nm与280 nm处吸光度的比率来测试DNA纯度。
1.3 FastTarget目标区域测 以标准人基因组为模板,扩增获得PLCE目标区域的引物。利用带有Index序列的引物,通过PCR扩增向末端引入特异性标签序列,获得最终的 FastTarget 测序文库,文库的片段经验证及摩尔浓度精确定量后进行高通量测序,最终获得FastQ数据。
1.4 数据筛选和分析 对原始数据进行比对及校正,将所有单核苷酸多态性(SNP)位点与dbSNP、千人基因组、ESP6500、ExAC03、ExAC03_EAS、gnomAD、Hrcr1Kaviar_20150923数据库进行比对分析,评估其变异频率、功能特征、保守性等。根据样本多态性位点的基因型及表型,采用 Hardy-Weinberg遗传平衡定律评估样本有无群体代表性、plink 分析软件进行关联分析、Haploview 软件进行连锁不平衡分析。使用数学工具如Logistic回归、χ2检验等进行统计分析。χ2分析设4个分析模型(Codominant、Dominant、Recessive、Allele)对每个位点进行分析。Logistic回归以单个位点为单位,按5个假设的遗传模型(Dominant,Recessive,Log-additive,HOM/HET)进行关联分析,快速地找到最有生物学意义的SNP位点。
2 结果
2.1 Hardy-Weinberg平衡检验 本研究样本中共检出19个SNP位点,对其进行Hardy-Weinberg平衡检测,均为P>0.05,说明样本符合Hardy-Weinberg平衡定律,具有群体代表性,见表1。
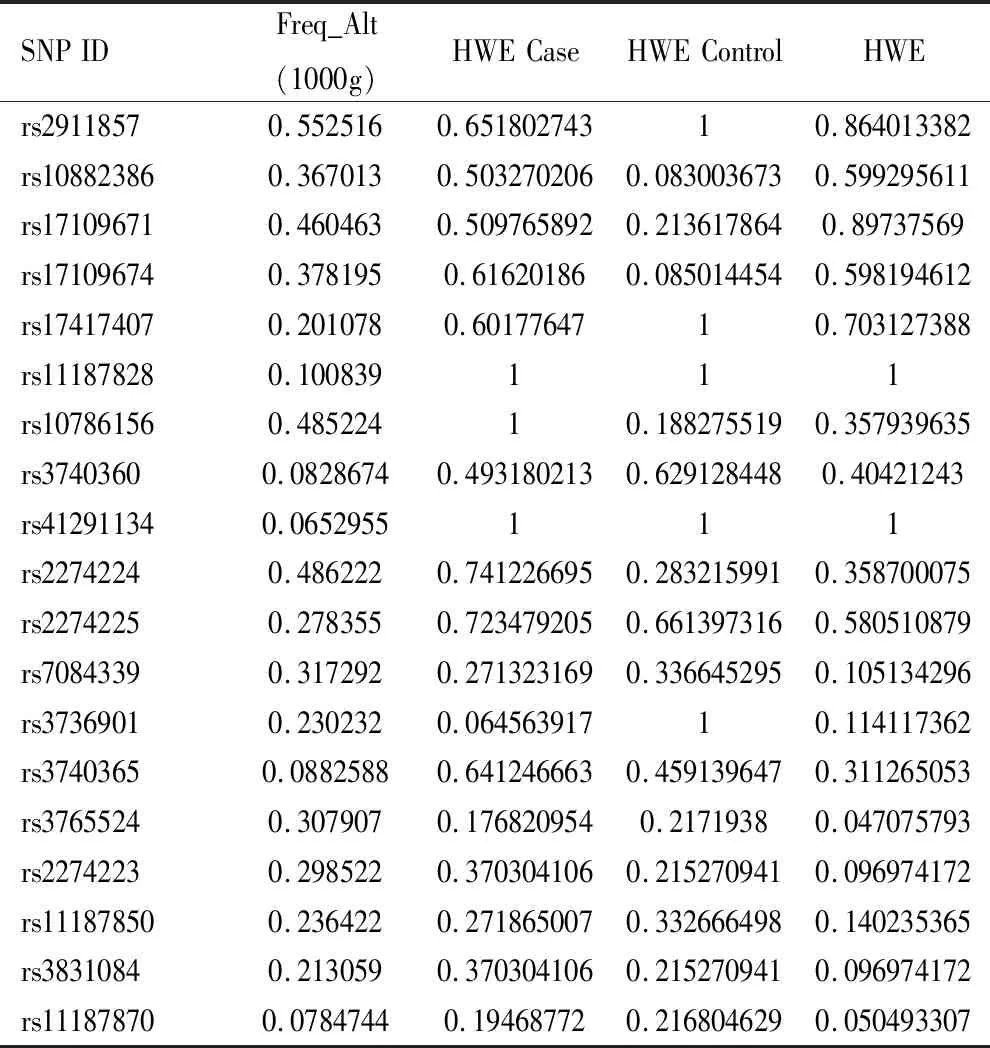
表1 PLCE1多态位点的Hardy-Weinberg平衡检验
2.2 χ2检验 对上述位点进行χ2检验,rs11187828位点在Dominant及Allele模型中显示P<0.05,OR=7.654,差异有统计学意义,见表2、表3。

表2 PLCE1基因SNP位点的χ2检验结果

表3 多态性位点rs11187828的χ2检验
2.3 Logistic回归分析 对上述位点进行Logistic回归分析,rs11187828在Dominant 、Log-additive模型显示P<0.05,OR=14.78,差异有统计学意义,见表4、表5。

表4 PLCE1基因SNP位点的Logistic回归分析结果

表5 多态性位点rs11187828的Logistic回归分析
2.4 连锁不平衡分析 使用haploview 软件对上述位点进行连锁不平衡分析,发现多对强连锁不平衡位点(D’>0.75,r2>0.33),其中rs2274223与rs11187850接近完全连锁不平衡(D’=1.00,r2=0.99),见图1~图2。
2.5 单倍型分析 对有较强关联性的Block进行单倍型分析及Logistic回归的关联分析。PLCE1-2中单倍型CGACTA的分布频率在两组间差异有统计学意义(OR=13.8756,P<0.05),见表6。
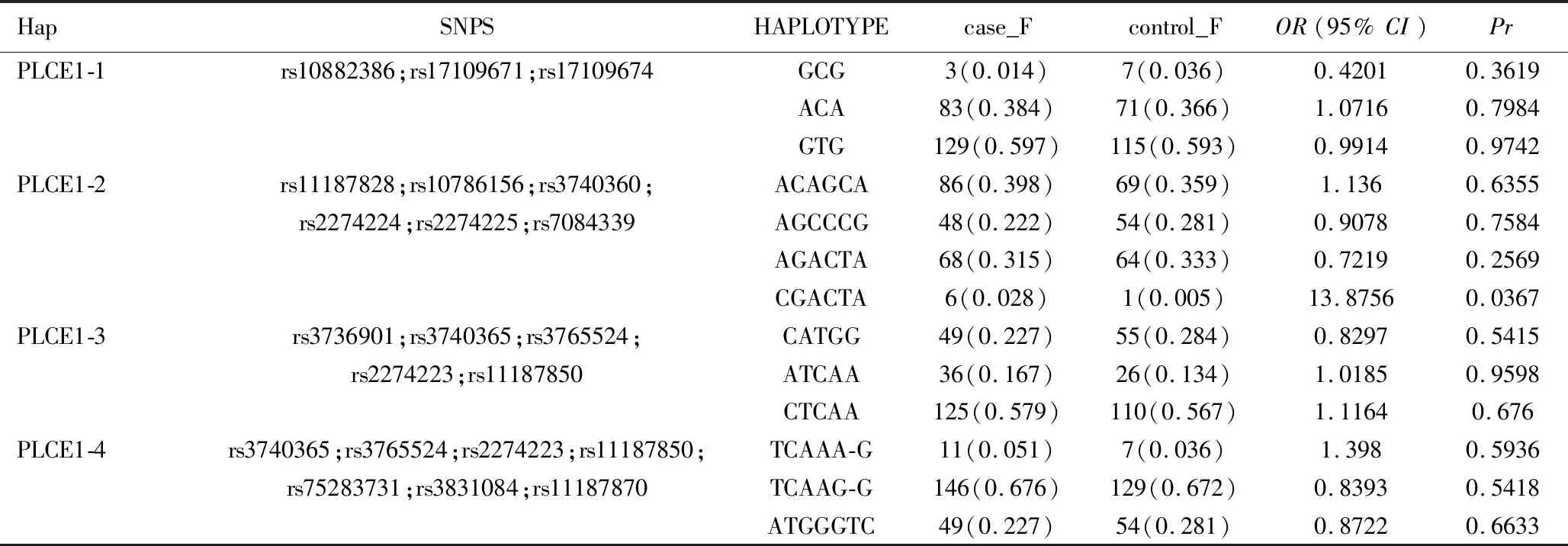
表6 PLCE1基因单倍型关联分析结果
3 讨论
SNP是人类基因组最常见的基因变异形式,是指人群中分布概率大于1%的单核苷酸变异[15],平均每500~1000个碱基对中就有1个,估计其总数可达300万个甚至更多[16]。由于SNP的高遗传稳定性,某些碱基的改变并不会改变翻译后氨基酸的表达及蛋白质的结构,不会导致疾病的发生,但有研究表明[17],SNP可能改变染色质重塑和三维染色体交互作用。由于单核苷酸在SNPs处的转移可能增强或降低转录因子与调控位点(由这些SNPs形成)的亲和力,同时他们可能促进或抑制位于不同染色体上的调控位点之间的环和/或桥的形成(3D染色体交叉对话),使其在调节基因表达和易受病态影响方面需要另一层调控机制。通过SNP关联或连锁分析,在定位疾病的易感基因、推断疾病易感相关性中发挥重要作用[18]。
国外报道[19-20],儿童NS的发病率为1 ~ 3/10万人口,患病率为16/10万人口。我国南方地区最常见的5种病理类型中,局灶性节段性肾小球硬化(FSGS)是最常见的病理类型,检出率为5.6%,占儿童NS的20%[21-22]。PLCE1蛋白定位在细胞膜上,该蛋白通过与相关蛋白或受体相互作用,从而调控细胞的生长、增殖、分化、凋亡等生物学功能,因此该蛋白表达或分布异常可能会参与肾脏、心脏、神经系统疾病甚至肿瘤的发生发展过程[23]。研究表明[24],PLCE1基因与家族性NS关系密切,提示PLCE1基因在肾血管球的发生中起重要作用。现有的研究大多认为[25-26],PLCE1导致儿童PNS的机制为PLCE1单基因突变导致的家族性常染色体隐性遗传型NS。对于PLCE1基因SNP位点是否会引起PNS发病或增加其易感性尚不明确。本研究通过采用目标基因捕获结合第二代测序技术对广西壮族108例PNS患儿及100例健康儿童进行全DNA检测。研究中所有样本符合H-W平衡,样本具有群体代表性。PNS组中有8名患儿及1名健康儿童体内存在rs111787828位点,对该位点进行χ2检验,显示其在PNS组及对照组中的分布差异有统计学意义,在Logistic回归分析中Dominant 、Log-additive两模型上的差异有统计学意义,在单倍型关联性分析中该位点上CGACTA单倍型的分布频率在两组间差异有统计学意义。综上所述,提示PLCE1基因多态性与广西壮族儿童PNS发生有关,多态位点rs11187828可能会增加中国广西壮族儿童PNS的易感性。
基因多态性位点的分析对疾病的易感性评估、早期诊断、预防和治疗等方面均有实际的意义及运用前景[27]。 在药物治疗方面,由于药物代谢酶和药物作用靶点基因特性的变化可影响药物在体内的浓度及靶组织对药物的敏感性,导致个体对药物的疗效及不良反应存在差异[28],PLCE1基因突变导致的PNS大多对激素耐药,我们可以通过研究PLCE1基因突变或多态性位点对药物作用的靶组织或代谢酶存在的影响,探究药物在不同遗传变异个体中的药物代谢动力学差异,为临床实施个体化药物治疗提供理论基础[29],在药物基因组学以及人类进化史方面也有重要意义。在基因干预治疗方面,以PLCE1基因SNP与PNS的易感性为例,应用基因沉默、基因置换、基因校正、基因封闭或灭活等技术,将PNS易感基因的SNP错义位点进行针对性治疗,使危险性SNP转化为保护性SNP,就能从基因水平上抑制PNS的发生,从而实现基因水平的精准治疗。

