不同基因型人乳头瘤病毒感染所致尖锐湿疣皮损中p16、Akt 的表达及意义
黄尾全 王丹丽 蒋元德
( 广东省东莞市厚街医院 广东 东莞 523945)
尖锐湿疣是由HPV 引起一种皮肤科常见性病,目前治疗方法有药物、激光、电灼、光动力疗法等,但容易复发,给病人造成较大的困扰,本研究探讨尖锐湿疣的复发与皮损部位p16,Akt的表达差异是否有关联,以及HPV 各亚型p16,Akt 的表达是否存在差异。
1.病例收集
病例入选标准:选取2017 年9 月—2019 年12 月80 名符合中国疾病预防控制中心制订的尖锐湿疣的诊断标准的患者,年龄18 ~52 岁,男女性别比例相同,初次发病首次就诊病例。近1 月内未接受系统治疗,2 周内未接受局部治疗者。为排除其他疾病的影响,月经期、孕妇、哺乳期女性不做为观察对象,有生殖器部位细菌、滴虫、真菌、感染或合并其他疾病、有全身慢性消耗性疾病或者严重肝肾疾病患者不做为观察对象。所有病例均签署知情同意书。
2.方法
2.1 HPV 基因分型检测
2.1.1 检测仪器及试剂 香港凯普公司的HPV 基因检测试剂盒,美国ABI-700PCR 检测仪。
2.1.2 HPV 分型原理及步骤 活检取材采集CA 组织标本送本院检验科,由检验科严格按照试剂盒说明书进行操作,进行定量PCR 检测分型,按HPV 分型结果分为低危型组、高危型组、高低危混合型组。
2.2 免疫组化测定组织中p16、Akt 表达
2.2.1 免疫组化 活检取材采集CA 患者皮损标本,先用福尔马林固定、石蜡包埋、连续切片,取健康成人包皮环切组织10 例做正常对照。切片常规脱蜡水化,3%过氧化氢甲醇溶液10min 阻断内源性过氧化物酶,抗原修复液于微波炉中抗原修复 10min;非免疫动物血清37℃孵育10min;加入一抗4℃湿盒中过夜孵育,生物素标记的二抗37℃孵育30min,链霉素-过 氧化物酶(SP)复合物37℃孵育30min;DAB 显色,苏木精复染,脱水、透明、封片。每次实验阳性对照参考已知阳性片,阴性对照则采用PBS 替代第一抗体。
2.2.2 免疫组化结果判定 参照Krajewska 等的评分方法分别记录标本中表皮基底细胞层和棘细胞层的评分,弱、中、强阳性表达强度按颜色显示为黄色、棕黄色、棕褐色分别定义,并且计为1 ~3 分;然后按阳性细胞所占的百分比将<1%、1%~25%、26%~50%、51%~75%、>76%记为0 ~4 分;最后综合两部分得分。
2.3 治疗方案
①物理方法:高频电灼祛除疣体;②肌注γ 干扰素200 万u,隔日一次,共10 次。
2.4 预后观察
手术后3 个月内每2 周门诊复查,3 个月后改为每月门诊复查,随访6 个月,在患者复诊期间如发现新发CA 病灶或者醋酸白试验阳性均视为临床复发。
2.5 统计学分析
采用SPSS19.0 软件对实验结果所得数据进行统计分析,计数资料以(%)表示,采用χ2检验;计量资料以(±s)表示,采用t 检验,P <0.05 为差异具有统计学意义。
3.结果
3.1 p16、Akt 蛋白在各组中的表达,低危组Akt 表达阳性38 例,p16 阳性35 例,高危组Akt 表达阳性10 例,p16 阳性9 例,高低危混合组Akt 表达阳性13 例, p16 阳性12 例,正常对照组Akt 表达阳性2 例,p16 阳性2 例;p16、Akt 表达阳性在各组之间差异具有统计学意义,P <0.01,均高于正常对照组,见表1。
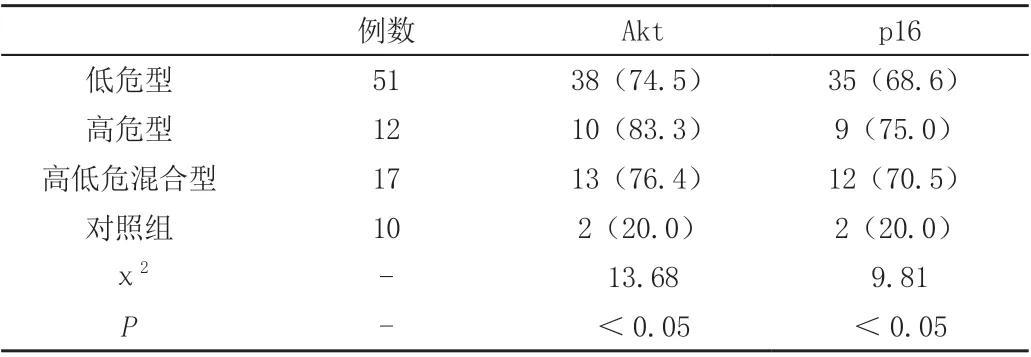
表1 各组p16、Akt 蛋白阳性率比较[n(%)]
3.2 尖锐湿疣复发组Akt、p16 的评分均高于未复发组,两组之间差异比较具有统计学意义,P <0.01,见表2。
表2 尖锐湿疣复发组与未复发组Akt、p16 的评分情况(±s)
例数Aktp16复发组311.95±0.422.11±0.38未复发组491.31±0.361.32±0.29 t-3.927.38 P-<0.01<0.01
4.讨论
尖锐湿疣是由人乳头瘤病毒(HPV)引起的皮肤性病科常见性病,临床表现主要为在生殖器及肛周附近的皮肤黏膜出现皮肤赘生物,患病率呈逐年上升的变化趋势。有关研究统计有半数以上的患者在初次治疗后可能会有尖锐湿疣的复发[1]。尖锐湿疣的具体复发原因目前并不明确,其可能与患者HPV潜伏感染、患者亚临床感染、细胞过度增生和机体的免疫功能发生异常等因素相关[2]。
我们临床上虽然治疗CA 方法有很多种,包括手术、药物、激光、冷冻、光动力疗法等,但是尖锐湿疣的复发率还是较高,CA 复发的具体原因目前尚未完全阐释清楚,CA 的易复发性可能与细胞过度增殖、HPV 感染型别、亚临床感染和机体免疫状态紊乱等相关联。有文献显示,HPV 亚型混合感染的CA 患者复发率要高于单一亚型感染的CA 患者。并且发现高危型+低危型是主要引起复发的一种感染模式[3]。因此,HPV 亚型混合感染有可能是引起患者复发的重要原因之一[4]。探究其原因,我们认为,HPV 亚型混合感染可能更易造成机体局部免疫紊乱,从而干扰表皮细胞正常的生长周期,导致局部细胞凋亡不足。
p16 基因又叫MTS(multiple tumor suppressor 1)基因,负调节细胞增殖及分裂,有人把它比作细胞周期中的刹车装置,一旦失灵则会导致细胞增殖,导致肿瘤发生[5]。在宫颈癌研究中,p16 蛋白在宫颈癌中表达量明显升高,考虑p16 的高表达与HPV感染有关。在正常细胞周期调控过程中,p16 通过视网膜细胞瘤蛋白(Rb 蛋白)发挥作用[6]。而在HPV 感染时,HPV 病毒基因E7 与PRb 结合,导致p16 蛋白反馈性增高,但此时p16 的生理功能却丧失[7]。本研究发现p16 在高危型患者阳性率为75.0%,高低危混合型为70.5%,低危型为78.6%,正常对照组为20%,各组之间比较差异具有统计学意义,复发组评分2.11±0.38,未复发组评分1.32±0.29,两组比较差异具有统计学意义,本研究发现尖锐湿疣的复发可能与p16 蛋白反馈性增高,失去了正常的抑制细胞生长周期的功能。
Demeter、冯进云等[8,9]研究显示CA 皮损的表皮细胞发生比较明显的细胞增殖,除基底细胞层外,发现棘层甚至颗粒层细胞均有增殖活性,而表皮细胞凋亡却没有相应的增加。从而容易导致皮损的复发。Akt 是一种丝氨酸/苏氨酸蛋白激酶,又称为蛋白激酶B(protein kinase,PKB)。活化的Akt 可以产生抑制细胞凋亡的作用,从而促进细胞周期运行[10,11]。本研究发现Akt 高危型患者阳性率为83.3%,高低危混合型为76.4%,低危型为74.5,正常对照组为20%,各组之间比较差异具有统计学意义,说明HPV 感染Akt 表达高于正常人,而Akt 的过表达可能可以抑制细胞凋亡的发生,而且高危型和高低危混合型均高于低危型,说明这两组患者可能更易复发,在临床治疗中应更加重视此类患者的治疗,并且我们发现,在复发的尖锐湿疣患者中Akt 评分1.95±0.42,高于未复发组评分1.31±0.36,差异具有统计学意义,进一步证明了Akt可能参与了CA的临床复发,我们推测HPV 可能通过抑制细胞凋亡,使细胞永生化,从而逃避宿主的清除,从而引起尖锐湿疣的复发。
总之,本项目研究各发现尖锐湿疣复发患者的Akt、p16的表达水平高于未复发者,说明尖锐湿疣的复发可能与皮损中Akt、p16 蛋白的过表达存在关联,为临床上尖锐湿疣起病原因、疾病转归、疾病的防御及治疗提供更扎实的理论基础。

