猪USP18基因表达规律及其与产仔数性状的关联分析
周泉勇 万明春 季华员 刘晨龙 方绍培 黄江南


摘要:【目的】明確泛素特异性蛋白酶18基因(USP18)在猪不同妊娠时期子宫内膜中的表达规律及其与雌激素和孕激素的关系,并分析其多态性与产仔数性状的关联性,为揭示USP18基因在猪妊娠过程中的作用机理提供参考依据。【方法】PCR扩增猪USP18基因编码区(CDS)序列及开展相关生物信息学分析,利用实时荧光定量PCR检测USP18基因在梅山猪和大白猪妊娠15、26和50 d子宫内膜中的表达水平,通过体外细胞试验检测分析雌二醇和孕酮联合处理对子宫内膜上皮细胞USP18基因表达的影响,并采用PCR-RFLP和SPSS 19.0检测猪USP18基因多态性与产仔数性状的关联性。【结果】猪USP18基因CDS序列为966 bp,共编码322个氨基酸残基,编码蛋白分子量为37 kD,理论等电点(pI)为6.74;猪USP18氨基酸序列与牛USP18氨基酸序列的同源性为82%,二者的遗传距离最近。USP18基因在妊娠15和26 d梅山猪和大白猪子宫内膜中的相对表达量均明显高于妊娠50 d,且在妊娠26和50 d,USP18基因在梅山猪子宫内膜组织中的相对表达量显著高于在大白猪子宫内膜组织中的相对表达量(P<0.05,下同)。以10-10 mol/L雌二醇和10-8 mol/L孕酮联合处理子宫内膜上皮细胞,USP18基因在子宫内膜上皮细胞中的相对表达量呈上调趋势,且显著高于激素处理前的相对表达量。在猪USP18基因CDS序列953 bp处存在1个SNP位点(T/G错义突变),其不同基因型与产仔数性状的关联分析结果表明,在经产母猪中,TG基因型母猪产活仔数最多,GG基因型母猪产活仔数最少,且差异显著。【结论】猪USP18基因在附植期子宫内膜中高水平表达,且在子宫内膜上皮细胞中的表达受雌激素和孕激素诱导,表明USP18基因在妊娠早期建立过程中发挥着重要作用。USP18基因在梅山猪和大白猪间的差异表达可能是导致梅山猪产仔数高于大白猪的一个重要因素。
关键词: 猪;USP18基因;子宫内膜;上皮细胞;妊娠;激素
中图分类号: S828.81 文献标志码: A 文章编号:2095-1191(2020)07-1714-07
Abstract:【Objective】The aim of study was to clarify the expression of porcine ubiquitin specific peptidase 18 gene(USP18) in Meishan pig and Yorkshire pig endometrium during different gestation stages, examine the relationship between its expression and estrogen and progesterone,analyze the association between USP18 gene polymorphism and li-tter size, and thus to provide important data for revealing the role of USP18 gene in the process of pregnancy. 【Method】The PCR was used to amplify protein coding region(CDS) of USP18 gene, and bioinformatics analysis was conducted. Real-time fluorescence quantitative PCR was used to analyze the USP18 gene expression level in endometrium of Meishan pig and Yorkshire pig on 15 d, 26 d and 50 d of pregnancy. The cell transfection technology was used to detected the effect of estradiol and progesterone on the USP18 gene expression in endometrial epithelial cells. The polymerase chain reaction-restriction fragment length polymorphism(PCR-RFLP) and SPSS 19.0 software were used to analyze the association between the gene polymorphism of USP18 and reproductive traits. 【Result】The CDS sequence of pig USP18 gene was 966 bp. It encoded 322 amino acids, and the molecular weight and the isoelectric point(pI) were 37 kD and 6.74 respectively. Amino acid sequence of USP18 protein had 82% similarity with cattle, and their genetic distance was the nearest. The expression level of USP18 gene on day 15 and day 26 of pregnancy were higher compared with day 50 of pregnancy both in Meishan and Yorkshire endometriums, and the expression in Meishan pig endometrium was significantly higher than in Yorkshire pig endometriums both on day 26 and day 50 of pregnancy(P<0.05, the same below). Moreover, treating with 10-10 mol/L estradiol and 10-8 mol/L progesterone in endometrial epithelial cells, the expression of USP18 was induced and was significantly higher than that before hormone treatment. Gene polymorphism analysis indica-ted that USP18 CDS sequence had a SNP site(T/G missense mutation) at 953 bp. The association analysis between various genotypes and litter size traits indicated that among multiparous sows, TG genotpye sows had the largest litter size and GG genotpye sows had the smallest litter size, and with significant difference. 【Conclusion】USP18 gene has high level expression in endometriums during implantation and is induced by estrogen and progesterone. This results indicates that USP18 may play important roles in the establishment of early pregnancy. And the differential expression in endometrium between Meishan pig and Yorkshire pig may be an important reason which leads to the litter size of Meishan pig higher than Yorkshire pig.
Key words: pig; USP18 gene; endometrium; epithelial cells; gestation; hormone
Foundation item: Jiangxi Pig Industry Technology System Construction Project(JXARS-01); Agricultural Research Collaborative Innovation Special Funds of Jiangxi(JXXTCX2015004-001)
0 引言
【研究意义】猪附植期胚胎死亡数通常占整个妊娠期胚胎死亡总数的50%以上,且很大程度上决定了实际窝产仔数(Tayade et al.,2007)。梅山猪是我国优良的地方品种,也是目前世界公认的高产品种(尹洛蓉等,2011;周艳红等,2015),在附植期间其胚胎死亡率约11%,而大白猪的胚胎死亡率高达31%(Bazer et al.,1988;Ashworth et al.,1997)。胎儿对于母体而言是半同种异基因移植物,其成功附植且不被排斥导致死亡与附植期子宫内膜容受性的建立密切相关(Simón et al.,2000)。妊娠早期,子宫在雌激素和孕激素的协同调控下,通过一系列信号分子的表达变化,促使子宫内膜形态及其功能发生改变,从而促进子宫内膜与胎儿相互作用,是胎儿成功附植的关键(Daikoku et al.,2011;付言峰等,2018)。因此,加强附植期子宫内膜相关基因表达及调控研究,可为提高胚胎存活率和母猪窝产仔数提供理论依据。【前人研究进展】已有研究显示,干扰素在哺乳动物的妊娠识别和维持过程中发挥着重要作用,是通过调控妊娠信号识别、子宫内膜血管发育及免疫基因表达等方式,促使子宫内膜形成一个可接受的植入环境(Bazer et al.,2008,2009)。泛素特异性蛋白酶18(Ubiquitin specific peptidase 18,USP18)是泛素特异性蛋白酶家族成员之一,是一种Ι型干扰素诱导调控因子(姚敏,2018)。USP18基因转录启动子位于干扰素刺激应答反应元件内,因此干扰素可强烈诱发机体表达USP18基因。对多种疾病和癌症的研究发现,USP18通过不同信号通路反向调节Ι型干扰素在先天免疫中发挥重要作用(Kim et al.,2005;Yan et al.,2007);尤其在癌细胞中,USP18基因下调表达可抑制体外肿瘤细胞增殖及体内肿瘤生长,显著降低癌细胞的转移和侵袭能力(Cai et al.,2017)。此外,USP18基因表达下调能抑制血管生成(Burkart et al.,2013)。胚胎附植与肿瘤发生具有极高的相似性,均是细胞发生增殖、迁移及生理性侵袭的生物学过程。在敲除USP18基因的小鼠中,USP18基因缺失使得胎儿植入位点子宫内膜的血管大量减少,胚胎发育中止,进而导致胎儿死亡(Rempel et al.,2007)。在哺乳动物的正常妊娠过程中,USP18基因在妊娠早期子宫内膜中的表达水平明显高于非妊娠期(Bauersachs et al.,2006;Forde et al.,2011),而在致病性腹泻病毒感染导致的妊娠期胚胎死亡及子宫内膜异位症导致的繁殖障碍中,均发现子宫内膜中的USP18基因表达水平显著降低(Kiba et al.,2015;Cheng et al.,2017)。说明妊娠期间子宫内膜中USP18基因的表达变化可能与胎儿存活密切相关。【本研究切入点】目前,有关USP18基因的研究主要集中在人类、鼠和牛等物种,而针对猪的研究鲜见报道。【拟解决的关键问题】PCR扩增猪USP18基因编码区(CDS)序列,利用实时荧光定量PCR检测USP18基因在梅山猪和大白猪不同妊娠时期子宫内膜中的表达变化,通过体外细胞试验分析雌激素和孕激素对子宫内膜上皮细胞中USP18基因表达的影响,并开展与产仔数性状的关联分析,为揭示USP18基因在猪妊娠过程中的作用机理提供参考依据。
1 材料与方法
1. 1 试验材料
选取梅山猪和大白猪初产母猪各6头,配种后于妊娠15、26和50 d分别进行屠宰。妊娠15 d母猪采用PBS冲洗子宫法确认是否怀孕,然后随机选取位置收集子宫内膜组织,妊娠26和50 d母猪收集附植点子宫内膜组织,采集的样本經液氮冷冻后置于-80 ℃冰箱保存。收集广东华农温氏畜牧股份有限公司水台猪场277头产6胎以上生产母猪的产活仔数(NBA)、总产仔数(TNB)及初生重(BW)等信息,并采集耳组织样品,浸泡于75%乙醇中备用。用于细胞试验的子宫内膜上皮细胞由计划生育生殖生物学国家重点实验室惠赠;RNA提取试剂盒购自天根生化科技(北京)有限公司,反转录试剂盒购自美国Promega公司,PCR纯化试剂盒购自北京百特生物科技有限公司,内切酶Bcc I购自MBI Fermentas公司,雌二醇和孕酮购自Sigma公司,SYBR Green Real-time PCR Master Mix试剂盒购自日本TOYOBO公司。
1. 2 组织DNA和RNA提取
采用苯酚—氯仿法提取组织DNA,以总RNA提取试剂盒(DP431)提取总RNA。提取的DNA和RNA采用Thermo Scientific公司的NanoDrop 2000核酸蛋白测定仪测定其浓度。
1. 3 基因表达检测样本制备
向DEPC处理无RNase污染的0.2 mL离心管中加入2.0 μg总RNA、0.4 μg Oligo(dT)引物和0.1 μg随机引物,70 ℃温育5 min,迅速置于冰上,然后依次加入10.0 μL 5×反转录缓冲液、2.5 μL 10 mmol/L dNTP Mix、1.0 μL RNase Inhibitor及1.5 μL M-MLV反转录酶(200 U/μL)。样品混匀离心后37 ℃温育10 min,42 ℃孵育50 min,85 ℃温育5 min。反转录合成的cDNA置于-20 ℃保存备用。
1. 4 引物设计与合成
在GenBank中搜索猪USP18基因核苷酸序列,使用Primer Premier 5.0设计USP18基因检测用引物(表1),委托上海英骏生物技术有限公司合成。
1. 5 PCR扩增、测序及生物信息学分析
PCR反应体系25.0 ?L:cDNA模板1.0 ?L(约50 ng),上、下游引物(10 ?mol/L)各1.0 ?L,dNTPs(10 mmol/L)2.0 ?L,10×PCR Buffer 2.5 ?L,Taq DNA聚合酶(5 U/?L)0.2 ?L,滅菌水17.3 ?L。扩增程序:95 ℃预变性5 min;94 ℃ 40 s,56 ℃ 40 s,72 ℃ 30 s,进行38个循环;72 ℃延伸10 min。扩增产物经凝胶电泳检测后进行回收测序,对测序结果进行拼接,通过NCBI网站的ORF Finder搜索猪USP18基因CDS序列,并进行同源性比对分析。在NCBI网站中搜索人类、小鼠、大鼠、牛、狗及黑猩猩的USP18氨基酸序列,利用DNASTAR中的MegAlign构建系统发育进化树。
1. 6 实时荧光定量PCR检测USP18基因表达情况
实时荧光定量PCR反应体系20.0 ?L:cDNA模板0.8 ?L,SYBR Green I Mix 10.0 ?L,上、下游引物各0.4 μmol/L,以无核酸水补足至20.0 ?L。混匀离心后使用ABI 7300实时定量PCR仪同时扩增USP18基因和TBP1基因(内参),扩增程序:95 ℃预变性10 s;95 ℃ 15 s,60 ℃ 30 s,进行40个循环;95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s,60 ℃ 1 min。使用USP18基因与TBP1基因的平均Ct差值ΔCt计算USP18基因的相对表达量,再以ΔCt减去ΔCt最大值得到ΔΔCt,通过2-ΔΔCt法分析USP18基因的差异表达情况。
1. 7 细胞培养及转染
常规方法培养细胞至良好状态,用含Hyclone胎牛血清(去激素血清)的无酚红培养基继续培养3 d后,传代至6孔板。分别设试验组和对照组,每组设3个重复,其中,对照组添加0.03%乙醇,试验组添加10-10 mol/L雌二醇和10-8 mol/L孕酮。培养12、24和48 h后,收集细胞并提取RNA,采用实时荧光定量PCR检测USP18基因的表达量。
1. 8 PCR-RFLP基因分型及产仔数性状关联分析
扩增产物检测合格后,65 ℃下酶切消化过夜。酶切体系10.0 ?L:扩增模板3.0 ?L,内切酶(10 U/?L)1.5 ?L,灭菌水5.5 ?L。酶切产物经3%琼脂糖凝胶电泳检测分型后,统计基因型数据,使用SPSS 19.0中的一般线性模型(GLM)对母猪产仔数性状与SNP位点分型结果进行最小二乘法分析。一般线性模型为:yi=μ+αi+pk+ei,式中,yi为性状值,μ为总体平均数,αi为基因型效应值(i=GG,TG,TT),pk为胎次效应(按初产和经产划分),ei为随机误差。
2 结果与分析
2. 1 猪USP18基因序列分离及氨基酸同源性分析结果
利用引物U-CDS1和U-CDS2分别扩增猪USP18基因cDNA序列,克隆测序后拼接得到完整的CDS序列(966 bp),编码322个氨基酸残基,编码蛋白分子量为37 kD,理论等电点(pI)为6.74。与人类及鼠、牛等其他哺乳动物进行USP18氨基酸同源性比对分析,结果(表2)发现猪USP18氨基酸序列与牛和狗的USP18氨基酸序列同源性最高,均为82%;与人类和猩猩的USP18氨基酸序列同源性分别为76%和75%;与小鼠和大鼠的USP18氨基酸序列同源性均为68%。利用MegAlign进行系统发育进化分析,结果(图1)也显示猪与牛的遗传距离最近。
2. 2 猪妊娠期子宫内膜组织中USP18基因表达水平检测结果
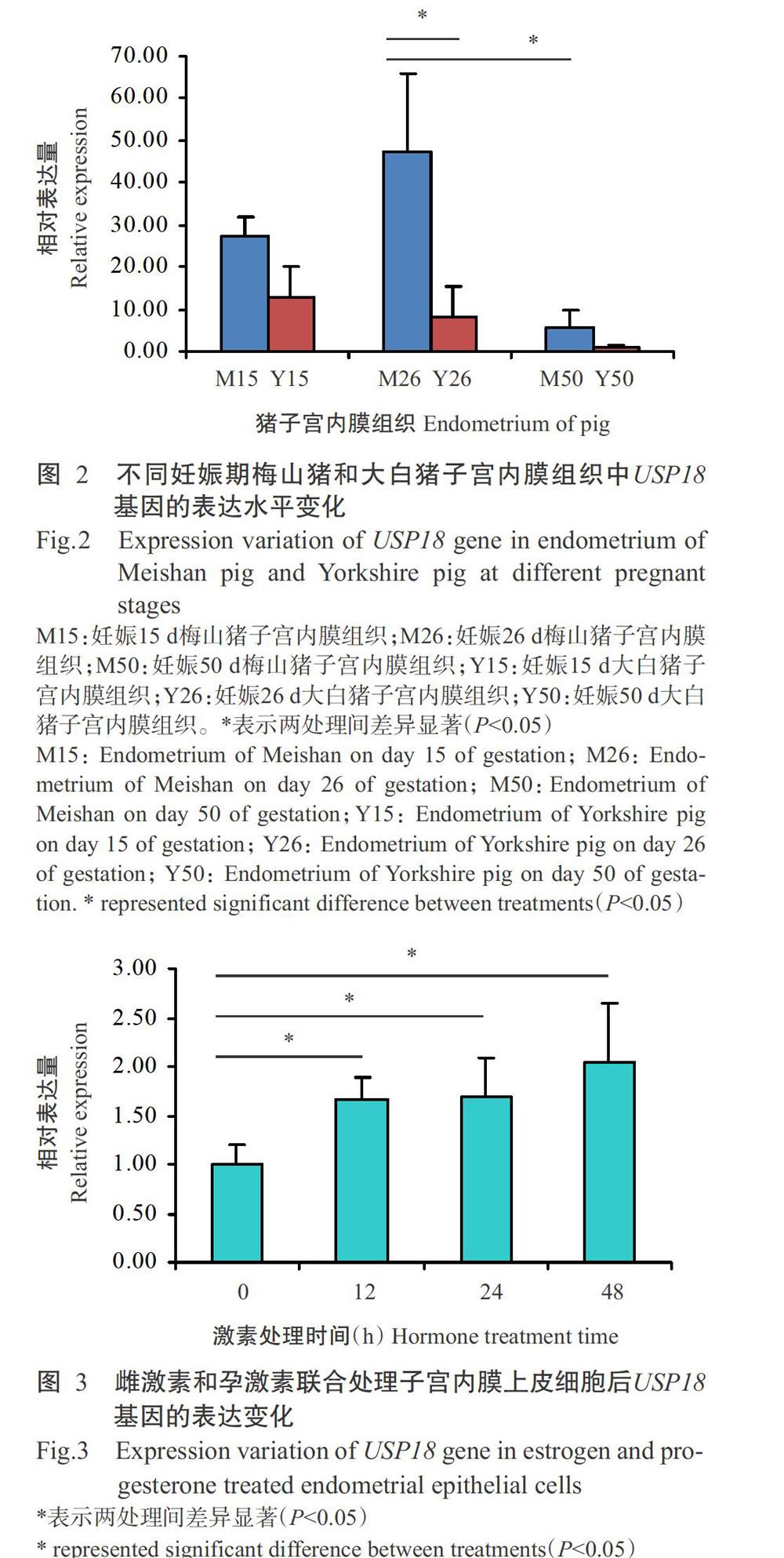
利用实时荧光定量PCR检测妊娠15、26和50 d梅山猪和大白猪子宫内膜组织中USP18基因的表达水平,结果(图2)显示,USP18基因在妊娠15和26 d梅山猪和大白猪子宫内膜中的相对表达量均明显高于妊娠50 d,且在妊娠26和50 d,USP18基因在梅山猪子宫内膜组织中的相对表达量显著高于在大白猪子宫内膜组织中的相对表达量(P<0.05,下同)。
2. 3 激素处理子宫内膜上皮细胞后USP18基因的表达变化情况
以10-10 mol/L雌二醇和10-8 mol/L孕酮联合处理子宫内膜上皮细胞,在处理0、12、24和48 h后分别收集上皮细胞,提取其RNA,再利用实时荧光定量PCR检测USP18基因的表达水平。结果(图3)显示,激素处理12、24和48 h后USP18基因在子宫内膜上皮细胞中的相对表达量呈上调趋势,且显著高于激素处理前的相对表达量。
2. 4 猪USP18基因SNP位点验证及其与产仔数性状的关联分析结果
对猪USP18基因测序结果进行比对分析,结果(图4)发现在猪USP18基因CDS序列953 bp处存在1个SNP位点(T/G错义突变),导致氨基酸序列第318位由甲硫氨酸(Met)突变为精氨酸(Arg),且被内切酶Bcc I所识别。利用引物U-Bcc I扩增包含SNP位点的基因序列并进行酶切,GG基因型的酶切产物大小为150 bp,TT基因型的酶切产物大小为127 bp(图5)。进一步利用PCR-RFLP检测USP18基因T953G位点在277头长白母猪中的基因型,并以SPSS 19.0分析不同基因型与产仔数性状的关联性,结果表明,在初产母猪中,USP18基因T953G位点不同基因型母猪在总产仔数、产活仔数和初生重性状中不存在显著差异(P>0.05);而在经产母猪中,TG基因型母猪产活仔数最多,GG基因型母猪产活仔数最少,且差异显著(表3)。
3 讨论
胎儿在附植过程中会导致子宫内膜产生免疫反应。正常妊娠状态下,子宫内膜中的淋巴细胞由Th1型向Th2型转换,对胎儿存活并成功附植极其关键(Raghupathy et al.,2000)。Th1细胞诱导超敏反应,抑制胚胎在子宫内附植;而Th2细胞促进抗体形成,抑制免疫炎症,有利于胚胎着床和发育(Aluvihare et al.,2004)。USP18基因是动物体内免疫调节的重要功能基因。在乳腺上皮細胞中,USP18基因缺失会导致Th1细胞趋化因子基因Cxcl10表达增加,从而募集Th1型T淋巴细胞(Burkart et al.,2013)。Tnf-α是Th1型细胞分泌的细胞因子之一,其过量表达会抑制胚胎着床,导致妊娠终止(Li et al.,2017)。USP18基因表达水平上升,可有效抑制Tnf-α表达(MacParland et al.,2016;Shaabani et al.,2018)。说明附植期间USP18基因在子宫内膜中的高水平表达可能有利于胚胎附植。在牛的相关研究中也发现,USP18基因在附植期子宫内膜中的表达水平明显高于非妊娠时期(Bauersachs et al.,2006;Forde et al.,2011)。本研究利用实时荧光定量PCR检测分析USP18基因在母猪妊娠15、26和50 d子宫内膜中的表达变化,结果发现USP18基因在妊娠15和26 d梅山猪和大白猪子宫内膜中的相对表达量均明显高于妊娠50 d。在妊娠过程中,USP18基因在附植时期子宫内膜中的高水平表达是胎儿附植和妊娠建立的关键。
丰富的血管有助于子宫内膜对胎儿胎盘的营养供给,从而提高胚胎存活率(Argente et al.,2006)。相对于大白猪等外来品种,梅山猪在妊娠26和50 d的胚胎正常附植点血管丰度明显更高,可能是导致梅山猪产仔数高于大白猪的一个重要因素(张高英,2009)。已有研究表明,USP18基因可通过抑制Ι型干扰素信号通路而促进血管生成(Hsu et al.,2017)。本研究结果也表明,USP18基因在梅山猪和大白猪附植期子宫内膜中的相对表达量均高于附植完成期,且在妊娠26和50 d梅山猪子宫内膜组织中的相对表达量显著高于在大白猪子宫内膜组织中的相对表达量。由此推测,USP18基因通过参与妊娠早中期子宫内膜血管发育从而影响胎儿存活。
雌激素和孕激素在妊娠建立过程中发挥着重要作用。在母猪妊娠早期,雌激素和孕激素分泌阶段性增加,且梅山猪附植期高胚胎存活率与雌激素和孕激素的高分泌水平密切相关(Hunter et al.,1996)。已有研究显示,雌激素和孕激素通过协同作用,可有效诱导子宫内膜中Th1型细胞向Th2型细胞转化,且在妊娠期间雌激素和孕激素水平的增加与血管形成密切相关(Liu et al.,2002;Salem,2004)。Satterfield等(2009)通过体外注射孕酮,发现在羊妊娠12 d的子宫内膜组织中USP18基因表达水平显著增加。本研究通过体外细胞试验检测雌二醇和孕酮联合处理对子宫内膜上皮细胞USP18基因表达的影响,结果显示,雌二醇和孕酮联合作用可有效诱导子宫内膜上皮细胞中USP18基因的表达。可见,在妊娠早期,雌激素和孕激素的高分泌水平有助于提高子宫内膜中USP18基因的表达,但是否存在剂量依赖性还有待进一步探究。
Bauersachs等(2006)、Forde等(2011)研究发现,牛USP18基因在附植期子宫内膜中的表达水平明显高于非妊娠时期,故推测USP18基因在牛子宫内膜中可作为检测子宫内膜容受性的分子标记。Shen等(2014)同样发现在猪妊娠14 d外周血中USP18基因的表达量显著高于非妊娠状态,说明其与早期妊娠密切相关。本研究也发现USP18基因在猪附植期子宫内膜中呈高水平表达,且在梅山猪中的表达水平高于大白猪,表明USP18基因在猪妊娠早期发挥着重要作用。基于此,本研究进一步对测序筛选获得的USP18基因T953G位点进行产仔数性状关联分析,结果发现在经产母猪中USP18基因T953G位点TG基因型母猪的产仔数和产活仔数均最多,且在产活仔数性状方面存在显著差异。但本研究的猪个体数量较少,因此还需加大样本数量进一步验证结果的可靠性。
4 结论
猪USP18基因在附植期子宫内膜中高水平表达,且在子宫内膜上皮细胞中的表达受雌激素和孕激素诱导,表明USP18基因在妊娠早期建立过程中发挥着重要作用。USP18基因在梅山猪和大白猪间的差异表达可能是导致梅山猪产仔数高于大白猪的一个重要因素。
参考文献:
付言峰,李兰,Knox R V,李碧侠,方晓敏,任守文. 2018. 猪脂肪沉积和胚胎附植期FTO基因的表达及碱基突变检测[J]. 江苏农业学报,34(3):591-598. [Fu Y F,Li L,Knox R V,Li B X,Fang X M,Ren S W. 2018. Detection of FTO expression and SNPs during fat deposition and embryo implantation in pigs[J]. Jiangsu Journal of Agricultural Sciences,34(3):591-598.]
姚敏. 2018. 泛素特异性蛋白酶USP18在HBV病毒感染中的作用及其机制研究[D]. 北京:中国医学科学院北京协和医学院. [Yao M. 2018. The role of ubiquitin specific protease 18 in hepatitis B virus infection and its under-lying mechanism[D]. Beijing:Chinese Academy of Me-dical Sciences & Peking Union Medical College.]
尹洛蓉,李學伟,吕学斌,朱汉春,应三成. 2011. 梅山猪多产性研究[J]. 西南大学学报(自然科学版),33(8):37-41. [Yin L R,Li X W,Lü X B,Zhu H C,Ying S C. 2011. Investgation of ptolificacy of Meishan pigs[J]. Journal of Southwest University(Natural Science Edition),33(8):37-41.]
张高英. 2009. 妊娠早中期大白猪与梅山猪子宫免疫特征研究[D]. 武汉:华中农业大学. [Zhang G Y. 2009. Study on the uterine immune character of Large White and Meishan pigs at early and midgestation[D]. Wuhan:Huazhong Agricultural University.]
周艳红,付言峰,赵为民,刘红林,任守文. 2015. 胚胎附植期梅山猪EphrinA1全编码区克隆及生物信息学分析[J]. 江苏农业学报,31(2):350-356. [Zhou Y H,Fu Y F,Zhao W M,Liu H L,Ren S W. 2015. Coding sequence cloning and bioinformatics analysis of EphrinA1 during embryo implantation in Meishan swine[J]. Jiangsu Journal of Agricultural Sciences,31(2):350-356.]
Aluvihare V R,Kallikourdis M,Betz A G. 2004. Tolerance,suppression and the fetal allograft[J]. Journal of Molecular Medicine(Berlin),83(2):88-96.
Argente M J,Santacreu M A,Climent A,Blasco A. 2006. Influence of available uterince space per fetus on fetal development and prenatal survival in rabbits selected for uterine capacity[J]. Livestock Science,102(1-2):83-91.
Ashworth C J,Pickard A R,Miller S J,Flint A P,Diehl J R. 1997. Comparative studies of conceptus-endometrial interactions in Large White×Landrace and Meishan gilts[J]. Reproduction,Fertility,and Development,9(2):217-225.
Bauersachs S,Ulbrich S E,Gross K,Schmidt S E M,Meyer H H D,Wenigerkind H,Vermehren M,Sinowatz F,Blum H,Wolf E. 2006. Embryo-induced transcriptome changes in bovine endometrium reveal species-specific and common molecular markers of uterine receptivity[J]. Reproduction,132(2):319-331.
Bazer F W,Burghardt R C,Johnson G A,Spencer T E,Wu G. 2008. Interferons and progesterone for establishment and maintenance of pregnancy:Interactions among novel cell signaling pathways[J]. Reproductive Biology,8(3):179-211.
Bazer F W,Spencer T E,Johnson G A. 2009. Interferons and uterine receptivity[J]. Seminars in Reproductive Medicine,27(1):90-102.
Bazer F W,Thatcher W W,Martinat-Botte F,Terqui M. 1988. Conceptus development in Large white and prolific Chinese Meishan pigs[J]. Journal of Reproduction and Fertility,84 (1):37-42.
Burkart C,Arimoto K,Tang T D,Cong X L,Xiao N M,Liu Y C,Kotenko S V,Ellies L G,Zhang D E. 2013. Usp18 deficient mammary epithelial cells create an antitumour environment driven by hypersensitivity to IFN-λ and elevated secretion of Cxcl10[J]. EMBO Molecular Medecine,5(7):1035-1050.
Cai J,Liu T D,Jiang X L,Guo C K,Liu A W,Xiao X L. 2017. Downregulation of USP18 inhibits growth and induces apoptosis in hepatitis B virus-related hepatocellular carcinoma cells by suppressing BCL2L1[J]. Experimental Cell Research,358(2):315-322.
Cheng Z R,Chauhan L,Barry A T,Abudureyimu A,Oguejiofor C F,Chen X,Wathes D C. 2017. Acute bovine viral diarrhea virus infection inhibits expression of interferon tau-stimulated genes in bovine endometrium[J]. Biology of Reproduction,96(6):1142-1153.
Daikoku T,Cha J,Sun X F,Tranguch S,Xie H R,Fujita T,Hirota Y,Lydon J,DeMayo F,Maxson R,Dey S K. 2011. Conditional deletion of Msx homeobox genes in the uterus inhibits blastocyst implantation by altering uterine receptivity[J]. Developmental Cell,21(6):1014-1025.
Forde N,Carter F,Spencer T E,Bazer F W,Sandra O,Mansouri-Attia N,Okumu L A,McGettigan P A,Mehta J P,McBride R,O'Gaora P,Roche J F,Lonergan P. 2011. Conceptus-induced changes in the endometrial transcriptome: How soon does the cow know she is pregnant? [J]. Biology of Reproduction,85(1):144-156.
Hsu K S,Zhao X,Cheng X W,Guan D Y,Mahabeleshwar G H,Liu Y,Borden E,Jain M K,Kao H Y. 2017. Dual regulation of Stat1 and Stat3 by the tumor suppressor protein PML contributes to interferon α-mediated inhibition of angiogenesis[J]. The Journal of Biological Chemistry,292(24):10048-10060.
Hunter M G,Picton H M,Biggs C,Mann G E,McNeilly A S,Foxcroft G R.1996. Periovulatory endocrinology in high ovulating Meishan sows[J]. The Journal of Endocrinology,150(1):141-147.
Kiba A,Banno K,Yanokura M,Asada M,Nakayama Y,Aoki D,Watanabe T. 2015. Differential mRNA expression profiling in ovarian endometriotic tissue with versus without leuprolide acetate treatment[J]. The Journal of Obstetrics and Gynaecology Research,41(10):1598-1606.
Kim K I,Malakhova O A,Hoebe K,Yan M,Beutler B,Zhang D E. 2005. Enhanced antibacterial potential in UBP43-deficient mice against Salmonella typhimurium infection by up-regulating type I IFN signaling[J]. Journal of Immunology,175(2):847-854.
Li L,Tu J,Jiang Y,Zhou J,Schust D J. 2017. Regulatory T cells decrease invariant natural killer T cell-mediated pregnancy loss in mice[J]. Mucosal Immunology,10(3):613-623.
Liu H Y,Buenafe A C,Matejuk A,Ito A,Zamora A,Dwyer J,Vandenbark A A,Offner H. 2002. Estrogen inhibition of EAE involves effects on dendritic cell function[J]. Journal of Neuroscience Research,70(2):238-248.
MacParland S A,Ma X Z,Chen L,Khattar R,Cherepanov V,Selzner M,Feld J J,Selzner N,McGilvray I D. 2016. Lipopolysaccharide and tumor necrosis factor alpha inhibit interferon signaling in hepatocytes by increasing ubiquitin-like protease 18(USP18) expression[J]. Journal of Virology,90(12):5549-5560.
Raghupathy R,Makhseed M,Azizieh F,Omu A,Gupta M,Farhat R. 2000. Cytokine production by maternal lymphocytes during normal human pregnancy and in unexplained recurrent spontaneous abortion[J]. Human Reproduction,15(3):713-718.
Rempel L A,Austin K J,Ritchie K J,Yan M,Shen M F,Zhang D E,Henkes L E,Hansen T R. 2007. Ubp43 gene expression is required for normal Isg15 expression and fetal development[J]. Reproductive Biology and Endocrinology,5:13. doi:10.1186/1477-7827-5-13.
Salem M L. 2004. Estrogen,a double-edged sword:Modulation of TH1- and TH2-mediated inflammations by differen-tial regulation of TH1/TH2 cytokine production[J]. Current Drug Targets. Inflammation and Allergy,3(1):97-104.
Satterfield M C,Song G,Kochan K J,Riggs P K,Simmons R M,Elsik C G,Adelson D L,Bazer F W,Zhou H J,Spencer T E. 2009. Discovery of candidate genes and pathways in the endometrium regulating ovine blastocyst growth and conceptus elongation[J]. Physiological Geno-mics,39(2):85-99.
Shaabani N,Honke N,Nguyen N,Huang Z,Arimoto K I,Lazar D,Loe T K,Lang K S,Prinz M,Knobeloch K P,Zhang D E,Teijaro J R. 2018. The probacterial effect of type I interferon signaling requires its own negative regulator USP18[J]. Science Immunology,3(27):eaau2125. doi:10.1126/sciimmunol.aau2125.
Shen J Y,Zhou C L,Zhu S,Shi W P,Hu M S,Fu X W,Wang C D,Wang Y C,Zhang Q,Yu Y. 2014. Comparative transcriptome analysis reveals early pregnancy-speci-fic genes expressed in peripheral blood of pregnant sows[J]. PLoS One,9(12):e114036.
Simón C,Martín J C,Pellicer A. 2000. Paracrine regulators of implantation[J]. Baillieres Best Practice and Research,14(5):815-826.
Tayade C,Fang Y,Croy B A. 2007. A review of gene expression in porcine endometrial lymphocytes,endothelium and trophoblast during pregnancy success and failure[J]. The Journal of Reproduction and Development,53(3):455-463.
Yan M,Luo J K,Ritchie K J,Sakai I,Takeuchi K,Ren R B,Zhang D E. 2007. Ubp43 regulates BCR-ABL leukemogenesis via the type 1 interferon receptor signaling[J]. Blood,110(1):305-312.
(責任编辑 兰宗宝)

