湖北和广西辣椒脉斑驳病毒的检测及遗传多样性分析
李桑桑 胡荣 罗香文 李诗君 卜珊 张宇 刘勇 张松柏
摘要:【目的】研究辣椒脉斑驳病毒(Pepper veinal mottle virus,PVMV)的分布及遗传变异,为明确该病毒在我国的流行扩散分子机制提供理论依据。【方法】利用特异性引物反转录PCR(RT-PCR)检测从湖北宜昌及广西南宁和百色采集的48份疑似感染PVMV的辣椒样本;采用常规Sanger测序测定PCR产物序列,序列采用MEGA 5.0构建系统发育进化树,采用RDP等算法分析其可能的重组事件;采用DnaSP v5分析病毒株系不同群体之间的基因流及基因差异。【结果】从48份辣椒样本中检测到5份样本被PVMV侵染,检出率10.42%。基因同源性比对分析结果表明,测定的PVMV湖北和广西分离物CP基因序列同源性在97.00%以上,与其他地区分离物的同源性为91.73%~98.78%。系统发育分析表明,湖北(YC)和广西(NN)PVMV分离物与我国台湾PVMV分离物的亲缘关系最近。重组分析表明,PVMV广西分离物NN10有2个重组事件。【结论】湖北和广西辣椒的PVMV检测结果表明,该病毒已扩散至湖北和广西;基因突变可能是PVMV湖北分离物遗传变异的主要方式之一;而基因重组和基因突变可能是PVMV广西分离物遗传变异的重要因子。
关键词: 辣椒脉斑驳病毒;RT-PCR;系统发育分析;重组;湖北;广西
中图分类号: S436.418.1 文献标志码: A 文章编号:2095-1191(2020)07-1693-06
Abstract:【Objective】This study aimed to define the distribution and genetic variation of Pepper veinal mottle virus(PVMV), the results would be contributed to understanding the dispersing molecular mechanism of PVMV in China. 【Method】PVMV was identified by specific primer reverse transcription PCR(RT-PCR) from 48 suspected pepper samples, which collected from Yichang in Hubei, and Nanning and Baise in Guangxi, and amplified products by PCR were sequenced by Sanger sequencing. The phylogenetic tree was constructed by MEGA 5.0. The recombinant events were analyzed by RDP algorithm. The gene flow and gene differentiation of different populations of PVMV isolates was analyzed by DnaSP v5. 【Result】There werefive PVMV positive pepper samples confirmed by RT-PCR among the 48 samples, and the incidence of PVMV in Hubei and Guangxi was 10.42%. According to gene homology detection, the sequences of CP genes of Hubei and Guangxi isolates shared over 97.00% identity with each other, and shared 91.72%-98.78% with isolates from others areas. Phylogenetic analysis showed the relationship of Hubei(YC) and Guangxi(NN) isolates had the closest relation isolates of Taiwan of China. There were two recombinant events detected in PVMV Guangxi isolate NN10. 【Conclusion】The survey and detection of PVMV shows that PVMV has infected pepper plants in Hubei and Guangxi.Gene mutation may be one of key patterns for evolution of PVMV Hubei isolates, and gene mutation and recombinant are probably key factors for PVMV guangxi isolates evolution.
Key words: Pepper veinal mottle virus; RT-PCR; phylogenetic analysis; recombination; Hubei; Guangxi
Foundation item: National Natural Science Foundation of China(317017765)
0 引言
【研究意义】辣椒脉斑驳病毒(Pepper veinal mottle virus,PVMV)是近年来我国辣椒上的一种新发病毒(Cheng et al.,2011; Zhang et al.,2016)。该病毒侵染辣椒,能导致辣椒整株矮缩、叶片畸形、叶脉暗绿,叶片、花易掉落,果实畸形或着色不均匀,严重影响辣椒的产品和品质(Tsai et al.,2010)。PVMV属马铃薯Y病毒属(Potyvirus)马铃薯病毒科(Potyviridae)成员,该属植物病毒寄主范围广,既能通过传毒介体蚜虫传播,也可通过病株汁液或机械接触方式传播,且传播速度快,危害严重(Rajam?ki et al.,2004)。因此,明確PVMV在我国辣椒主产区的发生情况及不同地区分离物的遗传变异,对于明确该病毒对我国辣椒的潜在威胁具有非常重要的意义。【前人研究进展】PVMV于1971年在加纳北部的辣椒和矮牵牛上首次被发现(Brunt et al.,1978),随后非洲南部多国报道PVMV侵染多种茄科重要作物,如番茄、辣椒、茄子和烟草等(Atiri,1986;Alegbejo,1999);此外,该病毒已蔓延到非洲西北部多国,严重影响辣椒和番茄的生产(Moury et al.,2005;Tsai et al.,2010;Arogundade et al.,2012)。在亚洲地区,我国台湾省首先报道该病毒危害辣椒和番茄(Cheng et al.,2009,2011),随后在我国其他地区也发现该病毒为害(Zhang et al.,2016;刘健等,2016;王莉爽等,2017)。目前,有关PVMV的研究主要集中在基因组序列测定与分析、病毒与寄主互作分子机制等方面。Zhang等(2015)研究表明,PVMV分离物存在明显的区域分化,侵染我国湖南省辣椒的PVMV分离物与我国台湾分离物的亲缘关系最近,湖南分离物可能是一个新颖的重组子。Akinyemi等(2016)采用高通量测序技术研究发现,PVMV与其他植物病毒共同侵染烟草,并组装了PVMV的全基因组序列。王莉爽等(2017)研究表明,贵州辣椒PVMV分离物与四川和云南分离物的亲缘关系最近,且存在明显的遗传变异。Bolou Bi等(2018)发现侵染辣椒的PVMV不同分离物存在明显的遗传分化。Laina等(2019)研究发现日本PVMV分离物与非洲分离物的亲缘关系最近。Moury等(2020)研究表明,寄主基因eIF4E2是PVMV复制所必须的寄主因子。以上研究表明,PVMV呈现快速扩展态势,且不同地区存在明显的遗传变异。【本研究切入点】虽然PVMV在我国多个省份发生为害,但在我国的具体分布及其分离物的遗传变异均需进一步研究。【拟解决的关键问题】湖南省植物保护研究所已报道PVMV湖南分离物全基因组序列(Zhang et al.,2015),以该基因组序列和GenBank中公布的其他PVMV全基因组序列为模板,设计特异性反转录PCR(RT-PCR)引物扩增PVMV CP基因,检测从湖北和广西采集的疑似感染PVMV的辣椒样本,明确PVMV的分布;采用常规Sanger测序测定PCR产物序列,分析序列的遗传变异,为揭示该病毒的流行扩散分子机制提供理论依据。
1 材料与方法
1. 1 试验材料
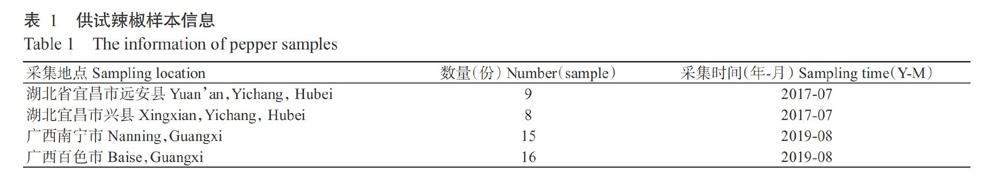
供试辣椒样本于2017年7月和2019年8月分别采集自湖北宜昌及广西南宁和百色。采集的辣椒样本有明显的病毒侵染症状,包括植株略矮化,叶片畸形、斑驳等。辣椒样本共计48份,相关信息见表1。
TRIzol试剂、一步法RT-PCR试剂盒和凝胶DNA回收试剂盒等均购自北京全式金生物技术有限公司。
1. 2 试验方法
1. 2. 1 总RNA抽提 辣椒叶片总RNA抽提采用TRIzol试剂,具体步骤参照说明书。
1. 2. 2 RT-PCR检测 采用Primer 5.0设计PVMV特异性PCR检测引物,以PVMV湖南分离物全基因组(GenBank登录号KR002568)为模板,设计扩增PVMV CP基因的特异性引物(CP-F:5'-AATTAAG CCATTGATTGACCA-3',CP-R:5'-AGCGCCAATTA TGAAACCGC-3')。PVMV特异性RT-PCR,采用一步法RT-PCR试剂盒,RT-PCR体系20.0 ?L:RNA模板1.0 ?L,dNTPs(10 mmol/L)1.0 ?L,随机六聚体引物(50 ?mol/L)1.0 ?L,PrimeScript II PCR Buffer 4.0 ?L,上、下游引物各0.5 ?L,反转录/聚合酶混合物0.5 ?L,RNase inhibitor(40 U/?L) 0.5 ?L,加RNase-free ddH2O至20.0 ?L。RT-PCR扩增程序:65 ℃ 5 min,42 ℃ 60 min,95 ℃ 5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,进行30个循环;72 ℃10 min,4 ℃保存。PCR产物采用1.5%琼脂糖凝胶电泳进行检测。
1. 2. 3 序列测定 采用凝胶DNA回收试剂盒回收PCR特异性条带,具体步骤参照说明书。回收纯化的PCR产物由生工生物工程(上海)股份有限公司采用常规Sanger测序技术测序。
1. 3 核苷酸序列分析
采用CLUSTAL W对PVMV不同分离物的CP基因序列进行多序列联配,采用MEGA 5.0构建最大似然法(Maximum-likelihood)系统发育进化树(Tamura et al.,2011)。利用MaxChi(Smith,1992)、GENECONV(Padidam et al.,1999)、SISCAN(Gibbs et al.,2000)、CHIMAERA(Posada and Crandall,2001)、RDP4软件的BOOTSCAN(Martin et al.,2015)和Recombination Detection Program(RDP)(Martin et al.,2015)进行PVMV不同分离物间的序列重组分析。PVMV不同分离物之间的序列突变采用MEGA 5.0分析最大可能性碱基替换(Tamura et al.,2011)。采用DnaSP v5分析PVMV不同群体之间的基因流及基因差异(Librado and Rozas,2009)。
2 结果与分析
2. 1 PVMV检出率
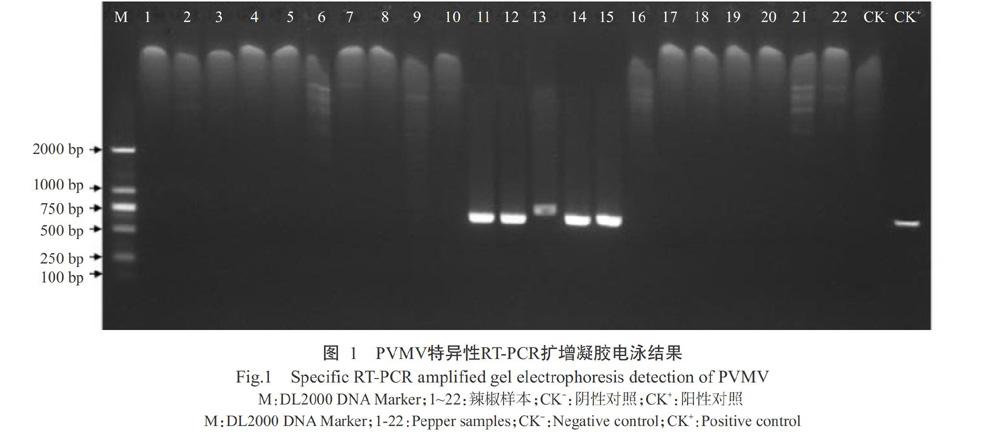
对湖北和广西的48份辣椒样本进行RT-PCR检测,得到大小为761 bp的特異性条带,与预期结果一致(图1)。共有5份PVMV阳性样本被检出,其中宜昌远安县2份,其他3个地区各1份。湖北和广西辣椒的PVMV检出率为10.42%。
2. 2 PVMV序列系统发育分析结果
将测定的PVMV湖北和广西分离物的CP基因序列片段在GenBank中进行核苷酸序列BLAST比对,结果表明,PVMV湖北和广西分离物的CP基因序列之间的同源性在97.00%以上,与其他地区分离物的同源性为91.73%~98.78%。
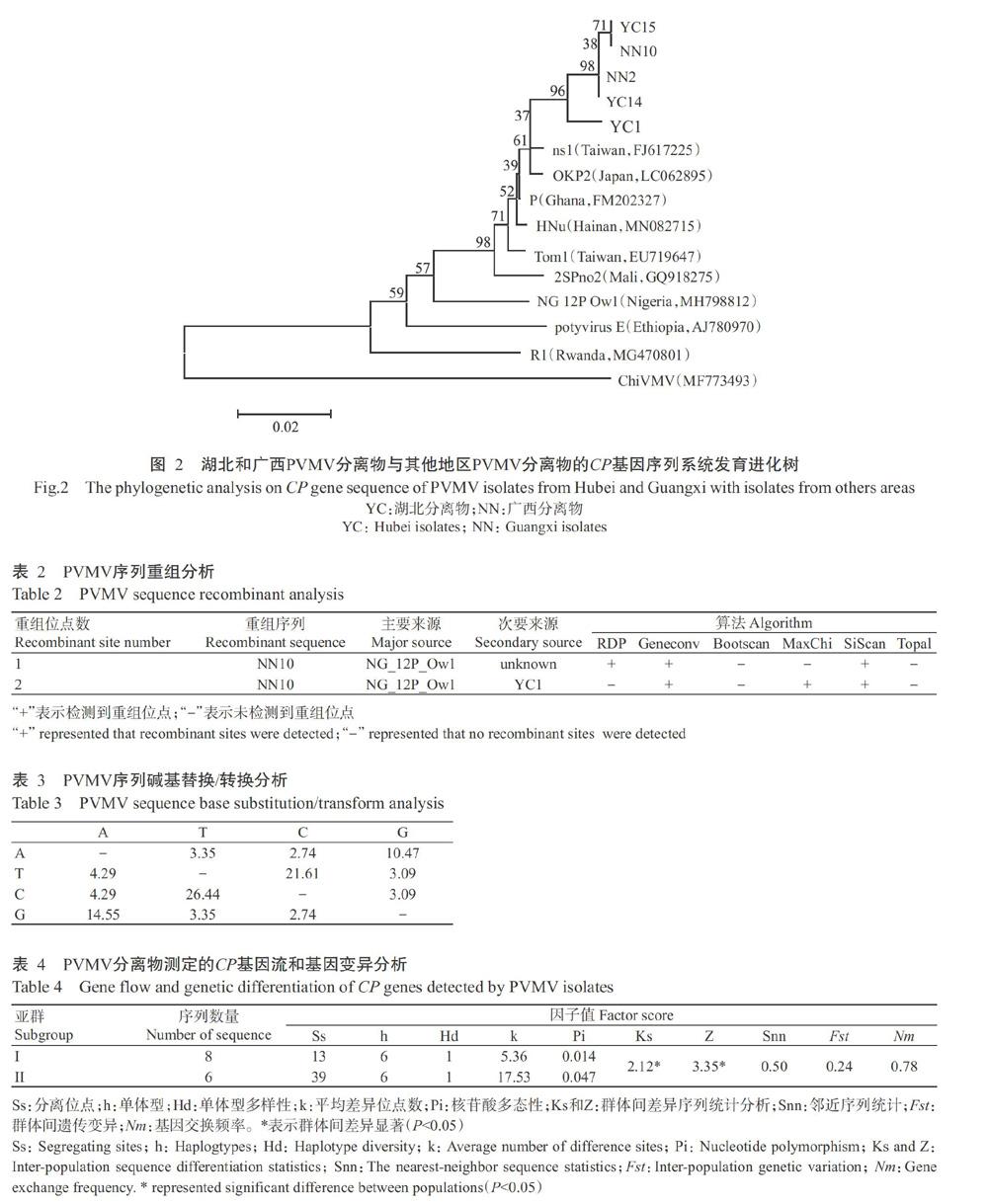
序列系统发育分析结果(图2)表明,湖北分离物(YC)与广西分离物(NN)亲缘关系最近,聚为一个亚簇;两个省份的PVMV分离物与我国台湾PVMV分离物ns1(FJ617225)的亲缘关系最近。
2. 3 PVMV序列重组分析结果
PVMV序列重组分析结果(表2)显示,分别有3种算法得到广西PVMV分离物NN10的CP基因序列有2个重组事件:重组事件1(算法RDP、Geneconv和SiScan)的主要序列来源和次要序列来源分别是非洲尼日利亚(Nigeria)分离物NG_12P_Ow1和一个未知分离物;重组事件2(算法Geneconv、MaxChi和SiScan)的主要序列来源和次要序列来源分别是非洲尼日利亚(Nigeria)分离物NG_12P_Ow1和湖北的分离物YC1。
2. 4 PVMV序列突变分析结果
PVMV CP基因的突变分析结果表明,PVMV分离物CP基因的碱基频率分别为:A(0.319)、T(0.249)、C(0.203)和G(0.229);嘌呤(A/G)的替换/转换率(k1)为3.390,嘧啶(C/T)的替换/转换率(k2)为7.896。PVMV CP基因总体的碱基替换/转换率(R)为2.226,以嘧啶(C/T)的替换/转换(26.44)为主(表3)。
2. 5 PVMV序列基因流及基因变异分析结果
将PVMV分离物CP基因序列分为我国分离物群(I亚群)和国外分离物群(II亚群)两个群体,采用DnaSP v5分析两个群体间CP基因的变异及基因流。两个群体CP基因的基因变异分析结果(表4)表明,我国PVMV分离物群体CP基因的分离位点数量(Ss)、平均差异位点数(k)和核苷酸多态性(Pi)分别为13、5.36和0.014;而国外PVMV分离物群体的CP基因的Ss、k和Pi分别为39、17.53和0.047;两个群体CP基因的基因流分析结果表明,群体间的遗传变异(Fst)为0.24,两个群体间的基因交换频率(Nm)低(0.78)。
3 讨论
PVMV属马铃薯Y病毒属马铃薯病毒科成员,能通过多种方式传播,目前在我国呈快速扩展的趋势(燕照玲等,2017)。本研究结果表明PVMV已扩散至华中地区的湖北和西南地区的广西,进一步证实该病毒在我国快速扩散,结合其他地区的报道(Cheng et al.,2011;Zhang et al.,2016;刘健等,2016;王莉爽等,2017),表明该病毒可能在我国绝大多数辣椒主产区发生危害。由于该病毒侵染辣椒,会导致辣椒严重减产,因此,急需加强抗性育种以及应急防控技术措施等方面的研究与应用。
PVMV序列系统发育分析结果表明,湖北和广西PVMV分离物与我国台湾分离物的亲缘关系最近,该结果与Zhang等(2015)的研究结果存在一定差异,Zhang等(2015)研究发现PVMV湖南分离物与我国台湾和非洲加纳分离物亲缘关系最近。而最新研究表明,PVMV日本分离物与东南亚分离物的亲缘关系最近,与非洲分离物的亲缘关系较远(Laina et al.,2019)。根据上述研究结果,可推测不同地区的PVMV分离物可能存在不同的选择压力,因此,其基因组可能通过不同方式进行适应性进化。
研究表明,植物病毒序列重组和突变等遗传变异是植物病毒适应性进化最重要的两种方式;正链RNA植物病毒通过基因重组和(或)突变,可促进基因组序列的变异,从而改变病毒群体,以适应寄主品种或环境等的选择压力(Bentley and Evans,2018)。对贵州PVMV分离物的研究表明,贵州分离物存在明显的株系分化,但是未深入分析其分化的分子机理(王莉爽等,2017)。湖南PVMV分离物全基因组分析表明,PVMV湖南分离物是一个新颖的重组子,表明重组可能在PVMV遗传进化中发挥重要作用(Zhang et al.,2015)。本研究分析推测,广西南宁PVMV分离物与非洲尼日利亚分离物和我国湖北分离物存在重组,因此,广西南宁的PVMV分离物可能与湖南分离物相似,通过重组的方式改变其基因,从而适应性进化。
然而,PVMV湖北分离物的CP基因序列没有重组事件,可能通过其他方式进行适应性进化。研究表明,在寄主与病原物的互作中,寄主与病原物存在共同进化的现象(Samantha et al.,2004);而在寄主—病原物共同进化过程中,基因突变(Yin et al.,2013)和基因转移(Wei et al.,2009)是植物病原物遗传变异的重要方式。对病毒及寄主(宿主)的研究表明,基因的水平转移在细菌及病毒致病性、寄主和环境的适应性中发挥重要作用(Dr?ge et al.,1999;Bahl et al.,2009)。本研究结果表明,PVMV湖北和广西分离物的CP基因存在明显的核苷酸碱基替换/转换率(R=2.226),以嘧啶(C/T)的替换/转换为主,由此推测PVMV湖北和广西分离物的基因突变可能也是该病毒遗传变异的主要方式。PVMV湖北和广西分离物CP基因序列的基因流分析表明,国外PVMV群体的多态性明显高于我国PVMV分离物群体;而且国外PVMV分离物群体与我国PVMV分离物群体间CP基因的遗传变异(Fst)为0.24,两个群体间的基因交换频率(Nm)低(0.78)。有研究表明,地区隔离是影响病毒分离物之间基因交流的重要因素(Lam et al.,2012),由此推测,我国PVMV群体与国外群体可能由于地域隔离,导致相互之间的基因交换频率低,表明基因轉移不是我国PVMV分离物遗传变异的主要因素。
为明确PVMV在我国辣椒等茄科主要经济作物主产区的快速扩散分子机制,急需测定更多地区PVMV分离物的序列,分析其遗传变异的方式,研究结果可为揭示该病毒的快速扩散提供科学依据,也为抗性育种等研究提供理论参考。
4 结论
湖北和广西辣椒的PVMV检测结果表明,该病毒已扩散至湖北和广西;基因突变可能是PVMV湖北分离物遗传变异的主要方式之一;而基因重组和基因突变可能是PVMV广西分离物遗传变异的重要因子。
参考文献:
刘健,张德咏,张松柏,刘勇. 2016. 湖南和福建辣椒上脉斑驳病毒的检测及系统发育分析[J]. 江苏农业科学,44(5):184-185. [Liu J,Zhang D Y,Zhang S B,Liu Y. 2016. Detection and phylogenetic analysis of Pepper veinal mottle virus in Hunan and Fujian[J]. Jiangsu Agricultural Science,44(5):184-185.]
王莉爽,陈小均,何海永,谭清群,陈文,黄露,杨学辉. 2017. 贵州辣椒脉斑驳病毒的检测及株系分化研究[J]. 南方农业学报,48(7):1220-1224. [Wang L S,Chen X J,He H Y,Tan Q Q,Chen W,Huang L,Yang X H. 2017. Detection of Chilli veinal mottle virus from Guizhou and its strain differentiation[J]. Journal of Southern Agriculture,48(7):1220-1224.]
燕照玲,段俊枝,冯丽丽,陈海燕,齐红志,杨翠苹,施艳,张会芳. 2017. 马铃薯Y病毒属病毒编码蛋白与寄主植物叶绿体蛋白互作研究进展[J]. 河南农业科学,46(11):1-5. [Yan Z L,Duan J Z,Feng L L,Chen H Y,Qi H Z,Yang C P,Shi Y,Zhang H F. 2017. Progress on interaction between potyviruses-coded proteins and chloroplast proteins of host plants[J]. Journal of Henan Agricultural Sciences,46(11):1-5.]
Akinyemi I A,Wang F,Zhou B G,Qi S S,Wu Q F. 2016. Ecogenomic survey of plant viruses infecting tobacco by next genration sequencing[J]. Virology Journal,13(1):181.
Alegbejo M D. 1999. Physalis micrantha L.,a weed host of Pepper veinal mottle virus[J]. Journal of Vegetable Crop Production,5(1):59-66.
Arogundade O,Balogun O S,Kareem K T. 2012. Occurrence and distribution of Pepper veinal mottle virus and Cucumber mosaic virus in pepper in Ibadan,Nigeria[J].Virology Journal,9:79-82.
Atiri G I. 1986. A disease of fluted pumpkin(Telfaira occidentalis Hook.F.) caused by a yellow vein-clearing strain of Pepper veinal mottle virus in Nigeria[J]. Journal of Plant Protection Tropics,3:105-110.
Bahl J,Vijaykrishna D,Holmes E C,Smith G J D,Guan Y. 2009. Gene flow and competitive exclusion of avian influenza A virus in natural reservoir hosts[J]. Virology,390(2):289-297.
Bentley K, Evans D J. 2018. Mechanisms and consequences of positive-strand RNA virus recombination[J]. Journal of Genenal Virology,99(10):1345-1356.
Bolou Bi B A,Moury B,Sorho K A F,Cherif M,Girardot G,Kouassi N P,Kone D. 2018. Survery of viruses infecting open-field pepper crops in C?te d'Ivoire and diversity of Pepper veinal mottle virus and Cucumber mosaic virus[J]. Plant Pathology,67(6):1416-1425.
Brunt A A,Kenten R H,Phillips S. 1978. Symptomatologically distinct strains of Pepper veinal mottle virus from four West Africa Solanaceous crops[J]. Annals of Applied Bio-logy,88:115-119.
Cheng Y H,Deng T C,Chen C C,Liao J Y,Chang C A,Chiang C H. 2011. First report of Pepper mottle virus in bell pepper in Taiwan[J]. Plant Disease,95(5):617.
Cheng Y H,Wang R Y,Chen C C,Chang C A,Jan F J. 2009. First report of Pepper veinal mottle virus in tomato and pepper in Taiwan[J]. Plant Disease,93(1):107.
Dr?ge M,Pühler A,Selbitschka W. 1999. Horizontal gene transfer among bacteria in terrestrial and aquantic habitats as assessed by microcosm and field studies[J]. Bio-logy and Fertility of Soils,29(3):221-245.
Gibbs M J,Armstrong J S,Gibbs A J. 2000. Sister-scanning:A Monte Carlo procedure for assessing signals in recombinant sequences[J]. Bioinformatics,16:573-582.
Laina J A,Matsumoto K,Setoyama T,Kawano S,Ohshima K. 2019. Pepper veinal mottle virus in Japan is closely related to isolates from other Asian countries,but more distantly to most of those from Africa[J].Virus Genes,55(3):347-355.
Lam T T,Hon S,Ghedin E,Wentworth D E,Halpin R A,Stockwell T B,Spiro D J,Dusek R J,Hoskins J,Bales B D,Yparraguirre D,Holmes E C. 2012. Migratory flyway and geographical distance are barriers to the gene flow of influenza virus among north american birds[J]. Ecology Letters,15(1):24-33.
Librado P,Rozas J. 2009. DnaSP v5:A software for comprehensive analysis of DNA polymorphism data[J]. Bioinformatics,25(11):1451-1452.
Martin D P,Murrell B,Golden M,Khoosal A,Muhire B. 2015. RDP4:Detection and analysis of recombination patterns invirus genomes[J]. Virus Evolution,1(1):vev003.
Moury B,Lebaron C,Szadkowski M,Ben Khalifa M,Girardot G,Bolou Bi B A,Koné D,Nitiema L W,Fakhfakh H,Gallois J L. 2020. Knock-out mutation of eukaryotic initiation factor 4E2 (eIF4E2) confers resistance to Pepper veinal mottle virus in tomato[J]. Virology,539:11-17.
Moury B,Palloix A,Caranta C,Gognalons P,Souche S,Selassie K G,Marchoux. G. 2005. Serological,molecular,and pathotype diversity of Pepper veinal mottle virus and Chili veinal mottle virus[J]. Journal of Phytopathology,95(3):227-232.
Padidam M,Sawyer S,Fauquet C M. 1999. Possible emergence of new geminiviruses by frequent recombination[J]. Virololy,265(2):218-225.
Posada D,Crandall K A. 2001. Evaluation of methods for detecting recombination from DNA sequences:Computer simulations[J]. Procceding of Natural Academy Science of the United States of America,98(24):13757-13762.
Rajam?ki M L,M?ki-Valkama T,M?kinen K,Valkonen J P T. 2004. Infection with potyviruses[M]//Talbot N J. Plant-Pathogen Interactions. Sheffield:Blackwell Publishing.
Samantha E F,Thompson J N,Bohannan B J M. 2004. Adaptation varies through space and time in a coevolving host-parasitoid interaction[J]. Nature,431:841-844.
Smith J M. 1992. Analyzing the mosaic structure of genes[J]. Journal of Molecular Evolution,34:126-129.
Tamura K,Peterson D,Peterson N,Stecher G,Nei M,Kumar S. 2011. MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J]. Molecular Biology and Evolution,28(10):2731-2739.
Tsai W S,Abdourhamane I K,Kenyon L. 2010. First report of Pepper veinal mottle virus associated with mosaic and mottle diseases of tomato and pepper in Mali[J]. Plant Disease,94(3):378.
Wei T Y,Yang J G,Liao F R,Liao F L,Gao F L,Lu L M,Zhang X T,Li F,Wu Z J,Lin Q Y,Xie L H,Lin H X. 2009. Genetic diversity and population structure of Rice stripe virus in China[J]. Journal of General Virology,90:1025-1034.
Yin X,Zheng F Q,Tang W,Zhu Q Q,Li X D,Zhang G M,Liu H T,Liu B S. 2013. Genetic structure of Rice black-streaked dwarf virus populations in China[J]. Archivers of Virology,158(12):2505-2515.
Zhang S B,Zhao Z B,Zheng L M,Liu J,Peng J,Yan F,Xie Y,Cheng Z B,Zhou X G,Zhang D Y,Liu Y. 2015. Complete genome analysis of a novel recombinant isolate of Pepper veinal mottle virus from mainland China[J]. Virology Journal,12:191-194.
Zhang S B,Zhao Z B,Zheng L M,Zhang D Y,Liu Y,Liu J,Du J,Peng J,Yan F,Li F,Xie Y,Cheng Z B. 2016. First report of Pepper veinal mottle virus infecting pepper in mainland China[J]. Plant Disease,100(5):1025.
(責任编辑 麻小燕)

