高羊茅FaGST1基因克隆、亚细胞定位及表达分析
陈锡 赵德刚 陈莹 吴佳海 袁暘暘 王小利

摘要:【目的】克隆高羊茅谷胱甘肽-S-轉移酶(GST)基因FaGST1,并进行亚细胞定位及表达分析,为深入研究该基因的抗逆分子调控提供理论依据。【方法】采用RT-PCR和RACE从高羊茅黔草1号中克隆FaGST1基因,对其进行生物信息学分析,构建植物融合表达载体pCAMBIA1300-FaGST1-GFP,通过农杆菌介导转入烟草叶片表皮细胞,观察FaGST1基因亚细胞定位情况,并利用实时荧光定量PCR检测高盐、高温、干旱及低氮胁迫处理下高羊茅叶片中该基因的表达情况。【结果】克隆获得FaGST1基因cDNA全长序列为1003 bp,开放阅读框(ORF)为681 bp,编码227个氨基酸残基,其编码蛋白的分子量约25.60 kD,理论等电点(pI)为5.58,亲水指数平均值-0.342,不稳定系数32.96,为稳定的亲水蛋白,定位于细胞核。FaGST1蛋白二级结构中,α-螺旋占50.44%,β-转角占5.75%,无规则卷曲占30.54%,延伸链占13.27%。FaGST1蛋白的保守结构区域为含有G位点的N末端结构域和含有H位点的C末端结构域。FaGST1蛋白与黑麦草GST蛋白(AMY26594.1)的氨基酸序列相似性最高,为93%,其次是海滨雀稗GST蛋白(AMN87043.1),为91%,与玉米(ACG39365.1)和小米(KQK86785.1)GST蛋白氨基酸序列相似性均在80%以上,与系统发育进化树分析结果基本相符,即FaGST1蛋白与黑麦草、海滨雀稗、玉米和小米等禾本科植物GST蛋白亲缘关系较近。高羊茅FaGST1基因在干旱、高温、高盐胁迫和低氮胁迫处理下均出现抑制表达。【结论】FaGST1基因负向调控高羊茅逆境胁迫响应。
关键词: 高羊茅;谷胱甘肽-S-转移酶(GST);基因克隆;亚细胞定位;生物信息学分析;非生物胁迫;表达分析
中图分类号: S543.9 文献标志码: A 文章编号:2095-1191(2020)07-0000-11
Abstract:【Objective】Glutathione-S-transferase(GSTs) gene FaGST1 form tall fescue was cloned,subcellular locali-zation and expression analysis was analyzed in order to provide reference for molecular regulation of stress resistance study of the gene. 【Method】FaGST1 gene was cloned by RT-PCR and RACE from tall fescue Qiancaoyihao, the structure and function of the protein were analyzed by bioinformatic software,and plant fusion expression vector pCAMBIA1300-FaGST1-GFP was constructed,which injected to tobacco epidermal cells through agrobacterium-mediated method,the subcellular localization of FaGST1 gene was observed,and FaGST1 gene expression level in tall fescue leaves under salt stress, heat stress,drought stress and low nitrogen stress was analyzed by qRT-PCR. 【Result】The sequence analysis results showed that the full-length cDNA(1 003 bp) was obtained with a 681 bp open reading frame(ORF),which encoded a small molecular protein containing 227 amino acids,the relative molecular weight of FaGST1 protein was about 25.60 kDa and its theoretical isoelectric point(pI) was 5.58. The grand average of hydropathicity was -0.342 and the instability index was 32.96, which was a stable hydrophilic protein. Subcellular localization results showed that FaGST1 was located on the cell uncleus. In the secondary structure of FaGST1 protein,including 50.44% of alpha helix, 5.75% of beta turn, 30.53% of random coil and 13.27% of extended strand were observed. FaGST1 protein conserved domain contained the GST-specific N-terminal domain (G site) and the C-terminal domain (H site). FaGST1 protein had the highest amino acid sequence similarity with GST (AMY26594.1) of Lolium perenne,at 93%,and followed the amino acid sequence similarity with GST(AMN87043.1) of Paspalum vaginatum, at 91%. Its amino acid sequence similarities with GST (AMY26594.1) of Zea mays(ACG39365.1) and Setaria italica(KQK86785.1) were over 80%, the results were basically consistent with phylogenetic evolution tree analysis. FaGST1 had close genetic relationship with the GST protein of Lolium perenne,P. vaginatum,Z. mays and S. italica. The qRT-PCR results showed that FaGST1 expression was down-regulated under drought stress,heat stress,salt stress and low nitrogen stress. 【Conclusion】The study results show that FaGST1 gene has negative regulation function under adversity stress response of tall fescue.
Key words: tall fescue; glutathione-S-transferase(GST); gene cloning; subcellular localization; bioinformatics analysis,abiotic stress; expression analysis
Foundation item: Special Fund Project of the Guizhou Science and Technology Platform and Talent Team(QKHPTRC〔2018〕5634); Science and Technology Plan Project of Guizhou(QKHJC〔2019〕1302); Open Foundation of Key Laboratory of Ministry of Education(MOELP-201702); Youth Foundation of Guizhou Academy of Agricultural Sciences(QNKYQNJJXM〔2018〕80)
0 引言
【研究意义】高羊茅(Festuca arundinacea)是禾本科羊茅属多年生冷季型牧草,广泛种植于温带地区,因具有四季常绿和耐践踏的优点,又被作为草坪草,应用于园林绿化设计、保持水土及生态环保等方面。贵州是典型的喀斯特地区,地表崎岖、土壤贫瘠、干旱频发,气候变化多样,冷季型牧草或草坪草生长较差(吴佳海等,2002)。谷胱甘肽-S-转移酶(Glutathione-S-transferase,GST)是广泛存在于真核生物中催化还原型谷胱苷肽与各种疏电或亲电化合物发生反应的一种多功能蛋白酶,主要作用于植物代谢、诱导胁迫和信号转导中(Gong et al.,2005;Eliana et al.,2006),还可作为天然植物生长素(IAA)的载体(陈秀华等,2013)。因此,克隆高羊茅GST基因(FaGST1),并进行亚细胞定位及表达分析,以探究该基因在高羊茅非生物胁迫响应中的调控机制,对培育抗性强且适宜贵州生态环境的高羊茅新品种具有重要意义。【前人研究进展】1970年Frear和Swanson首次在玉米植株中发现GST基因序列。随着相关研究的深入,已从17个物种中相继克隆获得GST基因及其类似序列(Basantani and Srivastava,2007;Conn et al.,2008),其中,玉米(Zea mays)42个(Shimabukuro et al.,1970),拟南芥(Arabidopsis thaliana)54个(Dixon et al.,2002),水稻(Oryza sativa)59个(Moons,2003),杨树(Populus)81个(Lan et al.,2009)。研究表明,GST是一类多功能蛋白家族,由分子量约26 kD的两个亚基组成二聚体(同源或异源),两个亚基均具有2个结构域,其中N端结构域的G位点是谷胱甘肽(GSH)特异结合的位点,氨基酸序列较保守,C端结构域的H位点结合疏水底物,氨基酸序列可变性较大(Chen et al.,2003)。GST在重金属、冷、热、盐、除草剂等非生物胁迫及病原侵染等生物胁迫过程中发挥重要作用(Dudler et al.,1991;胡廷章等,2007)。如水稻OsGST2基因受稻瘟病菌诱导表达上调,植株的抗病性提高(Agrawal et al.,2002);橡胶HbGSTU1是一个典型的GST Tau家族基因,在橡胶树割胶、伤害、低温等逆境过程中发挥作用,可作为橡胶树抗逆分子育种的靶标基因(范玉洁等,2011);小麦GST基因参与白粉病的应答,提高植株的抗病性(吴金华等,2013);番茄中多个GST基因家族成员受水杨酸和盐胁迫诱导表达上调,植株的抗胁迫能力明显提高(Csiszár et al.,2014);苹果被斑点落叶病原菌侵染后MdGSTU1基因表达显著上调,植株的抗病性明显提高(安秀红等,2014);向日葵HaGSTU1基因表达上调,抗核盘菌能力明显提高(马立功等,2015),且向日葵GST基因表达受盐、ABA、冷和热等胁迫影响(凌云鹤等,2019);山羊草GST基因也受干旱和盐胁迫影响,在不同组织中表达水平存在明显差异(马建辉等,2018);大蒜AsGST基因在盐胁迫下表达上调(梁志乐等,2019)。【本研究切入点】高羊茅是禾本科六倍体植物,已知的基因组信息量较少,至今鲜见关于高羊茅GST基因的相关研究报道。【拟解决的关键问题】以高羊茅品种黔草1号(Festuca arundinacea Schreb. cv. ‘Qiancao No.1)為材料,基于前期试验转录组测序拼接获得的GST基因序列,通过RT-PCR和RACE克隆FaGST1基因,对其进行生物信息学分析,通过构建融合表达载体进行亚细胞定位,并通过实时荧光定量PCR检测非生物胁迫下FaGST1基因的表达情况,为深入研究高羊茅GST基因的抗逆分子调控功能提供理论依据。
1 材料与方法
1. 1 试验材料
供试材料高羊茅黔草1号是贵州省农业科学院草业研究所牧草研究团队培育的牧草新品种,2005年通过国家审定(登记号299),种植于贵州独山县试验基地资源圃。该品种适应性广、坪用性好、抗逆性强、耐践踏、产量高,且种子成熟期集中,是草坪草、绿化环境及生态治理的优良草种。
TRIzolTM Kit RNA提取试剂、反转录试剂盒、RACE试剂盒和SYBR Green I荧光定量染料均购自宝生物工程(大连)有限公司。琼脂糖DNA回收试剂盒购自Omega Bio-Tek Inc(美国)。引物均由上海捷瑞生物工程有限公司合成。主要仪器设备:实时荧光定量PCR仪(TaKaRa PCR Thermal Cycler Dice Real Time System,Promega A6001)、PCR仪(Bio-Rad My-Cycler、GeneAmp PCR system 9700)、琼脂糖凝胶电泳仪(Bio-Rad Mini-Protean/Power Pac 300)和凝胶成像系统(Bio-Rad GelDoc)。
1. 2 样品处理及采集
选取饱满、品质优良的高羊茅种子,播种于装有标准Hoagland营养液容器中,存放于光照培养箱中进行培养,光强度5400 lx,光培养16 h/d,暗培养8 h/d,相对湿度60%,温度(24±2)℃,常规管理7 d后分别进行高盐、高温、干旱和低氮胁迫处理。高盐胁迫处理:取健康生长的高羊茅植株置于含有400 mmol/L NaCl的Hoagland营养液中处理24 h。高温胁迫处理:取健康生长的高羊茅植株在42 ℃培养箱中处理24 h。干旱胁迫处理:采用模拟干旱的方法将健康生长的高羊茅植株置于30% PEG-6000溶液(渗透勢为-1.0 MPa)中处理24 h。低氮胁迫处理:将健康生长的高羊茅植株转移至无氮的水培液(营养液中Cl-取代NO3-)中处理24 h。上述处理均以在标准Hoagland营养液中生长的高羊茅为对照。各处理的采样时间均为0、0.5、1.0、2.0、6.0、12.0和24.0 h共7个时间点,每处理3次重复。分别将同一时间采集的高羊茅鲜嫩叶片混合,液氮速冻后,置于-80 ℃保存备用。
1. 3 RNA提取及cDNA合成
称取高羊茅新鲜叶片0.1 g,参照TRIzol? Kit RNA试剂盒说明提取总RNA,于-80 ℃冰箱保存备用。取2 μg总RNA,以Oligo(dT)为引物,按照反转录试剂盒(RevertAid H Minus First Strand cDNA Synthesis Kit)说明反转录合成cDNA第一链,于-20 ℃冰箱保存备用。
1. 4 FaGST1基因克隆
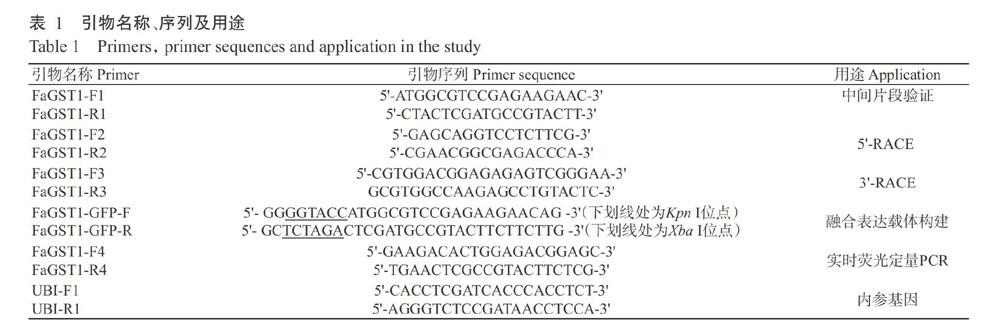
根据前期试验获得高羊茅转录组数据基因注释,从中找出高羊茅GST基因对应的Unigene序列,用Premier primer 5.0设计FaGST1基因的中间片段特异引物FaGST1-F1/FaGST1-R1(表1)。以高羊茅鲜嫩叶片的cDNA为模板,PCR反应体系50.0 μL:2×PCR Buffer for KOD FX Neo 25.0 μL,2 mmol/L dNTPs 10.0 μL,10 μmol/L上、下游引物(FaGST1-F1/FaGST1-R1)各2.0 μL,cDNA模板1.0 μL,KOD FX Neo(1 U/μL) 1.0 μL,用ddH2O补充至50.0 μL。扩增程序:98 ℃预变性5 min;98 ℃ 10 s,60 ℃ 15 s,68 ℃ 5 min,进行30个循环,4 ℃保存备用。经1.8%琼脂糖凝胶电泳检测PCR产物并照相记录,置于紫外灯下迅速切下与目的片段大小一致的条带,参照琼脂糖DNA胶回收试剂盒说明回收目的片段,连接至pMD19-T载体,转化大肠杆菌DH5α感受态细胞后涂板,挑取阳性克隆送至生工生物工程(上海)股份有限公司测序。利用DNAMAN 6.0分析测序结果。结合5'-RACE和3'-RACE试剂盒说明设计引物(FaGST1-F2/FaGST1-R2和FaGST1-F3/FaGST1-R3)(表1),然后参照5'-RACE和3'-RACE试剂盒说明进行操作,最终获得高羊茅FaGST1基因的5'端和3'端序列。利用琼脂糖DNA胶回收试剂盒回收纯化目的片段,使用DNAMAN 6.0将5'端和3'端序列与中间片段序列进行拼接,获得FaGST1基因的cDNA全长序列。
1. 5 生物信息学分析
应用ORF Finder在线网站查找FaGST1基因的开放阅读框(ORF)。使用ExPASy Proteomics Server中的ProtParam和ProtScale预测FaGST1蛋白的理化性质。通过NCBI中的BLAST比对,搜索下载其他植物同源GST蛋白,并用DNAMAN 6.0进行多重比对,最后利用MEGA 6.0的邻接法(Neighbor jointing,NJ)构建系统发育进化树。分别用SOPMA和SWISS-MODEL预测FaGST1蛋白的二级结构和三级结构。
1. 6 融合表达载体构建和亚细胞定位
以FaGST1-GFP-F/FaGST1-GFP-R为引物,利用高保真酶KOD FX Neo扩增获得FaGST1基因,反应体系和扩增程序见方法1.4,用1.8%琼脂糖凝胶电泳检测PCR产物,用琼脂糖DNA胶回收试剂盒回收目的片段。用Kpn I和Xba I对目的片段和质粒pCAMBIA1300-GFP进行双酶切,回收酶切产物进行体外连接,以构建融合表达载体pCAMBIA1300-FaGST1-GFP(图1),用冷却法将其转入GV3101农杆菌感受态细胞,涂布于含卡那霉素(Kan)和利福平(Rif)的固体培养基中进行抗性筛选,挑取单菌落培养后进行菌液PCR验证,将阳性克隆菌液送至生工生物工程(上海)股份有限公司测序。从测序正确的阳性克隆菌液中抽提质粒备用。
将被转入融合表达载体pCAMBIA1300-FaGST1-GFP的农杆菌过夜培养后,转接至含Kan和Rif的LB液体培养基中,28 ℃摇床培养16 h,再加入乙酰丁香酮和吗啉乙磺酸(MES)。常温下4000 r/min离心菌液10 min,丢弃上清液,用MgCl2溶液重悬菌体,加入MAS混匀,静置3 h,作为后续试验的侵染液。取正处于生长期的烟草叶片,叶片反面用针头扎数个小孔,用注射器吸取侵染液,将其从叶片下表皮注射到叶片内,作为处理组,以转入空载体pCAMBIA1300-GFP的烟草叶片为对照。注射72 h后,撕取烟草表皮细胞置于激光共聚交荧光显微镜下检测荧光信号[绿色荧光蛋白(GFP)激发光为488 nm,4',6-二脒基-2-苯基吲哚(DAPI)激发光为405 nm]。
1. 7 实时荧光定量PCR检测
分别称取干旱、高温、高盐和低氮胁处理的高羊茅叶片各0.1 g,提取其总RNA,并反转录合成cDNA第一链,具体方法与1.2.1相同。将合成的cDNA稀释20倍作为模板,以FaGST1-F4/FaGST1-R4为引物(表1),实时荧光定量PCR检测不同胁迫处理下高羊茅叶片FaGST1基因的表达情况。在冰上配制反应体系20.0 μL: cDNA模板2.0 μL,10 μmol/L上、下游引物(FaGST1-F4/FaGST1-R4)各1.0 μL,SYBR Premix Ex Taq(2×) 10.0 μL,ddH2O补足至20.0 μL。将反应体系置于实时荧光定量PCR仪进行扩增。扩增程序:95 ℃ 2 min;95 ℃ 15 s,55 ℃ 15 s,共进行45个循环;72 ℃延伸5 min。内参基因为Ubiquitin,其引物为UBI-F1/UBI-R1(李小冬等,2017)。生物学技术各设3次重复,样品也各设3次重复。
1. 8 统计分析
根据2-ΔΔCt法计算分析FaGST1基因的相对表达量。采用Excel 2007整理分析数据及作图。
2 结果与分析
2. 1 FaGST1基因cDNA克隆结果
以高羊茅鲜嫩叶片的cDNA为模板、FaGST1-F1/FaGST1-R1为引物,PCR扩增出一条长度约600 bp的清晰条带(图2-A),与预期结果相符。测序结果显示,该片段为FaGST1基因的中间片段,长度为644 bp。采用RACE扩增FaGST1基因的3'端和5'端,结果如图2-B和圖2-C所示。测序结果显示,该基因5'端为174 bp,3'端为326 bp。利用DNAMAN 6.0将5'端和3'端序列与中间片段序列进行拼接,获得高羊茅GST基因cDNA序列全长为1003 bp,ORF长度为681 bp,编码227个氨基酸残基(图3)。
2. 2 生物信息学分析结果
由图4可知,FaGST1蛋白的保守结构区域为含有G位点的N末端结构域(蓝色)和含有H位点的C末端结构域(绿色)。ProtParam预测结果显示,FaGST1蛋白分子式为C1182H1798N294O336S3,原子总数为3613个,分子量约25.60 kD,理论等电点(pI)为5.58,亲水指数平均值-0.342,不稳定系数32.96,为稳定的亲水蛋白(图5)。SOPMA和SWISS-MODEL预测结果显示,FaGST1蛋白的二级结构中,α-螺旋占50.44%,β-转角占5.75%,无规则卷曲占30.54%,延伸链占13.27%(图6)。利用SWISS-MODEL在线软件预测该蛋白的三级结构,结果(图7)显示,其与二级结构预测结果相符。
2. 3 系统发育进化树分析结果
通过NCBI数据库的BLAST比对,下载GenBank收录的16种植物GST蛋白氨基酸序列,利用DNAMAN 6.0进行多重序列比对,FaGST1蛋白与黑麦草GST蛋白(AMY26594.1)的氨基酸序列相似性最高,为93%,其次是海滨雀稗GST蛋白(AMN87043.1),为91%,与玉米(ACG39365.1)和小米(KQK86785.1)GST蛋白氨基酸序列相似性均在80%以上(图8)。由图9可知,FaGST1蛋白先与黑麦草GST蛋白聚在一起,然后与海滨雀稗GST蛋白聚在一起,表明三者亲缘关系较近,此外,FaGST1蛋白与玉米和小米GST蛋白亲缘关系也较近,其原因可能是这些植物同属禾本科,尤其是前三者均为禾本科牧草。
2. 4 FaGST1蛋白亚细胞定位结果
将克隆获得的FaGST1基因连接至pCAMBIA1300-GFP载体上,成功构建融合表达载体pCAMBIA1300-FaGST1-GFP,通过农杆菌介导转入烟草表皮细胞,撕取烟草表皮细胞置于激光共聚交荧光显微镜下观察荧光信号,结果发现,对照组整个烟草表皮细胞中分布非常强的绿色荧光,但处理组烟草表皮细胞仅细胞核能检测到荧光信号,表明FaGST1蛋白定位于细胞核(图10)。
2. 5 不同胁迫处理下FaGST1基因表达分析结果
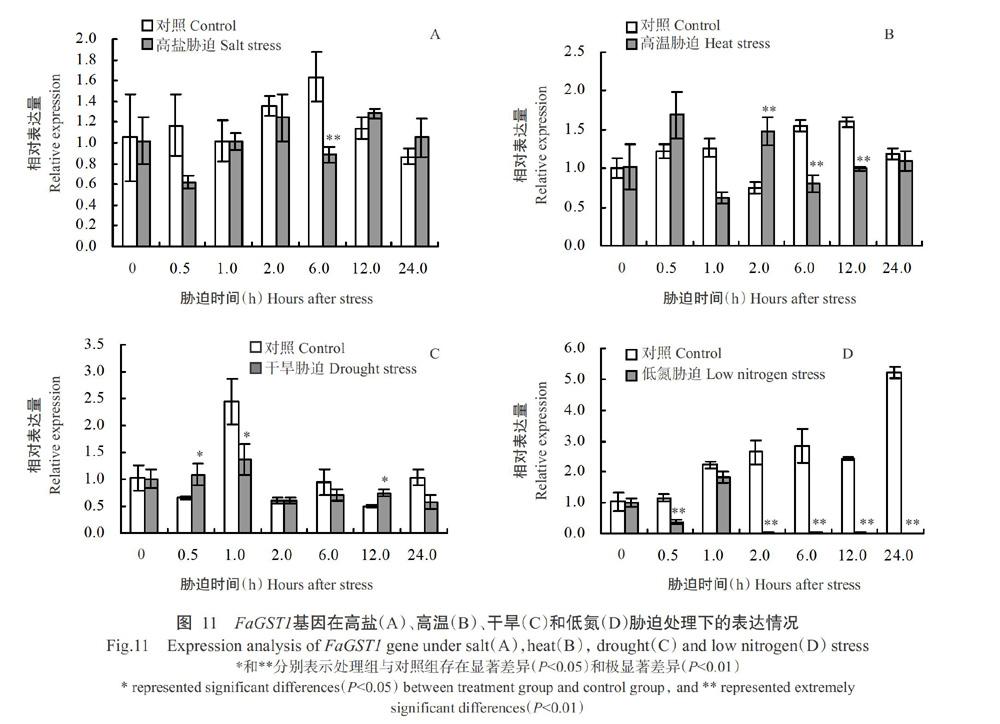
采用实时荧光定量PCR检测高盐、高温、干旱及低氮胁迫处理下高羊茅叶片中FaGST1基因表达情况,结果(图11)显示,FaGST1基因的表达水平受到不同程度影响,与对照相比,高盐胁迫6.0 h FaGST1基因极显著下调表达(P<0.01,下同)(图11-A);高温胁迫2.0 h FaGST1基因极显著上调表达,但胁迫处理6.0和12.0 h时,其表达极显著下调(图11-B);干旱胁迫0.5和12.0 h时FaGST1基因表达显著上调(P<0.05,下同),但处理1.0 h时其表达显著下调(图11-C);低氮胁迫0.5~24.0 h(除胁迫1.0 h外),FaGST1基因的表达呈极显著下调(图11-D)。可见,FaGST1基因在干旱、高温、高盐和低氮胁迫处理下均出现抑制表达,表明FaGST1基因负向调控高羊茅逆境胁迫响应。
3 讨论
植物正常生长发育过程中,体内活性氧(ROS)的产生和清除处于动态平衡,当受到不利生物环境条件如高温、低温、干旱、盐渍等逆境胁迫影响时,植物体内会大量积累ROS,对蛋白质、脂质等大分子物质造成不可逆性氧化损伤,从而引起细胞代谢异常,导致植株的生长发育受阻(Mohsenzadeh et al.,2011;毛小辉等,2014)。由于GST的GSH具有还原作用,可清除植物细胞中产生的ROS以修复受氧化损伤的细胞,维持植物体内正常代谢,且GSH能结合除草剂,以致不伤害目的酶,说明GST还具有降低异源物质毒性的作用(陈秀华等,2013)。Moons(2003)研究发现,水杨酸(SA)、茉莉酸(JA)和生长素(IAA)能诱导水稻根中GST基因表达上调,产生大量GST蛋白清除ROS,表明该基因参与胁迫应答调控机制。此外,植物GST基因能应答脱水、冷害、干旱、高盐和脱落酸(ABA)等非生物胁迫(Fang et al.,2002)。Roxas等(1997)研究发现,烟草植物中超表达GST/GPX基因可加速转基因烟草幼苗在冷胁迫条件下的生长;Yang等(2014)研究显示,刚毛怪柳中ThGSTZ1基因过量表达可增加植物的抗旱和耐盐能力,从而减少细胞的损伤。可见,GST在植物响应生物逆境胁迫中发挥重要作用。
目前,已有较多关于GST生理生化活性与植物抗性的研究报道,有关GST基因在植物中的表达调控研究也较多,但以高羊茅为研究对象的相关研究鲜见报道,其原因可能是高羊茅为禾本科六倍体植物,已知的基因组信息量较少。本研究以高羊茅黔草1号为材料,通过RACE从高羊茅中获得FaGST1基因cDNA全长序列,具有完整ORF序列,其编码蛋白保守结构区域包括含有G位点的N末端结构域和含有H位点的C末端结构域,与黑麦草GST蛋白的氨基酸序列相似度最高,然后与海滨雀稗的GST蛋白聚在一起,表明三者亲缘关系较近,此外,FaGST1蛋白与玉米和小米GST蛋白亲缘关系也较近,其原因可能是这些植物同属禾本科牧草。推测其与小麦GST蛋白和水稻GST蛋白(毛小辉等,2014)氨基酸序列相似性也较高,原因是小麦和水稻同属禾本科植物。
GST基因家族庞大,不同植物中GST基因种类和亚细胞定位均存在差异。本研究发现,FaGST1基因亚细胞定位于细胞核。但Dixon等(2002)研究表明,大多数GST基因定位于细胞质中,少数定位于细胞核。前人研究发现,拟南芥AtGST1(Yang et al.,1998)和盐角草SbGST(Jha et al.,2011)基因受干旱、高盐、低温胁迫等诱导表达上调。马立功等(2015)研究发现,干旱、高盐、草酸、核盘菌及其代谢物均能诱导向日葵HaGSTU1基因表达上调。本研究采用实时荧光定量PCR检测高盐、高温、干旱和低氮胁迫处理下高羊茅叶片中FaGST1基因表达情况,结果显示高羊茅FaGST1基因在干旱、高温、高盐和低氮胁迫处理下均出现抑制表达,推测高羊茅中FaGST1基因负向调控高羊茅逆境胁迫响应。该结论与前人研究结果存在差异,其原因是GST基因家族庞大复杂,其编码蛋白具有多种功能,虽然家族成员间存在功能冗余的现象,但不同成员在不同物种中具有一定的表达特异性和特定的表达模式(Sappl et al.,2009)。今后,可通过构建FaGST1基因的过量表达载体遗传转化拟南芥验证其调控功能。
4 结论
FaGST1基因负向调控高羊茅逆境胁迫响应,为进一步解析高羊茅FaGST1基因的抗性分子机制和功能特性提供理论基础。
参考文献:
安秀红,徐锴,厉恩茂,李壮,李敏,刘志,程存刚. 2014. 苹果抗性相关的谷胱甘肽转移酶基因MdGSTU1的生物信息学和表达分析[J]. 中国农业科学,47(24):4868-4877. [An X H,Xu K,Li E M,Li Z,Li M,Liu Z,Cheng C G. 2014. Bioinformatics and expression analysis of MdGSTU1 gene encoding a resistance-related glutathione transferase from apple[J]. Scientia Agricultura Sinica,47(24):4868-4877.]
陈秀华,王臻昱,李先平,朱延明,刘丽,陈威,陈勤. 2013. 谷胱甘肽S-转移酶的研究进展[J]. 东北农业大学学报,44(1):149-153. [Chen X H,Wang Z Y,Li X P,Zhu Y M,Liu L,Chen W,Chen Q. 2013. Research progress on glutathione S-transferases[J]. Journal of Northeast Agricultural University,44(1):149-153.]
范玉洁,林飞鹏,安泽伟,唐朝荣. 2011. 一个橡胶樹谷胱甘肽-S-转移酶基因的克隆和表达特性分析[J]. 中国农业科学,44(20):4150-4158. [Fan Y J,Lin F P,An Z W,Tang C R. 2011. Cloning and expression analysis of a glutathione-S-transferase gene in the latex of Hevea brasi-liensis(para rubber tree)[J]. Scientia Agricultura Sinica,44(20):4150-4158.]
胡廷章,周大祥,罗凯. 2007. 植物谷胱甘肽转移酶的结构与功能及其基因表达[J]. 植物生理学通讯,43(1):195-200. [Hu T Z,Zhou D X,Luo K. 2007. Structure and bio-logical function of glutathione transferases and their genes in plants[J]. Plant Physiology Communications,43(1):195-200.]
李小冬,吴佳海,孙方,陈光吉,王小利. 2017. 过量表达Fa14-3-3C促进拟南芥对低氮胁迫耐受性的研究[J]. 草业学报,26(9):104-112. [Li X D,Wu J H,Su F,Chen G J,Wang X L. 2017. Enhanced tolerance of arabidopsis over expressing Fa14-3-3C from tall fescue(Festuca arundi-nacea) to low-nitrogen stress[J]. Acta Prataculturae Sinica,26(9):104-112.]
梁志乐,尚珂含,王立辉,周瑾,王广龙,熊爱生. 2019. 大蒜谷胱甘肽硫转移酶基因AsGST的克隆及其对盐胁迫的响应[J]. 核农学报,33(6):1088-1095. [Liang Z L,Shang K H,Wang L H,Zhou J,Wang G L,Xiong A S. 2019. Clo-ning and expression analysis of the AsGST gene in garlic exposed to salinity stress[J]. Journal of Nuclear Agricultural Sciences,33(6):1088-1095.]
凌云鹤,李景兵,李春莲,肖恩时,王中华. 2019. 向日葵3个谷胱甘肽-S-转移酶GST基因的克隆及表达模式分析[J]. 干旱地区农业研究,37(5):92-98. [Ling Y H,Li J B,Li C L,Xiao E S,Wang Z H. 2019. Cloning and expression analysis of three glutathione S-transferase GST genes from sunflower(Helianthus annuus)[J]. Agricultural Research in the Arid Areas,37(5):92-98.]
馬立功,孟庆林,张匀华,刘志华,王志英. 2015. 向日葵谷胱甘肽-S-转移酶基因的克隆及抗病功能研究[J]. 中国油料作物学报,37(5):635-643. [Ma L G,Meng Q L,Zhang Y H,Liu Z H,Wang Z Y. 2015. Clone and function of a glutathione-S-transferase gene from sunflower(Helianthus annuus)[J]. Chinese Journal of Oil Crop Scien-ces,37(5):635-643.]
马建辉,张文利,高小龙,张黛静,姜丽娜,翟延玉,邵云,李春喜. 2018. 山羊草谷胱甘肽S-转移酶基因家族鉴定及表达分析[J]. 作物杂志,(5):54-62. [Ma J H,Zhang W L,Gao X L,Zhang D J,Jiang L N,Zhai Y Y,Shao Y,Li C X. 2018. Identification and expression analysis of the whole glutathione S-transferase genome family in Aegi-lops tauschii under abiotic stress[J]. Crops,(5):54-62.]
毛小辉,魏毅东,张建福,谢华安. 2014. 粳稻品种‘云引谷胱甘肽S-转移酶基因OsGST的克隆及序列分析[J]. 福建农业学报,29(3):197-203. [Mao X H,Wei Y D,Zhang J F,Xie H A. 2014. Cloning and sequence analysis of glutathione-S-transferase(GST) gene of japonica varity ‘Yun-yin[J]. Fujian Journal Agricultural Sciences,29(3):197-203.]
吴佳海,尚以顺,牟琼. 2002. 高羊茅草坪草在贵州南部地区的生态适应性研究[J]. 草业科学,20(6):59-61. [Wu J H,Shang Y S,Mu Q. 2002. Study on ecological adapta-bility of tall fescue turf in southern Guizhou Province[J]. Pratacultural Science,20(6):59-61.]
吴金华,张西平,胡言光,吉万全. 2013. 小麦抗白粉病相关基因GST克隆与表达[J]. 西北植物学报,33(1):34-38. [Wu J H,Zhang X P,Hu Y G,Ji W Q. 2013. Cloning and expression analysis of a glutathione-S-transferase (GST) gene related to powdery mildew of wheat[J]. Acta Botanica Boreali-Occidentalia Sinica,33(1):34-38.]
Agrawal G K,Jwa N S,Rakwal R. 2002. A pathogen-induced novel rice(Oryza sativa L.) gene encodes a putative protein homologous to typeII glutathione S-transferases[J]. Plant Science,163(6):1153-1160.
Basantani M,Srivastava A. 2007. Plant glutathione S-transfera-se a decade falls short[J]. Canadian Journal of Botany,85(5):443-456.
Chen L,Hall P R,Zhou X E,Ranson H,Hemingway J,Meehan E J. 2003. Structure of an insect delta-class glutathione S-transferase from a DDT-resistant strain of the malaria vector anopheles gambiae[J]. Acta Crystallographica Section D:Biological Crystallography,59(12):2211-2217.
Conn S,Curtin C,Bézier A,Franco C,Zhang W. 2008. Purification,molecular cloning,and characterization of glutathione S-transferases(GSTs) from pigmented Vitis vinifera L. cell suspension cultures as putative anthocyanin transport proteins[J]. Journal of Experimental Botany,59(13):3621-3634.
Csiszár J,Horváth E,Váry Z,?gnes G,Krisztina B,Szilvia B,Irma T. 2014. Glutathione transferase supergene family in tomato:Salt stress-regulated expression of representative genes from distinct GST classes in plants primed with salicylic acid[J]. Plant Physiology and Biochemi-stry,78(5):15-26.
Dixon D P,Lapthorn A,Edwards R. 2002. Plant glutathione transferases[J]. Genome Biology. doi:10.1186/gb-2002-3-3-reviews3004.
Dudler R,Hertig C,Rebmann G,Bull J,Mauch F. 1991. A pathogen-induced wheat gene encodes a protein homologous to glutathione-S-transferases[J]. Molecular Plant-Microbe Interactions,4(1):14-18.
Eliana N,Antonio M,Federica B,Luigi D B. 2006. Characteri-zation of two Arabidopsis thaliana glutathione S-transfera-ses[J]. Plant Cell Reports,25(9):997-1005.
Fang X X,Evans S L,Stephen P M,Dean E R. 2002. Tandemly duplicates safener-induced glutathione S-transfera-se genes from Triticum tauschii contribute to genome and organ specific expression in hexaploid wheat[J]. Physiologia Plantarum, 130(1):362-373.
Frear D S,Swanson H R. 1970. Biosynthesis of S-(4-ethylamino-6-isopropylamino-2-S-triazino) glutathione:Partial purification and properties of a glutathione S-transferase from corn[J]. Phytochemistry,9(10):2123-2132.
Gong H B,Hu W W,Jiao Y X,Pua E C. 2005. Molecular characterization of a Phi-class mustard(Brassica juncea) glutathione-S-transferase gene in Arabidopsis thaliana by 5'-deletion analysis of its promoter[J]. Plant Cell Reports,24(7):439-447.
Jha B,Sharma A,Mishra A. 2011. Expression of SbGSTU(tau class glutathione S-transferase) gene isolated from Salicornia brachiata in tobacco for salt tolerance[J]. Molecu-lar Biology Reports,38(7):4823-4832.
Lan T,Yang Z L,Yang X,Liu Y J,Wang X R,Zeng Q Y. 2009. Extensive functional diversification of the Populus glutathione S-transferase supergene family[J]. The Plant Cell,21(12):3749-3766.
Mohsenzadeh S,Esmaeili M,Moosavi F,Shahrtash M,Saffari B,Mohabatkar H. 2011. Plant glutathione S-transferase classification,structure and evolution[J]. African Journal of Biotechnology,10(42):8160-8165.
Moons A. 2003. Osgstu 3 and osgtu 4,encoding tau class glutathione S-transferases are heavy metaland hypoxic stress-induced and differentially salt stress-responsive in rice roots[J]. FEBS Letter,553(3):427-432.
Roxas V P,Smith R K,Allen E R,Allen R D. 1997. Overexpression of glutathione S-transferase/glutathioneperoxidase enhances the growth of transgenic tobacco seedlings during stress[J]. Nature Biotechnology,15(10):988-991.
Sappl P G,Carroll A J,Clifton R,Lister R,Whelan J,Harvey M A,Singh K B. 2009. The Arabidopsis glutathione transferase gene family displays complex stressre gulation and co-silencing multiple genes results in altered metabolic sensitivity to oxidative stress[J]. The Plant Journal,58(1):53-68.
Shimabukuro R H,Swanson H R,Walsh W C. 1970. Glutathio-ne conjugation:Atrazine detoxification mechanism in corn[J]. Plant Physiology,46(1):103-107.
Yang G Y,Wang Y C,Xia D A,Gao C Q,Wang C,Yang C P. 2014. Overexpression of a GST gene(ThGSTZ1) from Ta-marix hispida improves drought and salinity tolerance by enhancing the ability to scavenge reactive oxygen species[J]. The Plant Cell,Tissue and Organ Culture,117(1):99-112.
Yang K Y,Kim E Y,Kim C S,Guh J O,Kim K C,Cho B H. 1998. Characterization of a glutathione S-transferase gene ATGST1 in Arabidopsis thaliana[J]. Plant Cell Reports,17(9):700-704.
(責任编辑 陈 燕)

