基于气道三维CT 重建筛选颌面部间隙感染患者困难气道的 预测指标
宋 巧,严 佳,周 韧,张 磊,姜 虹
上海交通大学医学院附属第九人民医院麻醉科,上海200011
困难气道的管理是麻醉医师临床工作中必备的一项基本技能。研究[1]表明,因气道管理不当导致严重缺氧,继而诱发心室颤动、心搏骤停、脑缺氧甚至死亡者,约占麻醉事故相关死亡病例的25%。口腔颌面部间隙感染是口腔颌面外科中最常见的感染性疾病,起病急、进展快,需要及时借助外科方法进行切开引流及减压。因感染易累及深部组织间隙,造成不同程度的张口受限、会厌水肿、舌体抬高,困难气道发生率较高[2]。因此,术前准确的气道评估和充分准备是确保颌面部间隙感染患者围术期安全的先决条件之一[3]。
目前临床上常用的气道评估方法包括张口度测量、咬唇试验、Mallampati 分级以及Willson 综合评分法等;然而,因颌面部间隙感染患者常存在气道的受压、变形、移位,传统评估方法难以准确评估其内部气道情况,在此类患者困难气道评估中的作用有限。三维CT(3D-CT)重建技术可以清晰地显示气道解剖结构[4-5]。研究[6]表明,上气道3D-CT 重建可评估睡眠呼吸障碍患者上气道的狭窄及阻塞位置,较为精确地预测困难气道。因此,本研究拟通过气道3D-CT 重建筛选评估颌面部间隙感染患者气道是否困难的指标,以期为颌面部间隙感染患者的气道评估提供参考,为提高该类患者围术期气道安全性提供保障。
1 资料与方法
1.1 临床资料
1.1.1 病例分组 回顾性分析2017 年8 月—2019 年7 月于上海交通大学医学院附属第九人民医院行全身麻醉下颌面部间隙感染切开引流术患者的病例资料,选取其中已预测为困难气道并接受清醒镇静表面麻醉下气管插管的患者为病例组;通过医院住院病例系统,随机选取同期行全身麻醉手术的非困难气道并接受麻醉快诱导气管插管的非颌面部间隙感染手术患者为对照组。是否属于困难气道均由高年资麻醉科主治医师根据传统气道评估方法和临床经验判断。
1.1.2 纳入及排除标准 纳入标准:年龄≥18 岁;美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级Ⅰ~Ⅲ级;入院已行头颈颌面部CT 影像检查。排除标准:ASA 分级≥Ⅳ级;行颌面部CT 影像检查前已行气管插管或气管切开;合并其他任何影响气道结构或引起气道梗阻的疾病;接受过头颈颌面部放射治疗或外科 手术。
1.2 CT 数据的采集、重建与测量
1.2.1 图像获取 所有病例均由相同仪器根据标准参数 检 查。 采 用GE Discovery CT750 HD(GE Healthcare公司),扫描参数为120 kV/240 mA,螺距1.5:1,层厚5 mm,1.25 mm 重建。将获取的DICOM 格式的数据导入Dolphin 11.9 软件(Chatsworth 公司),进行气道三维重建及测量。
1.2.2 上气道三维重建 利用软件中的Orientation 模块校正头位,使眶耳平面平行于地面,正中矢状面垂直于地面,并设眶耳平面为水平面(图1)。个体化界定气道灵敏度阈值,手动调整阈值以最大化气道容积并最小化干扰。利用软件中Edit-Sinus/Airway 模块进行气道三维重建,将上部气道分为鼻咽(Naso)、口咽(Oro)和喉咽(Hypo)三部分,口咽又分为腭咽(Velo)和舌咽(Glosso)两部分;因鼻咽体积较小,故不对其进行测量。分别以后鼻棘点(PNS)、第三颈椎椎体前下缘(C3)、第六颈椎椎体前下缘(C6)水平线作为上部气道口咽及喉咽的分界,以腭垂尖端(U)水平线作为腭咽与舌咽的分界(图2)。
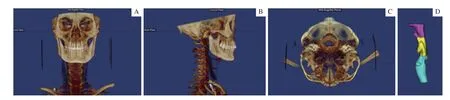
图1 头位校正图Fig 1 Skull orientation
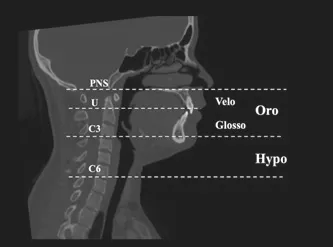
图2 上气道各区的分界图Fig 2 Dividing lines of upper airway areas
1.3 数据采集
1.3.1 基本资料 收集患者年龄、性别、体质量指数(body mass index,BMI)及ASA 分级等临床资料。
1.3.2 上气道3D-CT 重建数据 分别测量和采集上述3D-CT 重建分割部位的体积(V)、正中矢状面面积(Msa)、平均横截面积(Mean)、最小横截面积(Min)、最小横截面矢状前后径(AP)、最小横截面冠状左右径(LAT),以及第二颈椎(C2)水平横截面积(C2-Area)和咽后壁黏膜厚度(C2-ST)、第三颈椎(C3)水平横截面积(C3-Area)和咽后壁黏膜厚度(C3-ST)。同时,记录病例组患者的气道受压程度及会厌受累程度。2 组患者的气道3D-CT 重建见图3。
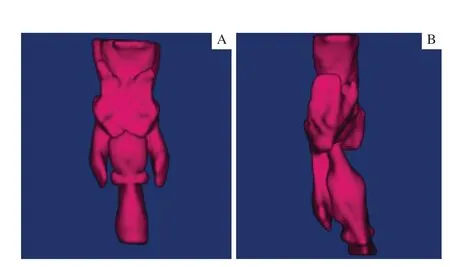
图3 咽气道3D-CT 重建Fig 3 3D-CT reconstruction of upper airway
1.4 统计学分析
所有指标均由同一研究者进行3 次重复测量并取其平均值。运用SPSS 26.0 软件对数据进行统计学分析。定量资料根据其是否符合正态分布,采用独立样本t检验或秩和检验进行比较,定性资料采用χ2检验进行比较。P<0.05 表示差异具有统计学意义。对于2 组差异有统计学意义的指标进行单因素和多因素Logistic 回归,分析该指标与困难气道的相关性。
2 结果
2.1 一般资料比较
共纳入54 例患者,病例组和对照组各27 例。2 组患者年龄、性别、BMI、ASA 分级比较,差异均无统计学意义(P>0.05)(表1)。
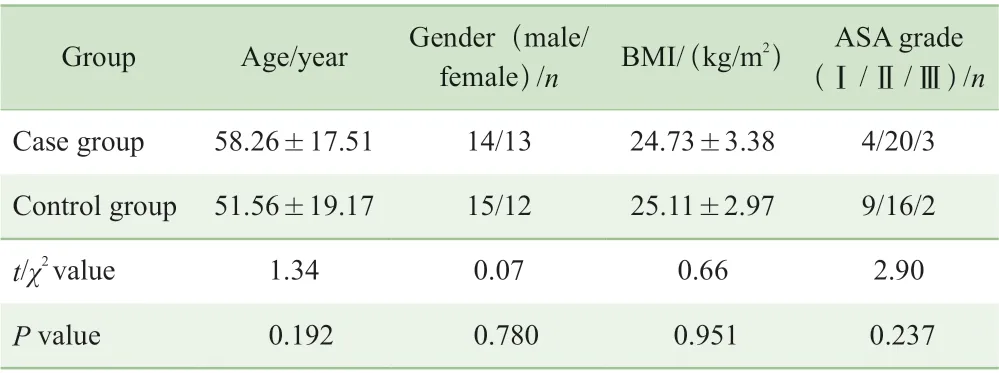
表1 2 组病例一般情况比较(n=27)Tab 1 Comparison of general status between the two groups (n=27)
2.2 气道3D-CT 测量结果分析
2 组病例气道阈值范围为46 ~82,病例组平均值为68.67±5.89,对照组平均值为69.07±6.73,差异无统计学意义(P<0.05)。
2 组病例腭咽体积(Velo-V)和喉咽体积(Hypo-V)比较,病例组明显小于对照组,差异有统计学意义(P<0.05);而2 组舌咽体积(Glosso-V)和口咽体积(Oro-V)比较,差异无统计学意义(P>0.05)(表2)。
2 组病例中腭咽正中矢状面积(Velo-Msa)及平均横截面积(Velo-Mean)、口咽正中矢状面积(Oro-Msa)及最小横截面积(Oro-Min)、喉咽正中矢状面积(Hypo-Msa)及平均横截面积(Hypo-Mean)比较,病例组均明显小于对照组,差异有统计学意义(P<0.05);2 组舌咽正中矢状面积(Glosso-Msa)及平均横截面积(Glosso-Mean)、口咽平均横截面积(Oro-Mean)、喉咽最小横截面积(Hypo-Min)、C2 水平横截面积(C2-Area)及C3 水平横截面积(C3-Area)比较,差异无统计学意义(P>0.05)(表2)。
表2 2 组病例气道3D-CT 体积及面积测量结果的比较(±s,mm)Tab 2 Comparison of volumetric and area measurements of the upper airway 3D-CT between the two groups (±s, mm)
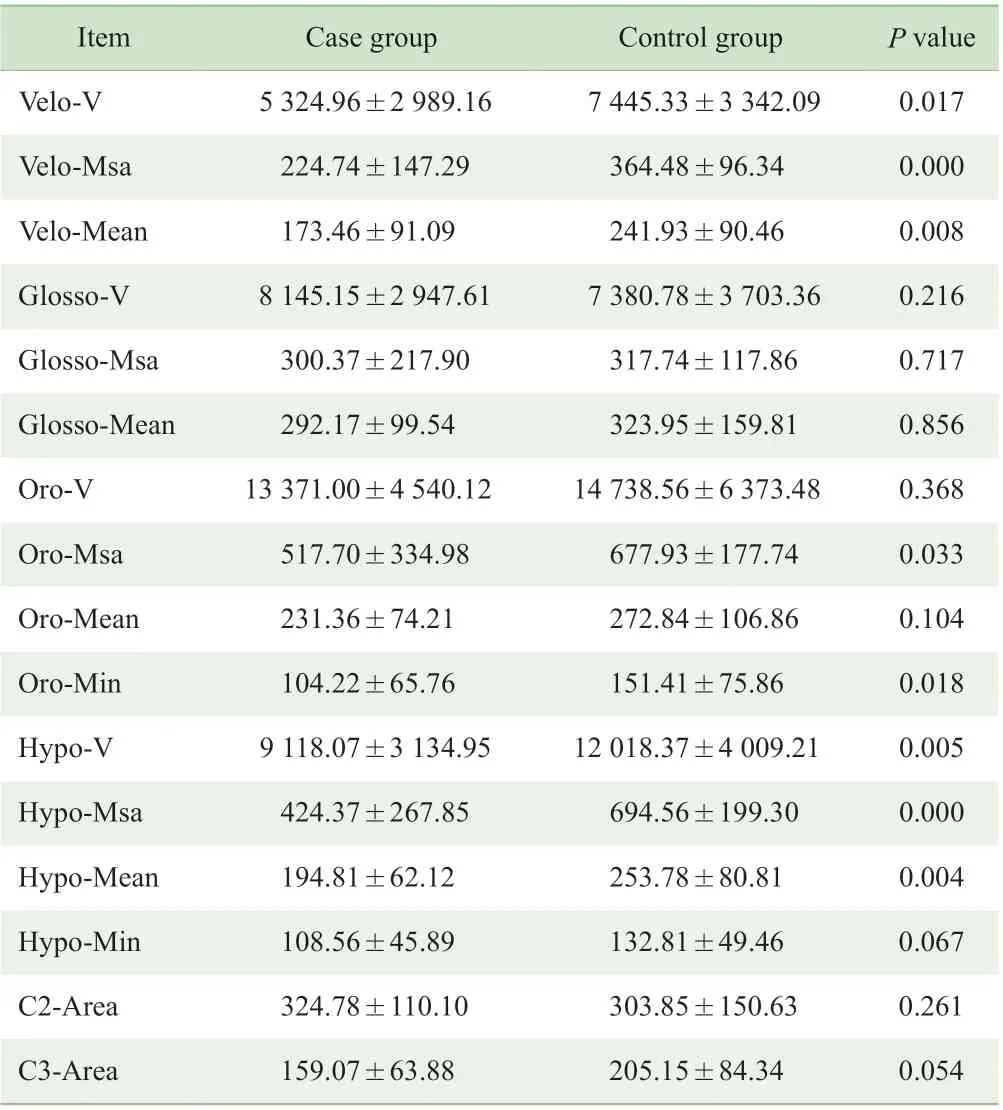
表2 2 组病例气道3D-CT 体积及面积测量结果的比较(±s,mm)Tab 2 Comparison of volumetric and area measurements of the upper airway 3D-CT between the two groups (±s, mm)
Item Case group Control group P value Velo-V 5 324.96±2 989.16 7 445.33±3 342.09 0.017 Velo-Msa 224.74±147.29 364.48±96.34 0.000 Velo-Mean 173.46±91.09 241.93±90.46 0.008 Glosso-V 8 145.15±2 947.61 7 380.78±3 703.36 0.216 Glosso-Msa 300.37±217.90 317.74±117.86 0.717 Glosso-Mean 292.17±99.54 323.95±159.81 0.856 Oro-V 13 371.00±4 540.12 14 738.56±6 373.48 0.368 Oro-Msa 517.70±334.98 677.93±177.74 0.033 Oro-Mean 231.36±74.21 272.84±106.86 0.104 Oro-Min 104.22±65.76 151.41±75.86 0.018 Hypo-V 9 118.07±3 134.95 12 018.37±4 009.21 0.005 Hypo-Msa 424.37±267.85 694.56±199.30 0.000 Hypo-Mean 194.81±62.12 253.78±80.81 0.004 Hypo-Min 108.56±45.89 132.81±49.46 0.067 C2-Area 324.78±110.10 303.85±150.63 0.261 C3-Area 159.07±63.88 205.15±84.34 0.054
病例组患者的口咽最小横截面左右径(Oro-LAT)小于对照组,C2 水平咽后壁黏膜厚度(C2-ST)及C3 水平咽后壁黏膜厚度(C3-ST)大于对照组,差异有统计学意义(P<0.05);口咽最小横截面前后径(Oro-AP)、喉咽最小横截面前后径(Hypo-AP)及左右径(Hypo-LAT)在2组间比较,差异无统计学意义(P>0.05)(表3)。
表3 2 组病例3D-CT 径线测量结果的比较(±s,mm)Tab 3 Comparison of linear measurements between the two groups (±s, mm)
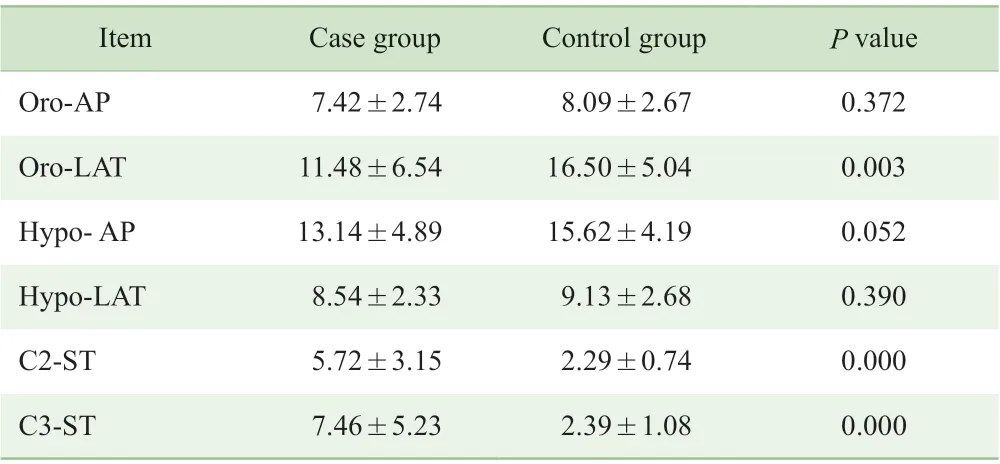
表3 2 组病例3D-CT 径线测量结果的比较(±s,mm)Tab 3 Comparison of linear measurements between the two groups (±s, mm)
Item Case group Control group P value Oro-AP 7.42±2.74 8.09±2.67 0.372 Oro-LAT 11.48±6.54 16.50±5.04 0.003 Hypo- AP 13.14±4.89 15.62±4.19 0.052 Hypo-LAT 8.54±2.33 9.13±2.68 0.390 C2-ST 5.72±3.15 2.29±0.74 0.000 C3-ST 7.46±5.23 2.39±1.08 0.000
在病例组中,有2 例患者气道未受压,25 例(92.6%)患者出现不同程度的气道受压,其中轻度受压者2 例(7.4%),中重度受压移位者14 例(51.9%),9 例(33.3%)患者气道明显移位;16 例(59.3%)患者感染未累及会厌,8例(29.6%)患者会厌轻度肿胀,3 例(11.1%)患者会厌重度受累;气道受压范围超过环状软骨水平者17 例(63.0%)。
2.3 3D-CT 测量指标与困难气道相关性的Logistic 回归分析
单因素Logistic 回归分析结果显示,腭咽体积(Velo-V)、腭咽正中矢状面积(Velo-Msa)、腭咽平均横截面积(Velo-Mean)、口咽正中矢状面积(Oro-Msa)、口咽最小横截面积(Oro-Min)、喉咽体积(Hypo-V)、喉咽正中矢状面积(Hypo-Msa)、喉咽平均横截面积(Hypo-Mean)、口咽最小横截面左右径(Oro-LAT)、C2 水平咽后壁黏膜厚度(C2-ST)及C3 水平咽后壁黏膜厚度(C3-ST)均与困难气道具有相关性(P<0.05)(表4)。进一步进行多因素Logistic 回归分析,校正患者年龄(≥55 岁)和BMI(≥26 kg/m2)差异对分析结果的影响,结果显示:腭咽正中矢状面积(Velo-Msa)、口咽正中矢状面积(Oro-Msa)、喉咽正中矢状面积(Hypo-Msa)、喉咽体积(Hypo-V)、喉咽平均横截面积(Hypo-Mean)、C2 水平咽后壁黏膜厚度(C2-ST)及C3 水平咽后壁黏膜厚度(C3-ST)与困难气道具有相关性(P<0.05)(表4)。
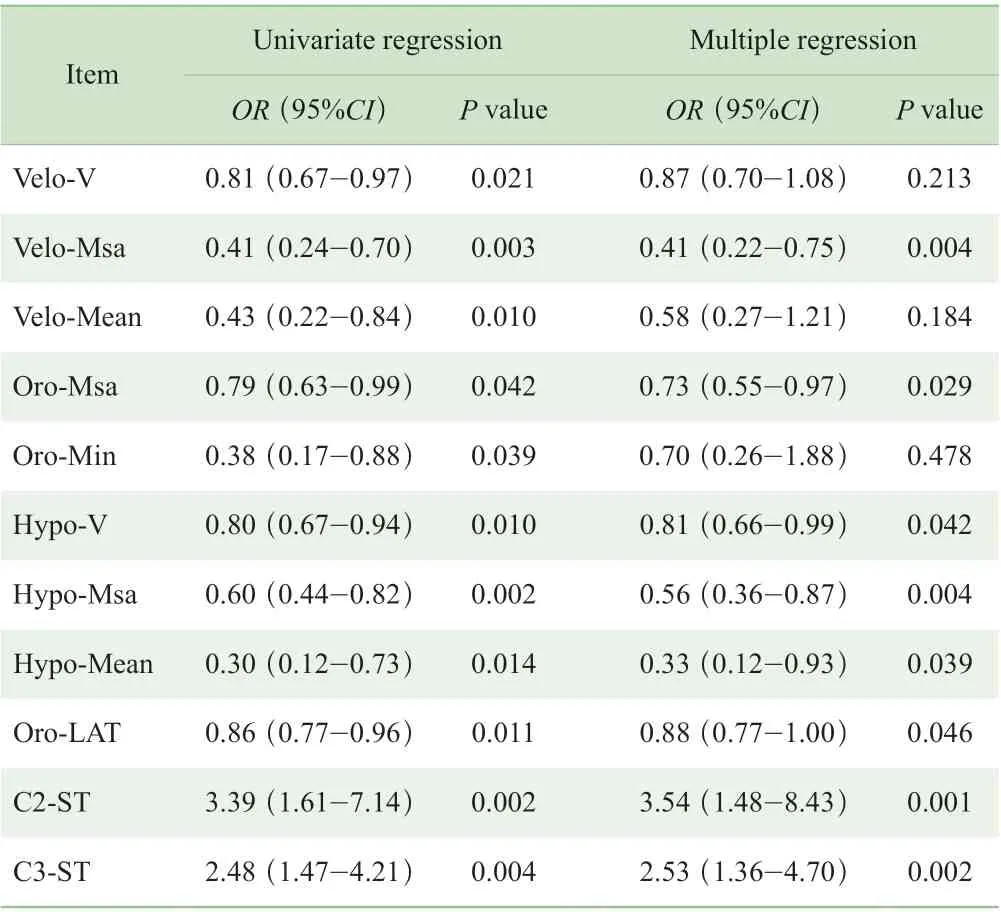
表4 测量指标与困难气道相关性的Logistic 回归分析结果Tab 3 Results of Logistic regression analysis of measurement indexes and difficult airway
3 讨论
口腔颌面部间隙感染易累及咀嚼肌间隙、咽旁间隙、口底间隙及气管前间隙等深部组织间隙,造成不同程度的气道受压、会厌水肿和张口受限等,引起气管插管困难或面罩通气困难[7]。对于已预测困难气管插管或困难面罩通气的患者,建议选择清醒镇静表面麻醉下气管插管,紧急情况下应选择气管切开等有创工具或方法[8]。虽然此类患者困难气道发生率高,但并非所有颌面部间隙感染患者均属于困难气道。在本研究中并未将所有颌面部间隙感染患者作为实际的困难气道病例,病例组纳入的为经麻醉医师评估的已预测困难气道患者,这部分患者均接受了清醒镇静表面麻醉气管插管或气管切开。非颌面部间隙感染患者也并非均属于非困难气道病例,因本研究是回顾性研究,对照组纳入的为经麻醉医师评估,且经过直视喉镜或者可视喉镜一次性插管成功的非困难气道正常患者。同时,病例组入组的为已预测困难气道患者,也是本研究中气道受压比例较高的原因。
CT 检查方便快捷,是颌面部间隙感染患者首选及必备的影像学检查方法[9],可作为此类患者气道评估的首选影像学气道评估方法。然而,目前临床上以二维 CT 检查为主,只能提供断层内的组织信息,无法显示组织的三维形态和组织间的毗邻关系。气道3D-CT 重建可以对整个气道的软硬组织结构进行显示,获得多平面、多角度的上气道解剖信息,帮助麻醉医师直观地观测到咽后、会厌、颈部的肿胀情况,以及异常的气道解剖改变,更准确地评估患者是否存在困难气道[10]。研究[11]表明,Dolphin 软件中的气道重建模块可迅速、准确地重建气道的三维结构,并可进行角度、线距、面积和体积的测量,在气道的三维测量分析中具有明显优势。
因颌面部间隙感染患者常伴随不同程度的气道受压变形,因此在本研究中以后鼻棘点、颈椎椎体前下缘水平线等骨性解剖结构作为气道口咽及喉咽的分界[12],而非以常规的软组织结构分界,以更客观地评价上气道不同部分的受压情况。
本研究病例组中92.6%的气道出现不同程度的压迫,口咽最小横截面积及其左右径小于对照组。有研究[13]表明,气道最狭窄平面是增加气流阻力的主要原因,气道横截面积测量的重要性高于气道体积。但在本研究中,回归分析结果显示,口咽最小横截面积及其径线与困难气道的相关性较低。
颌面部间隙感染患者感染病灶易波及气道周围组织,腭咽作为肌性气道区域易受压;病例组中63%的患者气道受压范围超过环状软骨水平,导致喉咽区受压移位较严重;而舌咽区因有骨性结构支撑,不易产生变形移位。因此,在本研究中,病例组患者腭咽及喉咽体积、腭咽及喉咽平均横截面积均显著小于对照组,而舌咽体积及平均横截面积在2 组中无显著差异。其中,Logistic 回归分析结果提示,喉咽体积及平均横截面积与困难气道具有较高的相关性。
间隙感染影响气道的程度及对解剖结构的改变,往往决定麻醉医师是否需要采用更多方法及设备来管理气道。气道是否偏离中线位置及偏离程度,可简单地帮助医师判断其压迫程度,而气道的正中矢状面面积可客观反映这一事实。在本研究中,病例组腭咽、口咽及喉咽的正中矢状面积均小于病例组,且Logistic 回归分析结果显示,腭咽、口咽及喉咽正中矢状面面积均与困难气道具有较高的相关性。
通过影像技术测量的椎前软组织厚度可用于识别软组织异常,如椎前肿胀、肿瘤等[14]。研究[15]表明,颌面部间隙感染患者C2 和C3 水平的椎前软组织厚度即咽后壁厚度高于正常上限,而C4 和C5 水平因喉部和食管位置差异,以及吞咽状态的不同显示出较大差异。在本研究中,病例组C2 和C3 水平咽后壁厚度明显大于对照组,回归分析结果均显示出其与困难气道的相关性。
在本研究中,喉咽体积及平均横截面积、咽气道正中矢状面面积、C2 和C3 水平咽后壁厚度在颌面部间隙感染困难气道患者中有较大程度的改变,或可成为今后颌面部间隙感染患者预测困难气道的潜在指标,为进一步前瞻性研究奠定基础。
本研究存在局限性。首先,因为回顾性研究无法限定患者CT 摄片时的头部姿势及呼吸状态,因此无法避免其对三维测量数据的干扰;同时由于患者术前摄片时间的差异,以及感染进展速度的差异,均会对CT 测量数据产生影响。其次,虽然麻醉医师对于困难气道的处理均遵循一定的指南,但不同麻醉医师对于患者气道状态的评估及采取的处理措施会略有差异,所以无法保证入组患者的一致性。最后,本研究缺少患者麻醉诱导时的详细气道评估数据,无法对CT 测量数据与真实困难气道评估情况进行敏感性分析,尚需前瞻性试验进一步研究。
综上所述,气道3D-CT 重建可以清晰地显示颌面部间隙感染患者的气道解剖情况,直观立体地观察气道形态及大小的变化。其中,咽气道正中矢状面面积、喉咽体积及平均横截面积、C2 和C3 水平咽后壁厚度或可成为颌面部间隙感染患者困难气道的预测指标。
参·考·文·献
[1] Cook TM, Woodall N, Frerk C, et al. Major complications of airway management in the UK: results of the Fourth National Audit Project of the Royal College of Anaesthetists and the Difficult Airway Society. Part 1: anaesthesia[J]. Br J Anaesth, 2011, 106(5): 617-631.
[2] Ovassapian A, Tuncbilek M, Weitzel EK, et al. Airway management in adult patients with deep neck infections: a case series and review of the literature[J]. Anesth Analg, 2005, 100(2): 585-589.
[3] Cho SY, Woo JH, Kim YJ, et al. Airway management in patients with deep neck infections: a retrospective analysis[J]. Medicine (Baltimore), 2016, 95(27): e4125.
[4] Osorio F, Perilla M, Doyle DJ, et al. Cone beam computed tomography: an innovative tool for airway assessment[J]. Anesth Analg, 2008, 106(6): 1803-1807.
[5] Christensen BJ, Park EP, Suau S, et al. Evidence-based clinical criteria for computed tomography imaging in odontogenic infections[J]. J Oral Maxillofac Surg, 2019, 77(2): 299-306.
[6] 何建德, 石慧敏, 卢晓蜂. 上气道三维CT 重建在睡眠呼吸障碍中的应用价值[J]. 中国口腔颌面外科杂志, 2006, 4(3): 166-170.
[7] Schumann M, Biesler I, Börgers A, et al. Tracheal intubation in patients with odentogenous abscesses and reduced mouth opening[J]. Br J Anaesth, 2014, 112(2): 348-354.
[8] Higgs A, McGrath BA, Goddard C, et al. Guidelines for the management of tracheal intubation in critically ill adults[J]. Br J Anaesth, 2018, 120(2): 323-352.
[9] Kim YJ, Kim JD, Ryu HI, et al. Application of radiographic images in diagnosis and treatment of deep neck infections with necrotizing fasciitis: a case report[J]. Imaging Sci Dent, 2011, 41(4): 189-193.
[10] Alwadei AH, Galang-Boquiren MTS, Kusnoto B, et al. Computerized measurement of the location and value of the minimum sagittal linear dimension of the upper airway on reconstructed lateral cephalograms compared with 3-dimensional values[J]. Am J Orthod Dentofacial Orthop, 2018, 154(6): 780-787.
[11] Park JW, Kim NK, Kim JW, et al. Volumetric, planar, and linear analyses of pharyngeal airway change on computed tomography and cephalometry after mandibular setback surgery[J]. Am J Orthod Dentofacial Orthop, 2010, 138(3): 292-299.
[12] Lenza MG, Lenza MM, Dalstra M, et al. An analysis of different approaches to the assessment of upper airway morphology: a CBCT study[J]. Orthod Craniofac Res, 2010, 13(2): 96-105.
[13] Lenza MG, Lenza MM, Dalstra M, et al. An analysis of different approaches to the assessment of upper airway morphology: a CBCT study[J]. Orthod Craniofac Res, 2010, 13(2): 96-105.
[14] Rojas CA, Vermess D, Bertozzi JC, et al. Normal thickness and appearance of the prevertebral soft tissues on multidetector CT[J]. AJNR Am J Neuroradiol, 2009, 30(1): 136-141.
[15] Detsky ME, Jivraj N, Adhikari NK, et al. Will this patient be difficult to intubate: the rational clinical examination systematic review[J]. JAMA, 2019, 321(5): 493-503.
——该叫矢状脊还是矢状隆起?

