核酸适配体sgc8 在急性白血病诊断中的应用研究
徐康力,马亚妮,王筱金,苗彦彦,韩 达#,谭蔚泓#
1.上海交通大学医学院附属仁济医院分子医学研究院,上海200127;2.上海交通大学医学院附属上海儿童医学中心,卫生部儿童血液肿瘤重点实验室,上海200127;3.上海交通大学医学院临床研究中心生物统计学教研室,上海 200025
急性白血病(acute leukemia,AL)是一类起源于造血系统的恶性疾病,主要包括急性髓系细胞白血病(acute myeloid leukemia,AML)和急性淋巴细胞白血病(acute lymphoblastic leukemia ,ALL),成人主要罹患AML,而儿童主要罹患ALL[1]。AL 的病死率较高[2],是一类对人类健康威胁较大的疾病。
多色流式细胞术具有高通量、高灵敏度、低检测限等特点,是对白血病进行免疫分型和微小残留病(MRD)监测的重要方法[3-4]。该方法主要用于寻找肿瘤细胞的特征性标志物,然而并非每个患者都能利用现有的抗体组合找到,而即便有特征性的抗原表达,也可能存在抗原漂移现象,即肿瘤细胞的免疫表型可能会在疾病发展过程中发生变化导致无法追踪[3,5],但可通过增加抗体的数量来降低这种不利影响[6]。因此,许多新型抗体被开发出来用于流式细胞术的AL 诊断[7]。然而,这些抗体的数量有限,并且从发现到应用的周期很长,如用于AML 诊断的免疫分型抗体组合在过去20 年几乎没有改变,限制了流式细胞术在AL 诊断中的应用[7]。
核酸适配体是一类人工筛选、合成、可修饰的寡核苷酸链,它通过形成特定的空间结构与靶分子或目标细胞结合,具有类似抗体的特异性[8]。利用指数富集配体系统进化(systematic evolution of ligand and by exponential enrichment,SELEX)技术,可以将核酸适配体的筛选与生产时间控制在2 ~8 周,而抗体的生产时间长达6 个月以上,因此它代表了一种能够快速开发针对靶标的新型配体技术[9-11]。与抗体相比,筛选出的核酸适配体具有化学性质稳定、批间差异小、易于修饰、生产成本低等优点,在多种诊断研究中备受关注[9]。Shangguan 等[12]利用细胞之间抗原表达的差异,筛选出具有T-ALL 细胞株CEM 细胞特异性的核酸适配体sgc8,其靶标为蛋白酪氨酸激酶7(protein tyrosine kinase,PTK7)[13-16]。Yu 等[14]利 用sgc8开发了一种高灵敏检测器用于白血病早期诊断。Mironov等[15]用金属同位素标记sgc8,用于质谱流式细胞术对白血病细胞的检测。然而尚未见将核酸适配体作为诊断工具,直接用于流式细胞术对AL 样本检测的报道。本研究利用核酸适配体sgc8 在流式细胞仪上直接对AL 骨髓样本进行检测,以研究其对不同骨髓细胞群的识别能力,探究sgc8 在急性白血病诊断中的应用价值。
1 材料与方法
1.1 研究对象
人急性T 淋巴细胞白血病(T-ALL)细胞株CEM 细胞及人慢性髓系细胞白血病(chronic myeloid leukemia ,CML)细胞株K562 细胞购于中国科学院细胞库。白血病骨髓样本来自上海交通大学医学院附属上海儿童医学中心,保存于肝素抗凝管中,骨髓样本获取和使用符合医院伦理委员会要求。共收集4 组共83 例样本,包括AML 样本45 例、T-ALL 样本19 例、B-ALL 样本9 例,正常样本10 例。所有样本均进行了骨髓形态学分析和流式细胞白血病免疫分型鉴定。本研究经上海交通大学医学院附属仁济医院伦理委员会批准(编号:RA-2019-070)。
1.2 试剂与仪器
清洗液[ 含有4.5 g/L 葡萄糖及5 mmol/L MgCl2的杜氏磷酸缓冲液(Dulbecco's phosphate-buffered saline,DPBS) ],结合缓冲液[含有0.1 mg/mL 酵母转移核糖核酸(tRNA)及1 mg/mL 牛血清白蛋白(BSA)的清洗液],均由实验室配制。Gibco DPBS(1×)、Gibco RPMI-1640 培养基、胎牛血清(fetal bovine serum,FBS)均购自美国Thermo Fisher 公司。离心管、细胞培养瓶、一次性移液管均购自美国Corning 公司。单克隆抗体CD7 PE(phycoerythrin)、CD45 PerCP(peridinin-chlorophyllprotein complex)、CD19 APC(allophycocyanin)、CD33 APC、CD34 APC、IgG1 APC、HLA-DR APC-H7(allophycocyanin-Hilite®7)、细胞裂解液BD Pharm LyseTMLysing Buffer(主要成分为NH4Cl 溶液)以及流式细胞仪 BD FACS Canto II 购自美国BD 公司;单克隆抗体PTK7 APC 购自德国Miltenyi 公司;MgCl2溶液(浓度为1 mol/L)、葡萄糖、BSA 均购自美国Invitrogen 公司。酵母tRNA 购自上海迈基生物技术有限公司;离心机和微量加样枪购自德国Eppendorf 公司;血细胞计数板购自上海市求精生化试剂仪器有限公司;3D 混匀器购自江苏海门其林贝尔仪器制造有限公司 。
1.3 研究方法
1.3.1 核酸适配体的合成、保存及使用 核酸适配体sgc8 及其对照随机文库链(Lib)的核酸序列见表1。核酸适配体经5-羧基荧光素(5-carboxyfluorescein,FAM)标记,由生工生物工程(上海)股份有限公司合成。合成产物为粉末状,用三蒸水将其溶解成浓度为10 μmol/L 的溶液,并根据使用量进行分装,分装的核酸适配体溶液保存于-20 ℃冰箱内,使用全程避光。

表1 适配体的核酸序列Tab 1 Aptamer nucleic acid sequence
1.3.2 白血病细胞株的培养及其与核酸适配体、PTK7 抗体的结合试验 CEM 和K562 细胞均培养在含有10% FBS的 1640 培养基中,培养条件为 37 ℃、5% CO2。取培养的细胞,用清洗液洗涤2 次,离心条件为300×g5 min,再用结合缓冲液重悬,取3×105细胞加入EP 管中,再用结合缓冲液补足至194 μL 后,加入6 μL 10 μmol/L 核酸适配体溶液,使反应总体积为200 μL,核酸适配体终浓度为300 nmol/L。EP 管在4 ℃条件下置于3D 混匀器上避光孵育30 min 后,用清洗液洗涤2 遍,最后用200 μL 清洗液重悬,置于冰上避光,等待流式细胞仪检测。
培养细胞洗涤后,用1×DPBS 溶液重悬后计数,取2×105细胞加入流式管中,再加入1 μL APC 标记的PTK7抗体,混匀后避光孵育15 min,用2 mL 1×DPBS 溶液洗涤1 遍后,离心沉淀用200 μL 1× DPBS 溶液重悬,置于冰上避光,等待流式细胞仪检测。
1.3.3 骨髓样本细胞与核酸适配体结合试验 将模拟的白血病骨髓样本细胞(白血病细胞CEM 或K562 分别与正常骨髓细胞,按照2:1 的比例混合)及不同组的骨髓样本细胞计数后取一定量细胞,分别用1×红细胞裂解液处理,室温孵育15 min,300×g离心5 min 后,通过清洗液洗涤2 遍,去除红细胞。获得的骨髓有核细胞用结合缓冲液重悬,取3×105细胞加入EP 管中,再用结合缓冲液补足至188 μL,再加入6 μL 10 μmol/L 核酸适配体溶液及6 μL 骨髓样本对应的骨架抗体组合(表2),使反应终体积为200 μL,核酸适配体终浓度为300 nmol/L。EP 管在4 ℃条件下置于3D 混匀器上避光孵育30 min 后,用清洗液洗涤2 次,去除未结合的抗体后,用200 μL 清洗液重悬,置于冰上等待。
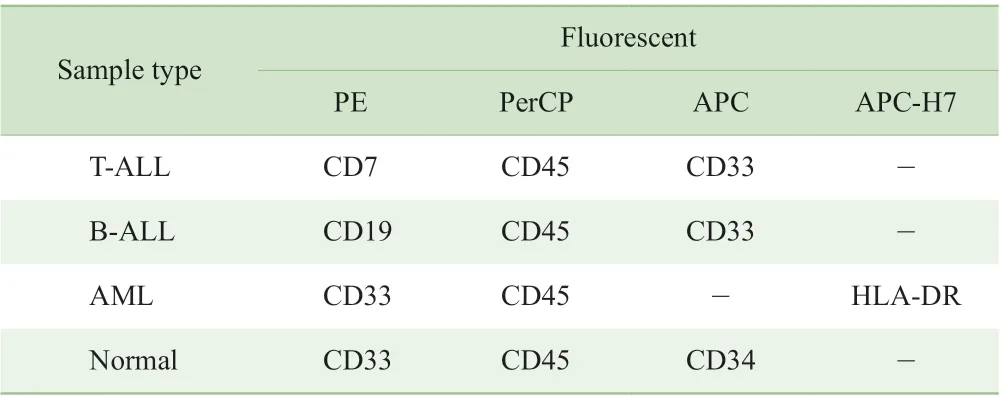
表2 不同骨髓样本的骨架抗体组合Tab 2 Backbone antibody panels for bone marrow samples
1.3.4 流式细胞仪检测与分析 用BD Canto II 流式细胞仪和BD FACS Diva 8.0 软件获取细胞,通过SSC/CD45 设门识别有核细胞:模拟及临床急性白血病骨髓细胞样本,收集有核细胞2 万个;正常骨髓样本,收集有核细胞5 万个。流式细胞仪有3 种激光8 个通道,各通道设置的电压和补偿条件与临床白血病免疫分型所采用的条件相同。BD FACS Diva 8.0 和Flowjo10.4 软件进行流式细胞的数据分析。
因荧光素FAM 与异硫氰酸荧光素(FITC)发射光波长类似,收集的细胞经骨架抗体组合分群后,分别在含有核酸适配体sgc8 的实验管(sgc8 管)及含有随机文库链Lib 的对照管(Lib 管)中,检测其在FITC 通道中的信号。以细胞群在Lib 管的荧光信号为参照设置阳性门,使Lib 管中细胞群95%以上的细胞在该阳性门外,再记录sgc8 管中阳性门内的细胞百分比。sgc8 结合阳性结果判断标准:同一群细胞在sgc8 管与Lib 管内阳性门的百分比差值(d值) >20%。值得注意的是,同样的标本在不同的检测系统内,平均荧光强度(median fluorescence intensity,MFI)是不同的,不具备可比性,所以在本实验中并未采用该值作为研究对象。
1.4 统计学分析
采用SAS 9.4 软件对数据进行分析。定性数据用n(%) 表示,非正态分布的数据使用Kruskal-Wallis 检验。P<0.05认为差异有统计学意义。
2 结果
2.1 白血病细胞株PTK7 蛋白的表达水平
核酸适配体sgc8 识别的靶标为PTK7 蛋白[13],因此本研究使用了PTK7 蛋白高表达的CEM 细胞株和PTK7蛋白低表达的K562 细胞株。为了明确白血病细胞株CEM细胞和K562 细胞PTK7 蛋白的表达情况,本研究用PTK7抗体及同型对照对2 株细胞进行检测。结果表明,CEM细胞高表达PTK7 蛋白,而K562 细胞低表达或不表达PTK7 蛋白(图1)。
2.2 sgc8 对白血病细胞株的识别能力
为了研究核酸适配体检测骨髓样本方法的有效性,我们在正常骨髓细胞样本中,分别加入PTK7 蛋白高表达的CEM 细胞及其阴性对照K562 细胞(PTK7 蛋白低表达),制成模拟的白血病骨髓样本,来探究核酸适配体sgc8 在骨髓样本中对2 种细胞是否仍具有不同的识别能力。本研究按照核酸适配体对骨髓样本的检测流程,对样本用红细胞裂解液进行处理,去除红细胞;然后,洗涤制成细胞悬液,再将其与核酸适配体、对应骨架抗体组合一起置于4 ℃冰箱避光孵育30 min,利用流式细胞仪对洗涤后的细胞悬液进行检测(图2)。
我们通过骨架抗体组合区分肿瘤细胞群与正常细胞群,并检测它们在Lib 管和sgc8 管内FITC 通道信号偏移情况。我们发现,在加有CEM 细胞的骨髓样本中,肿瘤细胞(CD7+CD33-CD45strongSSCmedium)在sgc8 管较Lib 管有明显的信号偏移,而样本内其他细胞未见明显偏移(图3)。 同时,在加有对照细胞K562 细胞的骨髓样本中,肿瘤细胞(CD7-CD33+CD45strongSSCmedium)与其他正常细胞在sgc8 管较Lib 管均未见明显偏移(图4)。结果显示:sgc8 可以在骨髓细胞样本中特异性识别靶细胞CEM 细胞,而不识别对照细胞K562 细胞及其他成熟细胞群。结果提示,核酸适配体sgc8 在骨髓样本中对2 种细胞仍具有不同的识别能力。
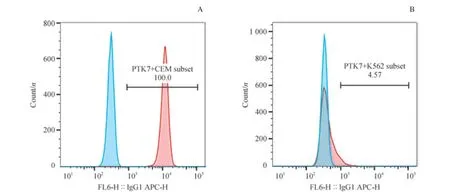
图1 CEM 细胞与K562 细胞的PTK7 蛋白表达水平Fig 1 Expression level of PTK7 protein in CEM cells and K562 cells
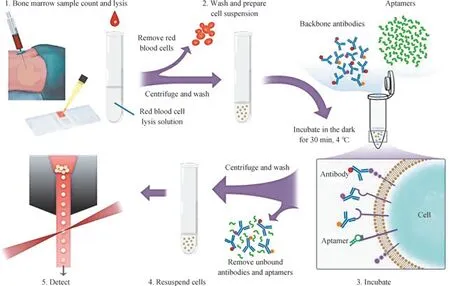
图2 核酸适配体和抗体的骨髓样本检测流程Fig 2 Detection procedure of bone marrow samples using aptamers and antibodies
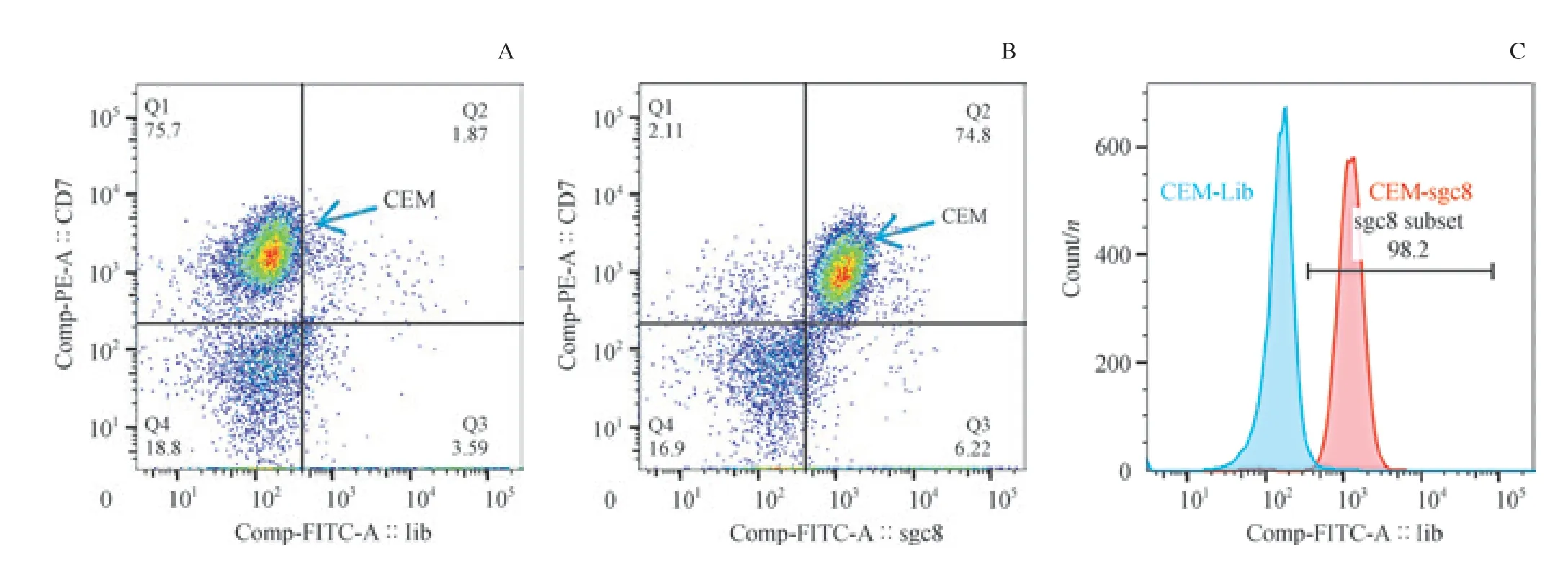
图3 sgc8 在模拟白血病骨髓样本中识别CEM 细胞的流式细胞术结果Fig 3 Recognition of sgc8 to CEM cells in the normal bone marrow sample mixed with CEM cells by flow cytometry
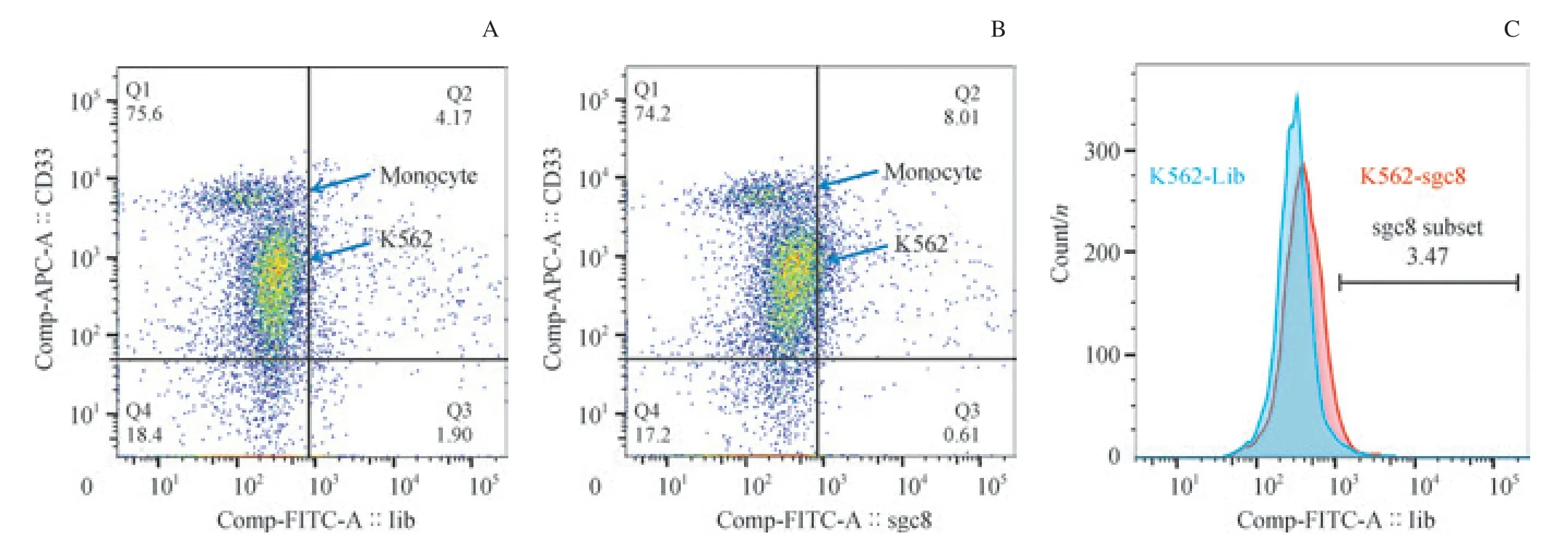
图4 sgc8 在模拟白血病骨髓样本中未识别K562 细胞的流式细胞术结果Fig 4 Recognition of sgc8 to K562 cells in the normal bone marrow sample mixed with K562 cells by flow cytometry
2.3 核酸适配体sgc8 对髓系原始细胞的特异性识别能力
本研究中,为了验证sgc8 对正常骨髓样本内各群细胞的识别能力是否存在差异,我们利用骨架抗体组合及SSC、FSC 2 个参数,对正常骨髓样本中的细胞进行分群,如图5A 所示,共分为6 群细胞:髓系原始细胞Blast 细胞(CD33+CD34+CD45-SSClow)、 早 前B 细 胞(Pro-B 细胞,CD19+CD33-CD34+CD45+SSClow)、前B 细胞(Pre-B细胞,CD19+CD33-CD34+CD45+SSClow)、成熟淋巴细胞(CD33-CD34-CD45strongSSClow)、成熟粒细胞(CD33+CD34-CD45+SSChigh)及单核细胞(CD33+CD34-CD45+SSCmedium)。然后,利用各群细胞在Lib 管FITC 通道设置阳性门,分别检测其在sgc8 管及Lib 管内阳性门的百分比,结果如图5B 所示,并计算两者d值。如图5C 所示,我们发现,正常骨髓样本内,各群细胞d值的中位数分别为:Blast 细胞(65.85%) >Pro-B 细胞(9.45%) > 成熟单核细胞(3.60%)> 成熟粒细胞(1.30%) > Pre-B 细胞(0.60%) > 成熟淋巴细胞(0.35%),Blast 细胞的d值显著高于其他细胞的d值,包括与它同为CD34+的Pro-B 细胞,且它们之间的差异有统计学意义(P=0.000)。同时,对sgc8 结合阳性率的研究显示,Blast 细胞在10 个样本中有9 个具有sgc8 结合阳性,具有较高阳性率(9/10,90.0 %),其余细胞仅1 例Pro-B 细胞出现阳性,该类细胞阳性率为(1/8,12.5%),而其他各群细胞均未见sgc8 结合阳性。结果显示,sgc8在正常骨髓细胞样本中,对Blast 细胞具备特异性识别能力,而对其他早期和成熟细胞无显著识别能力。
2.4 核酸适配体sgc8 对AML 样本内肿瘤细胞的特异性识别能力
为了研究sgc8 对AML 样本内各群细胞的识别能力,我们对AML 骨髓样本中的肿瘤细胞(AML 细胞)、成熟淋巴细胞、成熟粒细胞的结果进行了研究,并同时对比了AML 细胞与正常骨髓Blast 细胞(CD33+CD34+CD45+SSClow)的结果。利用在Lib 管FITC 通道设置的阳性门,我们分别检测了各群细胞在sgc8 管及Lib 管内阳性门的百分比,结果如图6A 所示;计算两者d值,如图6B 所示,我们发现,AML 样本内各群细胞d值的中位数为:AML 细胞(37.50%) >成熟淋巴细胞(2.30%) >成熟粒细胞(1.70%)。AML 细胞的d值显著高于与其样本内的成熟淋巴细胞和成熟粒细胞的d值,且它与后两者之间的差异有统计学意义(P=0.000)。尽管AML 细胞的d值与Blast 细胞的d值相比,后者的中位数(65.85%)要显著高于前者的中位数,但它们之间的差异无统计学意义(P=0.067)。同时,针对sgc8 结合阳性率的研究也显示,在45 个AML 骨髓样本中,有36 个样本的AML 细胞显示出sgc8 结合阳性,阳性率为80.0%(36/45),接近正常骨髓Blast 细胞的结果(90.0%);而此结果也远高于成熟淋巴细胞和成熟粒细胞的sgc8 结合阳性率,它们分别为2.2%和2.6%。结果表明,sgc8 在AML 骨髓细胞样本中对AML 细胞具有特异性识别能力,而对其他细胞群未见明显识别;但它对AML 细胞的识别能力与对正常骨髓Blast 细胞的识别能力之间没有差别。
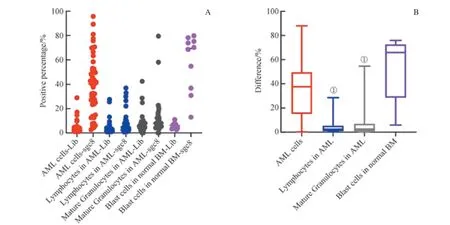
图6 核酸适配体sgc8 对AML 骨髓样本内各细胞群及正常骨髓Blast 细胞的识别Fig 6 Recognition of each cell population of AML samples and blast cells of normal bone marrow samples by aptamer sgc8
为了研究sgc8 对AML 各亚型肿瘤细胞的识别能力是否存在差异,我们根据骨髓形态学的结果,将AML 肿瘤细胞(AML 细胞)分为6 个亚型:急性粒细胞白血病未分化与部分分化型(M1/M2)、急性早幼粒细胞白血病(M3)、急性粒单核细胞白血病(M4)、急性单核细胞白血病(M5)、急性巨核细胞白血病(M7)及未明确类型(NK),我们比较了它们d值的差异。如图7 所示,我们发现,各亚型AML 细胞d值的中位数为:M7(66.70%) > M4(56.25%) > NK(39.55%) > M3(29.60%) > M5(27.95%) > M1/M2(20.20 %)。为了研究这些数据之间的差异是否存在统计学意义,我们以M1/M2 细胞的d值为参照进行比较,结果发现,仅M7 细胞的d值与它之间的差异有统计学意义(P=0.006);而与其他AML 细胞亚型之间差异无统计学意义:M3(P=0.914),M4(P=0.233),M5(P=0.635),NK(P=0.102)。鉴 于M3、M4 细 胞 标本数较少,NK 细胞未明确类型,我们着重比较了M1/M2、M5、M7 之间d值的差异,发现它们三者之间的差异有统计学意义(P=0.027)。究其原因,我们又对M5、M7 的d值进行比较,结果显示它们之间的差异有统计学意义(P=0.032)。结果表明,sgc8 对M7 细胞的识别能力显著高于M1/M2 及M5 细胞,而后两者之间无明显差别。同时,我们也研究了各亚型AML 细胞的sgc8 结合阳性率,结果表明,除了样本量较少的M3、M4 和不确定的NK 细胞均为100%外,sgc8 对M7 细胞的识别阳性率也为100 %,大于M5 细胞的68.8 %及M1/M2 细胞的53.3%(P≥0.05)。结果表明,除M7 外,sgc8 对其余亚型AML 细胞的识别无显著差别,且对M7 的识别能力显著高于M1/M2 及M5 细胞。
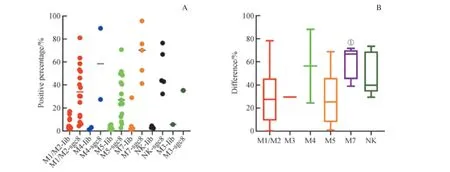
图7 核酸适配体sgc8 对AML 各亚型肿瘤细胞的识别Fig 7 Recognition of cancer cells in various AML subtypes by aptamer sgc8
2.5 核酸适配体sgc8 对T-ALL 样本内肿瘤细胞的特异性识别能力
为了研究sgc8 对T-ALL 骨髓样本内各群细胞的识别能力是否存在差异,我们对样本内的肿瘤细胞(T-ALL 细胞)、成熟淋巴细胞、成熟粒细胞的结果进行了研究,并同时对比了正常骨髓样本中的成熟淋巴细胞。如图8 所示,我们发现,各群细胞在sgc8 管与Lib 管阳性门内d值的中位数为:T-ALL 细胞(35.40%) > T-ALL 中成熟粒细胞(2.50%) > T-ALL 中成熟淋巴细胞(2.10%) > 正常骨髓成熟淋巴细胞(0.35%)。T-ALL 细胞的d明显高于其样本内的成熟淋巴细胞、成熟粒细胞及正常骨髓成熟淋巴细胞的d值,且它们之间的差异有统计学意义(P=0.000)。同时,在sgc8 结合阳性率方面,19 个样本中,有14个样本的T-ALL 细胞表现结合阳性,阳性率为78.9%(14/19),而其他细胞则未见sgc8 结合阳性。结果表明,sgc8 在T-ALL 骨髓细胞样本中可以特异性识别T-ALL 细胞,而不识别样本内的其他成熟细胞群。
为了研究sgc8 对不同亚型T-ALL 肿瘤细胞的识别能力是否存在差异,我们从T-ALL 中分出一类特别的亚型,即早前T 淋巴细胞白血病(early T-cell precursor lymphoblastic leukaemia,ETP)。 根 据WHO 的 分 类 标准,T-ALL 样本免疫表型特征为CD7 阳性、胞质CD3阳性。ETP 肿瘤细胞的免疫表型为CD1a 和CD8 阴性,CD5 阴性或者弱阳性(弱阳性指的是肿瘤细胞阳性率低于75.00%),胞膜CD3 阴性(极少数情况CD3 阳性),同时至少表达1 种下列抗原:CD34、CD117、HLA-DR、CD13、CD33、CD11b、CD65[17]。我们比较了常规T-ALL与ETP 肿瘤细胞在sgc8 管及Lib 管内阳性门d值的情况。如图9 所示,我们发现,ETP 中的肿瘤细胞(ETP 细胞)与T-ALL 中的肿瘤细胞(T-ALL 细胞)的d值差异无统计学意义(P≥0.05);且对sgc8 结合阳性率的研究也表明,ETP 细胞与T-ALL 细胞也有类似的阳性率,两者分别为75.00%和73.30%。结果表明,sgc8 对不同亚型T-ALL 的识别能力没有显著差异。
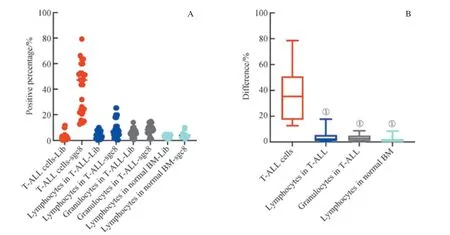
图8 核酸适配体sgc8 对T-ALL 骨髓样本内各细胞群及正常骨髓淋巴细胞的识别Fig 8 Recognition of each cell population in T-ALL samples and mature lymphocytes in normal bone marrow samples by aptamer sgc8
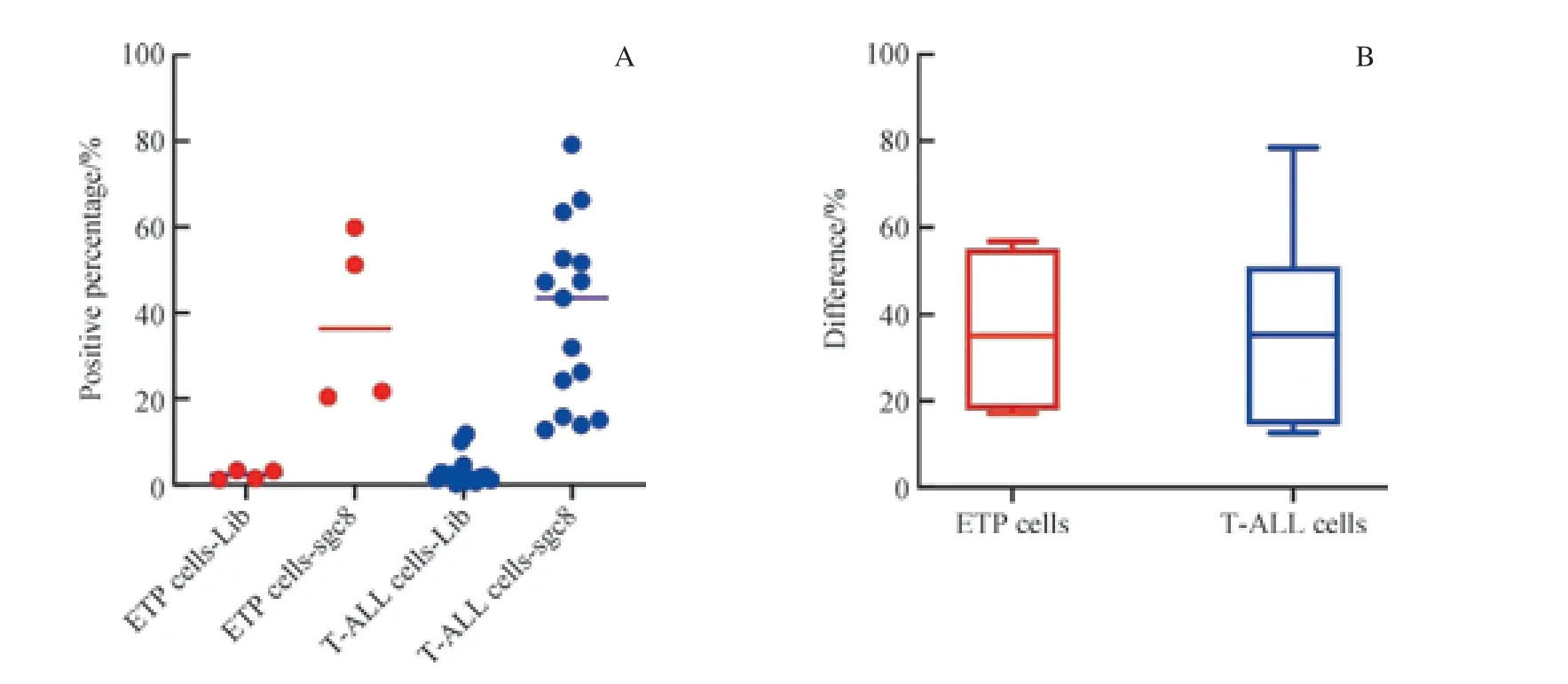
图9 核酸适配体sgc8 对ETP 细胞与T-ALL 细胞的识别Fig 9 Recognition of ETP cells and T-ALL cells by aptamer sgc8
2.6 核酸适配体sgc8 对B-ALL 样本内各群细胞的识别 能力
为了研究sgc8 对B-ALL 骨髓样本内各群细胞的识别能力是否存在差异,我们对样本内的肿瘤细胞(B-ALL 细胞)、成熟淋巴细胞、成熟粒细胞进行了比较研究,并同时对比了正常骨髓中的早期B 系细胞Pro-B 细胞和Pre-B 细胞。如图10 所示,我们发现,各群细胞在sgc8 管与Lib 管阳性门内d值的中位数为:Pro-B 细胞(9.45%) > B-ALL 细胞(6.50%) >B-ALL 中的成熟淋巴细胞(1.20%) >Pre-B 细胞(0.60%) > B-ALL 中的成熟粒细胞(0)。B-ALL 细胞与其样本内的成熟淋巴细胞和正常骨髓中的Pro-B 细胞d值之间的差异无统计学意义(P=0.102,P=0.386);而B-ALL与其样本内的成熟粒细胞及正常骨髓Pre-B 细胞之间的d值差异有统计学意义(P=0.002,P=0.028)。然而,各群细胞sgc8 识别阳性率研究显示,B-ALL 细胞、B-ALL 样本内的成熟粒细胞均未见与sgc8 结合,而B-ALL 样本中的成熟淋巴细胞仅有12.5 %的阳性率。结果表明,sgc8 对B-ALL骨髓样本内的各群细胞无显著识别能力。
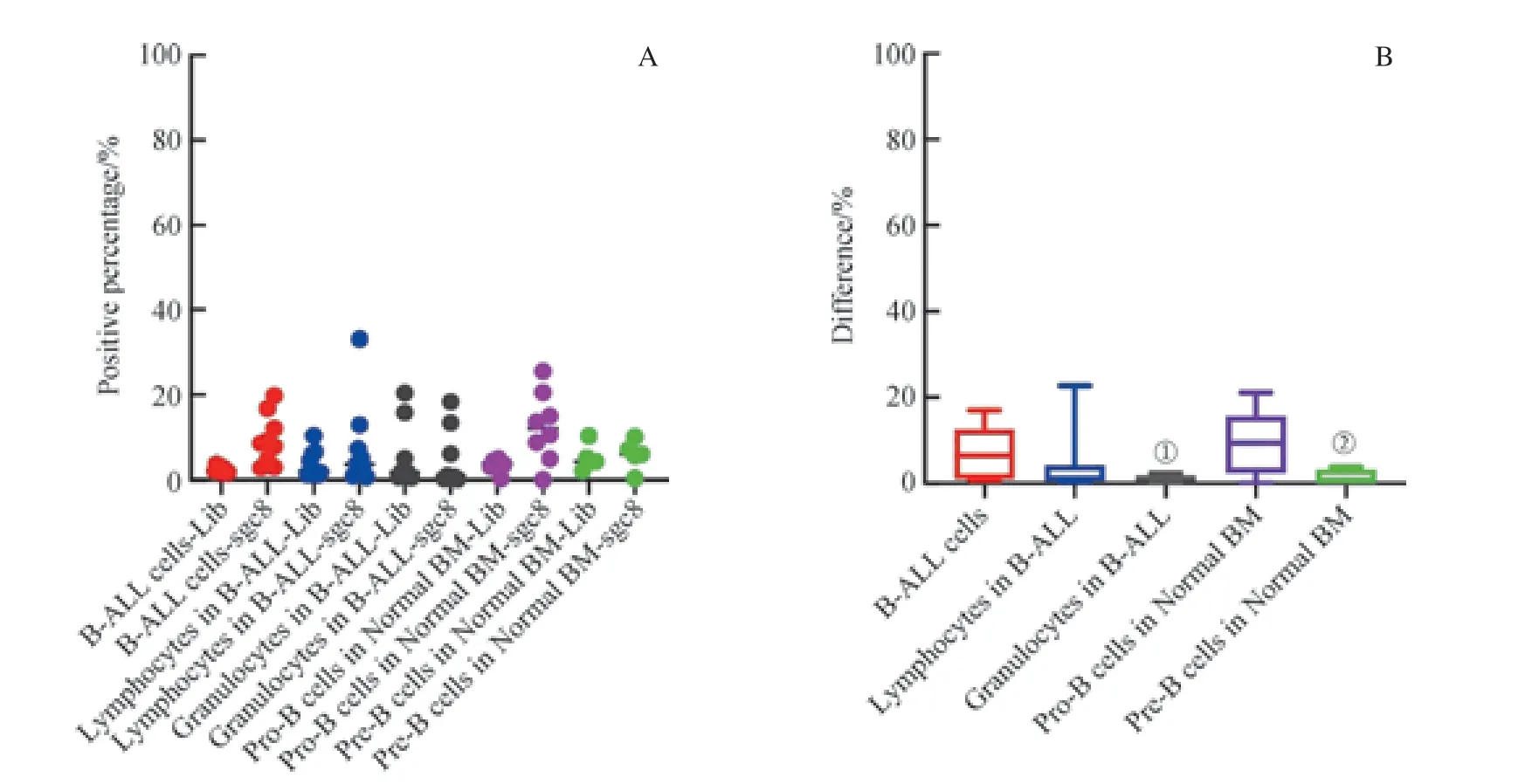
图10 核酸适配体sgc8 对B-ALL 骨髓样本内各细胞群及正常骨髓不成熟B 细胞的识别Fig 10 Recognition of each cell population in B-ALL samples and immature B cells in normal bone marrow samples by aptamer sgc8
2.7 核酸适配体sgc8 对不同AL 肿瘤细胞及正常骨髓(CD34+)早期细胞的识别能力差异
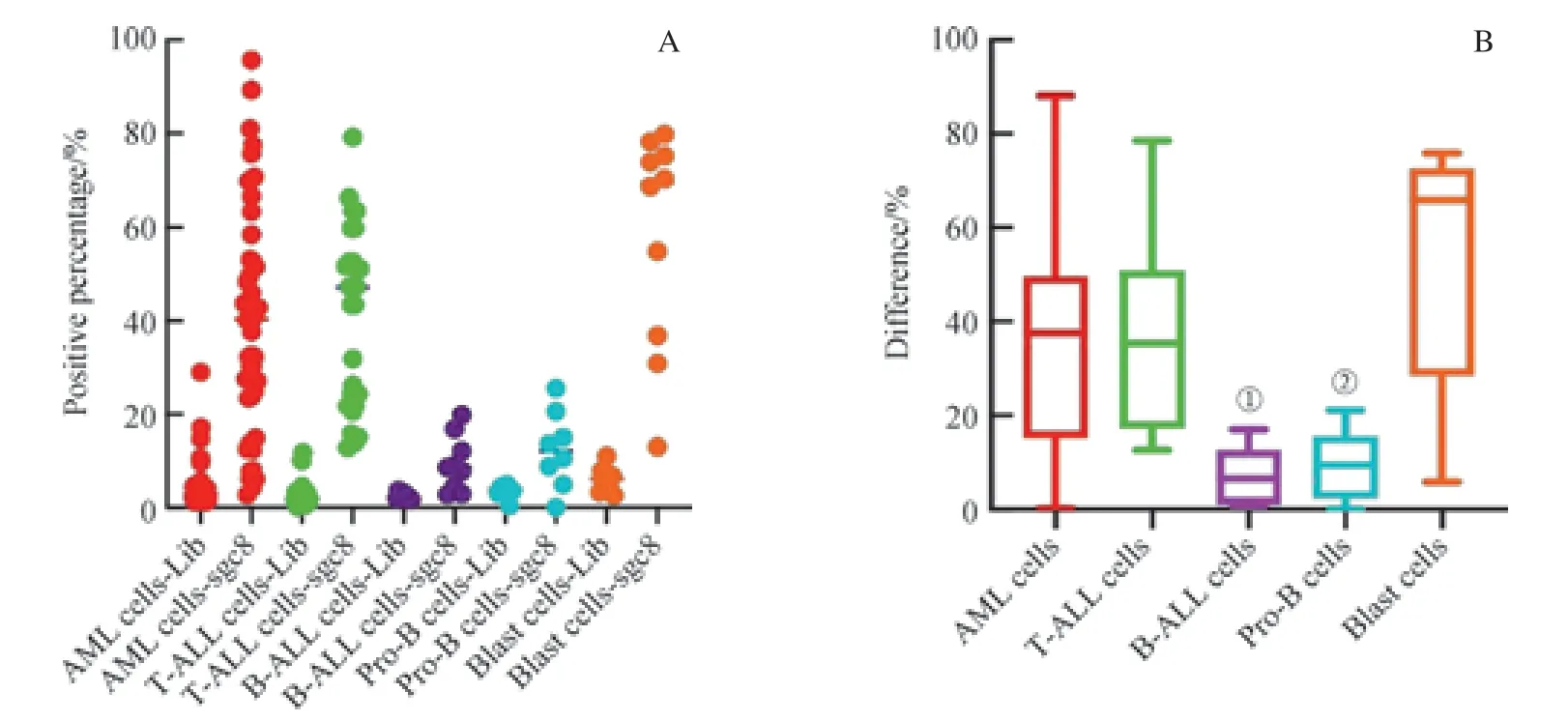
图11 核酸适配体sgc8 对各类AL 肿瘤细胞及正常骨髓(CD34+)早期细胞的识别Fig 11 Recognition of cancer cells in various AL cells and CD34+ cells in normal bone marrow samples by aptamer sgc8
为了研究sgc8 在各类AL 细胞及正常骨髓(CD34+)早期细胞识别能力方面的差异,我们对AML 细胞、T-ALL 细胞、B-ALL 细胞及正常骨髓中CD34+的Blast细胞、Pro-B 细胞进行了研究。我们以Blast 细胞为对照,比较了各群细胞在sgc8 管与Lib 管阳性门内的d值。如图11 所示,我们发现,各群d值的中位数为:Blast细 胞(65.85%) > AML 细 胞(37.50%) > T-ALL 细 胞(35.40%) > Pro-B 细胞(9.45%) > B-ALL 细胞(6.50%)。前三者的d值显著高于后两者,但在Blast 细胞与AML 细胞(P=0.067)和T-ALL 细胞(P=0.067)d值之间的差异无统计学意义;而T-ALL 细胞与B-ALL 细胞(P=0.000)及Pro-B 细胞(P=0.001)的d值之间的差异有统计学意义(P<0.05)。同时,针对sgc8 结合阳性率的研究显示,AML 细胞、T-ALL 细胞及Blast 细胞均有较高的sgc8 识别阳性率,而B-ALL 细胞和Pro-B 细胞的阳性率较低。结果表明,sgc8 对AML 细胞、T-ALL 细胞及Blast 细胞具有较高的识别能力,且它们之间无显著差异;而sgc8 对B-ALL 细胞及Pro-B 细胞无显著识别能力。
3 讨论
Shangguan 等[13]通过质谱分析的方法确定核酸适配体sgc8 主要靶标为PTK7 蛋白,并将PTK7 确定为T-ALL 的潜在生物标志物。Prebet 等[18]的研究表明,在AML 骨髓样本中,有72%的AML 细胞表达PTK7 蛋白。Jiang 等[19]的后续研究表明,在正常骨髓中,PTK7 蛋白表达在髓系前体细胞(CD34+CD117+)上,而较少在不成熟的B 细胞上表达;在3 种主要的AL(AML、B-ALL、T-ALL)中均观察到PTK7 蛋白表达的变化,且PTK7 蛋白的表达水平在AML 细胞和正常骨髓中的对照细胞(Blast 细胞)之间无差异,PTK7 蛋白的表达水平也同样在B-ALL 细胞与正常骨髓不成熟B 细胞之间无差异,但PTK7 蛋白在T-ALL 上高表达,可与其他T 细胞标志物一起用作骨髓T-ALL 的检测标志物。
本研究基于核酸适配体的流式细胞术,利用核酸适配体sgc8 对AL 样本及正常的骨髓样本各群细胞进行检测。我们发现,sgc8 在T-ALL 和AML 骨髓样本中,对肿瘤细胞具有特异性识别能力,而在B-ALL 骨髓中,对各类细胞均未见显著识别;同时,在正常骨髓中,sgc8 对Blast细胞具有特异性识别能力,而对早期B 细胞(Pro-B 和Pre-B 细胞)及其他成熟细胞均无显著识别能力;并且,sgc8 对AML 细胞和正常骨髓Blast 细胞的识别无显著差异,对B-ALL 细胞和正常骨髓早期B 细胞的识别也无显著差异。以上结果与既往报道的PTK7 抗体研究结果较为一致。此外,在AML 各亚型的肿瘤细胞中,sgc8 对M7细胞的识别阳性率要高于其他亚型细胞,而在其他亚型肿瘤细胞之间,sgc8 的识别能力并没有差异。
我们的研究提示,核酸适配体sgc8 在AML、T-ALL和正常骨髓样本中具有特异性识别能力,而对B-ALL 样本无显著识别,且对不同AML 亚型可能具有不同的诊断价值,可以考虑作为AL 的辅助诊断标志。本研究是第一次将核酸适配体应用到AL 临床样本检测,研究表明核酸适配体sgc8 在临床样本中的检测结果与报道的PTK7 抗体的检测结果较为一致。与抗体相比,核酸适配体有较短的开发和生产周期、较低的生产成本、易于人工合成和修饰、批间差异小、化学性质稳定等特点[9],使它更易于被临床应用,而成为一类具有临床应用前景的诊断工具。近年来可用于白血病相关诊疗的核酸适配体也不断出现,如Cibiel 等[20]筛选出针对膜联蛋白A2(Annexin A2)的适配体。据报道,Annexin A2 在急性早幼粒细胞白血病[21]和MLL 重排的婴儿ALL[22]中都高度表达。Joo等[23]报道了核仁蛋白(nucleolin,NCL)的特异性适配体AS1411,可能用于高表达NCL 的急性前体B 淋巴细胞白血病(pre-B ALL)的治疗。可见,核酸适配体不仅可以作为诊断工具用于白血病免疫分型和MRD 监测,还可以开发成为靶向治疗药物。由于样本和时间的限制,本研究仅涉及了核酸适配体sgc8,但实验结果表明这种新型诊断工具在应用前景上具有价值。未来将会有更多具有特异性靶标的核酸适配体用于AL 的流式细胞学诊断,并结合患者的复发风险分级和预后评估,以期发现其更多的临床应用价值。
参·考·文·献
[1] 林果为, 王吉耀, 葛均波. 实用内科学[M]. 北京: 人民卫生出版社, 2017.
[2] 郑荣寿, 孙可欣, 张思维, 等. 2015 年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28.
[3] Griesinger F, Pirò-Noack M, Kaib N, et al. Leukaemia-associated immunophenotypes (LAIP) are observed in 90% of adult and childhood acute lymphoblastic leukaemia: detection in remission marrow predicts outcome[J]. Br J Haematol, 1999, 105(1): 241-255.
[4] Wood BL. Principles of minimal residual disease detection for hematopoietic neoplasms by flow cytometry[J]. Cytometry B Clin Cytom, 2016, 90(1): 47-53.
[5] Oelschlägel U, Nowak R, Schaub A, et al. Shift of aberrant antigen expression at relapse or at treatment failure in acute leukemia[J]. Cytometry, 2000, 42(4): 247-253.
[6] Campana D, Coustan-Smith E. Minimal residual disease studies by flow cytometry in acute leukemia[J]. Acta Haematol, 2004, 112(1/2): 8-15.
[7] Costa AFO, Menezes DL, Pinheiro LHS, et al. Role of new immunophenotypic markers on prognostic and overall survival of acute myeloid leukemia: a systematic review and meta-analysis[J]. Sci Rep, 2017, 7(1): 4138.
[8] Liu J, You MX, Pu Y, et al. Recent developments in protein and cell-targeted aptamer selection and applications[J]. Curr Med Chem, 2011, 18(27): 4117-4125.
[9] Ali MH, Elsherbiny ME, Emara M. Updates on aptamer research[J]. Int J Mol Sci, 2019, 20(10): 2511.
[10] Zhang Y, Lai BS, Juhas M. Recent advances in aptamer discovery and applications[J]. Molecules, 2019, 24(5): 941.
[11] Morita Y, Leslie M, Kameyama H, et al. Aptamer therapeutics in cancer: current and future[J]. Cancers, 2018, 10(3): 80.
[12] Shangguan D, Li Y, Tang Z, et al. Aptamers evolved from live cells as effective molecular probes for cancer study[J]. Proc Natl Acad Sci U S A, 2006, 103(32): 11838-11843.
[13] Shangguan DH, Cao ZH, Meng L, et al. Cell-specific aptamer probes for membrane protein elucidation in cancer cells[J]. J Proteome Res, 2008, 7(5): 2133-2139.
[14] Yu YT, Duan SL, He J, et al. Highly sensitive detection of leukemia cells based on aptamer and quantum dots[J]. Oncol Rep, 2016, 36(2): 886-892.
[15] Mironov GG, Bouzekri A, Watson J, et al. Aptamer-facilitated mass cytometry[J]. Anal Bioanal Chem, 2018, 410(13): 3047-3051.
[16] Tan Y, Li YJ, Tang FQ. Nucleic acid aptamer: a novel potential diagnostic and therapeutic tool for leukemia[J]. Oncotargets Ther, 2019, 12: 10597-10613.
[17] Swerdlow SH, Campo E, Harris NL, et al. World Health Organization classification of tumours of the haematopoietic and lymphoid tissues, 4th[M]. Lyon: International Agency for Research on Cancer, 2017: 212.
[18] Prebet T, Lhoumeau AC, Arnoulet C, et al. The cell polarity PTK7 receptor acts as a modulator of the chemotherapeutic response in acute myeloid leukemia and impairs clinical outcome[J]. Blood, 2010, 116(13): 2315-2323.
[19] Jiang GH, Zhang M, Yue BH, et al. PTK7: a new biomarker for immunophenotypic characterization of maturing T cells and T cell acute lymphoblastic leukemia[J]. Leuk Res, 2012, 36(11): 1347-1353.
[20] Cibiel A, Nguyen Quang N, Gombert K, et al. From ugly duckling to swan: unexpected identification from cell-SELEX of an anti-annexin A2 aptamer targeting tumors[J]. PLoS One, 2014, 9(1): e87002.
[21] Menell JS, Cesarman GM, Jacovina AT, et al. Annexin Ⅱ and bleeding in acute promyelocytic leukemia[J]. N Engl J Med, 1999, 340(13): 994-1004.
[22] Spijkers-Hagelstein JAP, Mimoso Pinhanços S, Schneider P, et al. Src kinaseinduced phosphorylation of annexin A2 mediates glucocorticoid resistance in MLL-rearranged infant acute lymphoblastic leukemia[J]. Leukemia, 2013, 27(5): 1063.
[23] Joo EJ, Wasik BR, Parrish C, et al. Pre-B acute lymphoblastic leukemia expresses cell surface nucleolin as a 9-O-acetylated sialoglycoprotein[J]. Sci Rep, 2018, 8(1): 17174.

